1、金属增材制造胸腰椎融合匹配式假体系统的产品结构及组成
该产品包括胸腰椎融合匹配式假体,以及配合组件钉扣、螺钉。其中胸腰椎融合匹配式假体依据患者胸腰椎解剖结构进行匹配,由符合 GB/T 13810 标准规定的 TC4 钛合金材料,通过增材制造技术制成;钉扣为标准化规格,与胸腰椎融合匹配式假体配合使用,由符合 GB/T 19701.2 标准规定的 2 型超高分子量聚乙烯材料制成;螺钉为标准化规格,与胸腰椎融合匹配式假体配合使用,由符合 GB/T 13810 标准规定的 TC4 钛合金材料机加工制成。胸腰椎融合匹配式假体及螺钉为非灭菌包装。钉扣为灭菌包装,采用辐照灭菌,灭菌有效期 5 年。
2、金属增材制造胸腰椎融合匹配式假体系统的产品适用范围
该产品适用于上胸椎至下腰椎(T1-L5)因肿瘤或其它病变需行连续三个及以上节段椎体切除后的结构重建,需与脊柱内固定系统匹配永久植入。
3、金属增材制造胸腰椎融合匹配式假体系统的工作原理
胸腰椎融合匹配式假体是通过增材制造技术打印的实体与多孔结构,依据患者胸腰椎解剖结构,用于椎体切除后,与脊柱内固定产品配合使用,提供结构性支持。胸腰椎融合匹配式假体上设计钉孔结构,通过超高分子量聚乙烯钉扣,实现脊柱螺钉的固定,与脊柱内固定系统联合使用。产品的实现路径为:医生提供患者 CT 数据以及明确椎体切除范围,工程师将 CT 数据重建出患者三维模型,根据切除范围来设计假体,利用增材制造技术,实现产品的个性化制造。
4、金属增材制造胸腰椎融合匹配式假体系统的产品性能研究
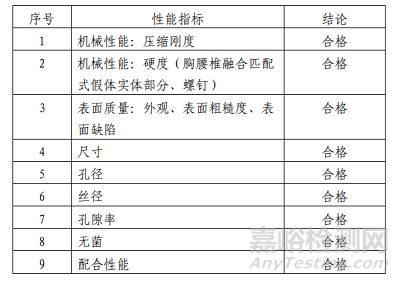
技术要求性能指标如表 2 所示。
材料/化学表征,关于胸腰椎融合匹配式假体组件,开发人开展了 EBM 增材制造钛合金粉末原材料供应商资质、采购合同、材质单、不同摆放方式以及不同批次产品成分验证、成品检验。关于钉扣组件明确了原材料质控要求及成品检验。关于螺钉组件,开发人开展了原材料检验、成品检验。物理和机械性能,开展了胸腰椎融合匹配式假体的力学性能研究,包括静动态的轴向压缩、静动态的剪切、静动态的扭转试验,以及沉陷试验。对于螺钉固定于超高分子量聚乙烯钉扣中,模拟临床使用,开展了螺钉拧入试验,螺钉拔出试验。与预期配合的脊柱内固定系统组合,作用力加载在胸腰椎融合匹配式假体上,进行整体系统动态压缩疲劳试验。考虑螺钉对胸腰椎融合匹配式假体牵拉作用,模拟该情况,作用力加载在脊柱内固定系统上,进行动态压缩疲劳、剪切疲劳和扭转疲劳试验,疲劳后螺钉拔出试验。开展了螺钉与预期配合的脊柱棒、顶丝组件间的动静态性能研究。开展了钉扣与螺钉配合预期是否发生磨损、松动、金属离子析出等情况的研究。明确了各项试验中样品可代表产品最差情形的确定依据,评价各项性能试验结果的临床可接受性。
5、金属增材制造胸腰椎融合匹配式假体系统的生物相容性研究
关于胸腰椎融合匹配式假体组件生物相容性评价,开发人明确了相同打印工艺产品的金属离子析出、细胞毒性研究、耐腐蚀性能研究等,按照 GB/T 16886.1《医疗器械生物学评价 第 1 部分:风险管理过程中的评价与试验》的要求进行了生物学评价,并按照 345 号文的要求与已上市产品进行了比对,同时开展了胸腰椎融合匹配式假体组件的热原与内毒素检测,检验结果符合要求。关于螺钉和钉扣组件,按照 GB/T 16886.1《医疗器械生物学评价 第 1 部分:风险管理过程中的评价与试验》的要求进行了生物学评价,其中对于钉扣组件,开展了原材料细胞毒性、迟发型超敏反应和原发性皮肤刺激测试。经评价,产品生物学风险可接受。
6、金属增材制造胸腰椎融合匹配式假体系统的灭菌研究
该产品胸腰椎融合匹配式假体和螺钉组件为非灭菌提供,钉扣组件为辐照灭菌、无菌状态提供。开发人开展了使用者湿热灭菌确认报告以及生产企业辐照灭菌确认,证明无菌保证水平可达 10-6。
7、金属增材制造胸腰椎融合匹配式假体系统的产品有效期和包装
该产品钉扣组件的货架有效期为五年。开发人开展了产品稳定性研究、包装系统加速老化货架有效期验证以及模拟运输验证。
8、金属增材制造胸腰椎融合匹配式假体系统的动物研究
开发人结合产品特点,模拟临床应用开展了小尾寒羊动物试验研究,进行了组织学、影像学对比观察和离体动物标本的生物力学测试对比,验证了多孔结构设计参数的有效性及骨生长效果。
9、其他
该产品胸腰椎融合匹配式假体组件采用增材制造工艺制成,开发人开展了粉末原材料及产品质量控制、工艺稳定性等研究,包括粉末重复使用、打印软件、打印工艺、打印后处理工艺及清洗工艺验证等。开发人遵循《医疗器械生产质量管理规范》及其相关指导原则,明确了医生及工程师之间的互动模式和职责要求,明确设计开发流程,并设定系统评审。开发人根据既往备案病例的医工交互文件,如医工交互记录、需求制作订单、产品确认单等,确定了产品设计规范。