今日头条
海思科长效DPP-4抑制剂报产。海思科二肽基肽酶-4(DPP-4)超长效抑制剂HSK7653片的上市申请获CDE受理,拟用于2型糖尿病治疗。2022年8月,海思科宣布HSK7653已完成两项III期临床试验。两项试验共入组超过900例2型糖尿病患者,试验结果均达到预设终点。如果获批,该新药有望成为全球首个降糖药双周制剂,为患者提供一个更优的治疗选择。
国内药讯
1.辉大眼科基因疗法获FDA临床批件。辉大(上海)生物宣布其首个基因治疗产品HG004已获得FDA临床许可,即将开展国际多队列、剂量探索性研究,评估单次注射用于RPE65基因突变引起的相关性视网膜病变成人及儿童患者的安全性、耐受性和初步有效性。在临床前Rpe65基因敲除小鼠模型中,单次注射后第17周,HG004与AAV2产品相比,小鼠视网膜功能恢复分别提高67.6%和35.8%。
2.传奇生物BCMA CAR-T国际III期临床积极。传奇生物靶向BCMA的CAR-T疗法Carvykti(西达基奥仑赛,Cilta-cel)用于既往接受过1-3线治疗(包括蛋白酶体抑制剂和免疫调节药物)且来那度胺耐药的多发性骨髓瘤患者的III期临床CARTITUDE-4(NCT04181827)达到主要终点。与泊马度胺、硼替佐米和地塞米松(PVd)或达雷妥尤单抗(CD38单抗)、泊马度胺和地塞米松(DPd)相比,Cilta-cel显著改善患者的无进展生存期(PFS)。详细结果将于医学会议上公布。
3.晨泰可入脑EGFR抑制剂报产。晨泰医药与阿斯利康合作开发的EGFR抑制剂佐利替尼(zorifertinib/AZD3759)的上市申请获CDE受理,用于治疗晚期非小细胞肺癌伴中枢神经系统转移患者。zorifertinib是一款新一代EGFR-TKI药物,具有高达100%的血脑屏障透过率。此前,晨泰医药宣布佐利替尼的II/III期EVEREST研究完成最后1例受试者的末次访视,将基于该研究结果提交上市申请。该研究的主要研究者为吴一龙教授。
4.科州MEK抑制剂拟纳入优先审评。科州制药1类新药MEK抑制剂妥拉美替尼(HL-085)获CDE拟纳入优先审评,用于治疗既往接受过免疫治疗的携带NRAS突变的晚期黑色素瘤患者。公布于ASCO 2020会议上的I/II期临床结果显示,HL-085在可评估患者中的最佳客观缓解率(ORR)为33.3%,疾病控制率为83.3%,中位无进展生存期为17.4周。
5.歌礼RdRp抑制剂国内获批猴痘临床。歌礼口服病毒聚合酶抑制剂ASC10获国家药监局临床默示许可,拟针对猴痘适应症开展临床研究。临床前研究显示,ASC10-A具有广谱抗病毒活性,对包括猴痘病毒等在内多种病毒均具有强效抗病毒活性。在美国,FDA已批准该药物在美国开展用于猴痘适应症的Ⅰb期临床试验。
6.固安鼎泰三靶点DNA肿瘤疫苗获批临床。固安鼎泰海规生物1类生物制品NMM肿瘤治疗性DNA疫苗裸质粒注射液获国家药监局临床默示许可,拟用于晚期实体瘤和复发、难治性淋巴瘤的治疗。去年4月,该公司获得一项名为《 一种抗肿瘤重组NMM融合抗原质粒DNA疫苗》的专利授权(CN109081873B);该项发明设计和构建一种融合有3个肿瘤抗原靶点(NY-ESO-1, MUC1,MAGE-A3)的重组质粒DNA(pNMM)疫苗。
国际药讯
1.礼来非共价BTK抑制剂获FDA加速批准。礼来旗下Loxo Oncology公司非共价BTK抑制剂Jaypirca(pirtobrutinib)获FDA加速批准,用于治疗BTK抑制剂经治、复发/难治性套细胞淋巴瘤(MCL)患者。在Ⅰ/Ⅱ期BRUIN临床中,pirtobrutinib在这类难治性患者中达到50%(95% CI:41-59)的缓解率,分别有13%与38%的患者达成完全与部分缓解。患者的中位DOR为8.3个月(95% CI:5.7-尚无法评估)。Jaypirca是首个针对BTK抗性癌症的BTK抑制剂。
2.FDA批准K药辅助治疗NSCLC。默沙东PD-1单抗帕博利珠单抗(Keytruda)获FDA 批准新适应症,用于IB期(T2a≥4cm)、II或IIIA期非小细胞肺癌 (NSCLC)患者切除和铂类化疗后的辅助治疗。在关键Ⅲ期临床KEYNOTE-091中,与安慰剂相比,无论肿瘤PD-L1的表达量如何,Keytruda均可增加患者的无病生存期(DFS)。对于接受辅助化疗的患者,Keytruda组的中位DFS为58.7个月,安慰剂组为34.9个月(风险比=0.73;95%CI:0.60-0.89)。
3.KIT/PDGFRα抑制剂获FDA优先审评资格。FDA受理Blueprint公司口服KIT/PDGFRα抑制剂Ayvakit(avapritinib)的补充新药申请并授予其优先审评资格,用于治疗惰性系统性肥大细胞增多症成人患者。预计今年5月22日之前公布审评结果。在注册PIONEER临床(NCT03731260)中,与对照组相比,Ayvakit治疗组24周时患者的平均TSS改变具有统计学显著改善(下降15.6分vs下降9.2分,p=0.003)。基石拥有该新药的大中华区权益。
4.BMS靶向CD19自体CAR-T早期临床积极。百时美施贵宝靶向CD19的CAR-T疗法Breyanzi(lisocabtagene maraleucel)治疗复发/难治性(R/R)慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)的Ⅰ/Ⅱ期临床达到主要终点。与历史对照组相比,Breyanzi显著改善患者的完全缓解率。2021年2月,FDA已批准该新药用于治疗接受过两种或以上系统治疗的复发/难治性大B细胞淋巴瘤(LBCL)成人患者。
5.Aβ蛋白疫苗早期临床积极。AC Immune公司抗Aβ疫苗ACI-24.060用于治疗前驱期(prodromal)阿尔茨海默病患者的Ⅰ/Ⅱ期临床结果积极。ACI-24.060旨在激发针对Aβ寡聚体和焦谷氨酸Aβ的多克隆抗体反应,抑制淀粉样蛋白斑块形成。中期结果显示,二剂低剂量ACI-24.060两周后就激发抗Aβ抗体反应,疫苗总体耐受性良好。目前,接种高剂量的AD患者队列已启动,试验将扩展至包括唐氏综合症患者。
6.强生撤回伊布替尼治疗MSL的NDA。强生日前在欧盟撤回BTK抑制剂伊布替尼(Imbruvica)联合苯达莫司汀与利妥昔单抗一线治疗套细胞淋巴瘤(MCL)患者的新适应症上市申请。原因是人用药品委员会认为Imbruvica的研究数据不足以支持该适应症中的应用。在III期SHINE研究中,中位随访84.7个月时,伊布替尼组的中位无进展生存期为80.6个月,安慰剂组为52.9个月(HR=0.75;95%Cl:0.59-0.96;P=0.01)。
医药热点
1.全国整体疫情已进入低流行水平。1月30日,国务院联防联控机制举行新闻发布会。国家卫健委新闻发言人米锋介绍:春节期间,国务院联防联控机制相关部门持续做好服务保障,广大医务人员和各行业工作者坚守岗位,防控工作平稳有序,“乙类乙管”措施落地见效。目前全国整体疫情已进入低流行水平,各地疫情保持稳步下降态势。
2.98%以上县市达到麻风消除目标。1月29日是第70届“世界防治麻风病日”暨第36届“中国麻风节”。今年世界防治麻风病日活动的主题为“弘扬时代精神,消除麻风危害”。国家疾控局当日发布消息称,我国消除麻风危害目前进入新阶段,全国98%以上的县(市)达到消除目标。
3.WHO更新应对辐射和核紧急情况药物清单。1月27日,世界卫生组织在其官网更新了应对辐射和核紧急情况建议储备的药物清单。根据清单,典型的辐射应急储备包括以下药物:稳定碘(用于阻止或减少甲状腺对放射性碘的吸收)、普鲁士蓝(去除人体内部的放射性物质铯和铊)、螯合剂(对一些金属及放射性元素有促排作用)、含铝抗酸剂和藻酸盐(增加放射性锶的排出)、碳酸氢钠、生长因子、昂丹司琼、洛派丁胺等和其他用于治疗呕吐、腹泻和感染的药物。
评审动态
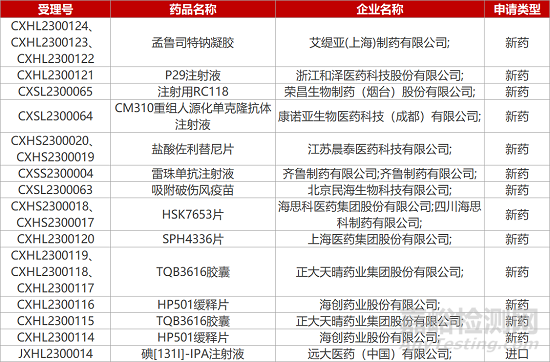
1. CDE新药受理情况(01月31日)
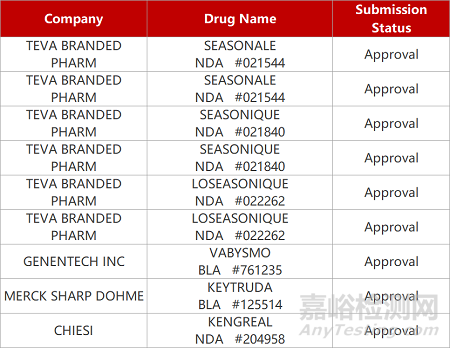
2. FDA新药获批情况(北美01月27日)