刚刚,国家药监局器审中心发布《应用纳米材料的医疗器械安全性和有效性评价指导原则 第三部分:生物相容性/毒理学评价(征求意见稿)》,全文如下:
应用纳米材料的医疗器械安全性和有效性评价指导原则第三部分:生物相容性/毒理学评价
(征求意见稿)
一、背景
本指导原则为注册申请人/监管人员提供关于应用纳米材料的医疗器械生物相容性/毒理学评价相关方面的信息。
本指导原则是对应用纳米材料医疗器械生物相容性/毒理学评价的一般要求,注册申请人应依据具体产品的特性对注册申报资料的内容进行充分说明和细化。注册申请人还应依据具体产品的特性确定其中的具体内容是否适用,若不适用,需详细阐述理由及相应的科学依据。
本指导原则是对注册申请人和审评人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能满足相关法规要求的其它方法,也可以采用,但是需要提供详细的研究资料和验证资料。应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将进行适时的调整。
二、适用范围
本指导原则适用于与人体直接或间接接触,由纳米材料组成或包含纳米材料的医疗器械的生物相容性/毒理学评价。
不适用于:
- 应用纳米材料的体外诊断(In Vitro Diagnosis,IVD)产品;
- 应用纳米材料的赋能技术(如纳米机器人);
- 应用纳米材料的药品;
- 应用纳米材料的医疗器械在制造和废弃过程中造成的职业和环境风险。
三、医疗器械中与纳米材料相关的风险识别和风险评估的层级评价方法
本指导原则描述的应用纳米材料的医疗器械,是指注册申请人在医疗器械产品中应用了纳米材料/纳米结构,且该纳米材料/纳米结构被设计为发挥预期功能。此类医疗器械的生物学评价应首先执行GB/T 16886系列标准文件及医疗器械法律法规的内容,再结合本指导原则描述的纳米材料特殊考虑点进行相关研究。纳米材料的安全风险与常规材料不同,主要取决于纳米材料的化学成分、物理化学性质、纳米特性、纳米结构与形貌、与组织相互作用方式以及暴露途径与水平等。相比于常规材料,纳米材料在样品制备时会有溶解性和分散性的区别,以及稳定性和均一性的要求,因此可能需要考虑纳米材料在样品制备时的特殊性;由于纳米材料被认为可能穿越所有生物屏障,包括血脑屏障和胎盘屏障等,因此可能需要考虑纳米材料的全身毒性,特别是中枢神经系统毒性和生殖/发育毒性;“纳米蛋白冠”的形成,可能会影响其生物响应、动力学、蓄积和毒性等生理效应;有些纳米材料具有类佐剂特性,可能会对免疫系统产生影响,需要关注免疫毒性;纳米材料被单核吞噬细胞系统清除、在特定组织器官分布、形成纳米蛋白冠等可能改变其毒代动力学特征。因此,应用纳米材料的医疗器械生物学评价内容,在兼顾GB/T 16886系列标准文件中关于常规器械评价内容的基础上,重点考虑与纳米材料有关的其他问题,如样品制备,吸收、分布、代谢和排泄/清除(ADME)、中枢神经系统毒性和免疫毒性等。对应用纳米材料的医疗器械进行生物相容性/毒理学评价时,需根据GB/T 16886.1附录A中描述的生物学评价框架开展评价,并参考ISO/TR 10993.22(等同转化为GB/Z 16886.22)、本指导原则第四章及附录一中所描述的纳米材料特殊考虑点设计研究/试验方案。
在对应用纳米材料的医疗器械进行生物学评价时,如果纳米材料吸收和分布导致纳米材料的内部暴露、反应活性或代谢动力学或生物持久性发生改变时,可能触发进一步的试验,用于研究非常规的评价终点(如中枢神经系统、免疫系统功能终点)。
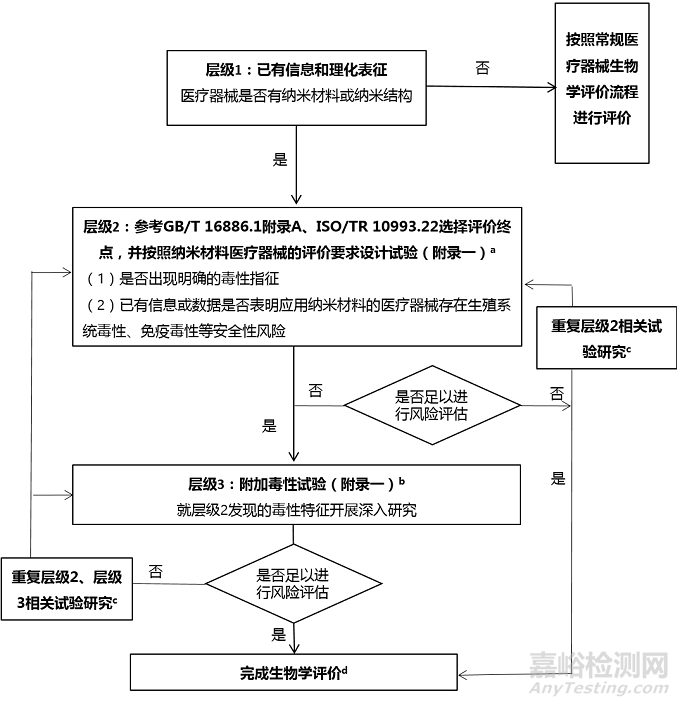
为了生成有效的毒理学数据用于应用纳米材料的医疗器械的风险识别和风险评估,更加高效地识别和评价特定风险,本指导原则提供了层级研究方法,用于逐步对应用纳米材料的医疗器械中与纳米材料相关的安全风险开展识别和评估。
层级1:如注册申请人在医疗器械生产制造过程中使用了纳米材料或纳米结构,且该纳米材料或纳米结构预期在终产品中发挥作用,应根据医疗器械已有信息和理化表征结果判断终产品中是否有纳米材料或纳米结构,若判断无纳米材料或纳米结构,则按照常规医疗器械的生物相容性/毒理学评价研究流程进行;若判断有纳米材料或纳米结构,则进行层级2的研究。目前,基于当前科学技术水平和认知,评估应用纳米材料的医疗器械中纳米材料或纳米结构暴露可能性的评价方法和技术手段还不够完善,若应用纳米材料的医疗器械中存在纳米材料或纳米结构,难以排除无暴露的可能性,仍需通过生物相容性/毒理学评价来评估纳米材料的安全风险。
层级2:主要针对常规评价终点进行研究/试验,同时增加特殊指标的检测,考察是否有潜在的特殊毒性风险,如免疫毒性、中枢神经系统毒性等,来决定是否有必要进行深入研究。层级2的步骤如下:参考GB/T 16886.1附录A选择评价终点,并按照应用纳米材料的医疗器械评价要求设计试验,具体参见本指导原则附录一。GB/T 16886.1附录A列出了一个制定生物学评价的框架,除适用于常规医疗器械外,也适用于应用纳米材料的医疗器械。但由于纳米材料或纳米结构可能引发非预期的生物学效应,若已有信息或数据证明应用纳米材料的医疗器械在某些生物学评价终点有额外的安全风险考虑点,可在层级2增加相关研究内容。因此,注册申请人应结合纳米材料的纳米特性及暴露特征,基于个案处理的原则,提供评价终点选择的理由,并阐述评价终点选择的科学性和合理性。
以下内容为纳米材料生物相容性与常规材料生物相容性研究差异性的举例,具体内容详见附录一:
细胞毒性:根据细胞摄取纳米材料的能力,以及纳米材料与细胞的相互作用模式考虑需增加的试验。若常规细胞(如L929成纤维细胞)不足以代表纳米材料在靶器官、接触部位细胞、免疫细胞的摄取及生物效应,应考虑使用其他合适的细胞进行试验,如肝、肾为潜在靶器官时,可选择HepG2人源肝癌细胞、LLC-PK1猪肾近曲小管细胞、人源THP衍生巨噬细胞等进行试验。
致敏反应:若纳米材料可穿透皮肤表层,仅进行GPMT试验不足以评价纳米材料的致敏反应,可考虑增加体外替代方法并验证方法的适用性,如直接肽反应性测定法(DPRA)、人细胞系激活试验(H-CLAT)、KeratinoSens和SenCeeTox等方法。
亚慢性全身毒性:根据层级评价方法,该试验建议增加附加毒性终点相关检测指标,如生殖系统毒性、中枢神经系统毒性、免疫毒性、内分泌系统毒性等终点的相关敏感指标的检测。
慢性毒性、致癌性、生殖/发育毒性、中枢神经系统毒性、免疫毒性、内分泌干扰等附加毒性终点一般不作为层级2的首批评价终点,但需在层级2的其他试验中增加与上述终点相关的敏感指标的检测,作为进入层级3的依据,如在亚慢性全身毒性试验中增加中枢神经系统的功能观察组合指标的检测,考察应用纳米材料的医疗器械是否有潜在中枢神经系统毒性。
若层级2的研究结果未发现附加毒性终点相关毒性指征的改变,一般无需进入层级3的研究,而是考察层级2的研究结果是否足以进行生物相容性/毒理学风险评估,若不足以进行生物相容性/毒理学风险评估,则需修正试验条件重复层级2相关研究内容,直至完成生物学评价,或根据研究结果停止生物学评价研究。
若层级2研究结果提示明确的附加毒性终点相关毒性指征,则进入层级3的研究。这些毒性指征包括但不限于纳米材料存在消除缓慢、在特定的组织器官内有蓄积的潜力、需要更长时间的代谢数据,或毒性特征提示需要关注特定组织/器官的毒性等。此外,若已有信息或数据证明应用纳米材料的医疗器械存在生殖系统毒性、免疫毒性等安全性风险时,需考虑直接进行层级3的相关研究。
层级3:是对层级2中发现的应用纳米材料的医疗器械附加毒性终点相关毒性指征发生明显改变时,开展与毒性指征相对应的全面的特殊试验,如生殖/发育毒性试验、致癌性试验、免疫毒性试验、中枢神经系统毒性试验、或内分泌干扰试验等,参见本指导原则附录一,同时考察关键组织、器官中纳米材料暴露量、分布和蓄积特征。注册申请人应结合纳米材料的纳米特性及暴露特征,基于个案处理的原则,提供评价终点选择的理由,并阐述评价终点选择的科学性和合理性。
完成层级3的研究后,结合层级2和层级3的研究结果考察是否足以进行生物相容性/毒理学风险评估。若层级2、层级3的研究结果足以进行生物相容性/毒理学风险评估,不必再进行其他试验;否则应重复层级2或层级3的相应研究内容,直至完成生物学评价,或根据研究结果停止生物学评价研究。
图1 医疗器械中与应用纳米材料相关的风险识别和风险评估的层级评价方法流程图
a. 现有GB/T 16886.1 附录A,以及ISO/TR 10993.22所提供的框架用于评价应用纳米的医疗器械的生物相容性/毒理学是有限的,需要结合其纳米特性和暴露特征考虑增加评价终点。
b. 如层级2研究结果提示应用纳米材料的医疗器械存在安全性风险,如蓄积、特定器官或系统毒性、则在层级3中针对层级2的发现进行进一步研究。如层级2中发现生殖器官有纳米材料分布,应在层级3中开展对生殖功能影响等毒性试验。
c. 如果出现以下情况,需要考虑重复进行层级2或层级3相关试验研究,如完善试验设计、试验结果存在争议、试验结果提示需要补充研究内容等。
d. 完成生物学评价后,可进行产品的获益-风险评价,或者停止生物学评价,对产品重新进行研究和开发。
四、生物相容性/毒理学评价
(一)引言
对应用纳米材料的医疗器械的生物相容性/毒理学开展的评价包括文献综述、生物信息学、体外和体内等一系列研究。对于医疗器械,任何试验的选择策略均基于其预期用途/适用范围。体内研究应采用与医疗器械和/或纳米材料人体暴露途径相关的接触途径进行。所有试验均应按照现行/有效的最佳实验室/治疗规范进行,数据应由经过培训且有经验的专业人员进行分析解读。对应用纳米材料的医疗器械的生物相容性/毒理学评价应依据以下原则:
1.进行多层级评价研究
应用纳米材料的医疗器械生物相容性/毒理学测试策略由其潜在外部和内部暴露特征决定。当理化表征及暴露评估确定医疗器械有纳米材料或纳米结构暴露的可能性时,除按照GB/T 16886系列国家标准的要求进行相应的试验外,还应基于纳米材料风险评估的要求,参考ISO/TR 10993.22,按照与纳米材料相关的风险识别和风险评估的层级评价方法流程图进行多层级评价研究,考虑是否增加额外毒性关注指标,以及深入开展附加毒性试验。
2.遵循个案处理原则
按照GB/T 16886.1的要求,医疗器械的生物学评价试验策略均应基于医疗器械分类、接触性质和暴露持续时间等进行考虑。由于应用纳米材料的医疗器械情况复杂,本指导原则不可能涵盖所有应用纳米材料的医疗器械生物相容性/毒理学评价的全部内容。针对某一具体产品,其生物相容性/毒理学评价应遵循个案处理的原则。
3.确认测试系统的适用性
纳米材料的溶解或分散状态、样品制备方法、剂量设计、细胞品系、动物种属等测试系统参数都可能影响试验结果的可靠性,故需确认测试系统是否适用于评价应用纳米材料的医疗器械。目前可用于应用纳米材料的医疗器械生物学评价的专属试验方法尚在开发中,可参考的试验方法较少,已发布并正式实施的相关标准主要包括内毒素试验(GB/T 41309、YY/T 1295)、细胞毒性试验(GB/T 41212、GB/T 41915、YY/T 0993)、体外溶血试验(YY/T 1532)。因此,注册申请人应确认测试系统的适用性,提供适合所申报产品特点的生物学评价资料。一些体外试验可能对于筛选目的及作用机制的研究是有用的,但这些方法的使用必须基于个案处理原则。目前经过确认的体外方法参见欧洲替代方法验证中心(EURL ECVAM)发布的方法。
4.生物组织中纳米材料的表征原则
纳米材料和生物组织中的生物分子相互作用可能获得新“生物学特征”,即在表面吸附蛋白质等生物分子(蛋白冠、生物冠)时产生的新性质,可影响机体的生理响应及毒理学特征。因此,纳米材料在试验条件下的实际存在形式、特性和稳定性等信息对于任何试验结果的解释都是至关重要的。应在试验开始和结束时(若可行)对生物组织中的纳米材料进行表征。
5.毒代动力学数据判定原则
证明纳米材料在细胞和/或组织中有暴露是解释研究结果的关键(特别是阴性结果),缺乏这类数据对得出最终结论可能造成很大的不确定性。因此,在技术可行的情况下,应确定纳米材料是否分布在组织或细胞的特定区域,明确在试验系统中的暴露量。
(二)应用纳米材料医疗器械生物学评价试验的核心关注点
1.样品制备
溶解和分散:纳米材料与溶解的化学物质不同,通常为不溶或部分溶解的纳米颗粒以混悬/分散和/或更大的团聚和聚集状态存在。试验介质/制剂(及其成分)可能影响纳米材料的特性和性能。当采用体内或体外方法对不溶或部分溶解纳米颗粒进行测试时,一定要重点考虑纳米材料在介质中的分散状态。
样品制备:取样和样品制备通常是整个分析过程中至关重要的步骤,也是结果不确定性的最大可能来源。纳米材料样品制备中的一个关键问题是颗粒的适当分散。目前尚无专门应对纳米材料样品制备的标准文件,注册申请人可参考GB/T 16886.12提供的样品制备通用要求进行样品制备。此外,建议注册申请人对样品制备的分散效率和稳定性进行测试并记录。
2.浓度/剂量
纳米材料浓度/剂量可能在试验期间因团聚、聚集、沉淀、与试验介质中其他物质结合,或在玻璃/塑料容器上吸附而降低。为了确保在试验期间使用的浓度/剂量可以保持稳定,任何体内、体外毒性试验应特别关注纳米材料的团聚/聚集、解聚和重聚集行为,以及纳米材料的不溶/部分溶解性质,考察纳米材料在试验介质中的稳定性和均一性,以确保所用的纳米材料的浓度/剂量与预期一致。
此外,在特定的试验方法中,使用过高的浓度或剂量可能会改变纳米材料的物理化学特性(如形成团聚体等次级粒子),导致吸收、毒性降低,甚至获得与材料固有毒性无关的结果,如吸入研究中过度负荷剂量、遗传毒性中过高浓度导致细胞毒性等。因此,应避免使用过高的浓度或剂量。
3.剂量单位
常规材料通常使用重量或体积单位剂量进行检测、表示以及风险评估(例如mg/kg,或mg/L)。然而,对于纳米材料来说,潜在生物相互作用不直接依赖于分子的浓度或数量,而依赖于纳米材料/纳米物体本身。纳米毒理学的剂量-反应关系可能不是传统的质量或浓度单位,而是纳米物体数量或纳米材料/纳米物体的总表面积。因此,使用比表面积或颗粒数量剂量单位描述剂量-反应关系可能更加合适,也可使用纳米材料表征中得出的其他参数来表示剂量。在合适的参数识别出来之前,重要的是描述不同的剂量度量,如质量/体积浓度、颗粒数量浓度、比表面积等,为基于质量的剂量换算成其他参数提供足够的信息。
4.对试验系统的干扰
内毒素的干扰:纳米材料分散体系中存在的内毒素可能干扰试验系统,并随试验系统的不同导致假阴性或假阳性结果。
对基于光学试验方法的干扰:纳米材料可能与试验系统或试剂相互作用,特别是在比色试验中(例如用于细胞活性试验的磺酰罗丹明B,或MTT)。另外,一些纳米材料本身对光有散射/吸收,也可能干扰比色试验测定。这些因素需要在使用比色方法时加以考虑。
与生物分子作用:试验系统中的蛋白质/生物介质(如细胞因子)也可能吸附到纳米材料表面,造成低响应甚至是假阴性结果。
对于此类问题,建议增加合适的对照品或对现有方法进行调整。例如,纳米材料已被证明可干扰基于四唑化合物的试验,如MTS和MTT法的吸光度检测。可在读数前通过离心除去纳米材料,以降低由纳米材料产生的数据变异度。
5.可能的毒性机制
解离离子的毒性:一些金属(银)、金属氧化物(氧化锌)或无机非金属/陶瓷材料在生物介质中会(缓慢)溶解/降解,检测的部分(或全部)毒性效应可能都源于溶解/降解产生的离子。对于这类纳米材料,应在试验之前和试验期间测定溶解/降解的部分所占比例,并增加合适的离子形式对照组。
与尺寸相关的毒性:纳米材料的毒性可能源自其尺寸效应,易于进入生物系统,被炎性细胞吞噬,特别是巨噬细胞和多核嗜中性粒细胞。纳米材料可吸附蛋白质和多肽形成新的蛋白质复合物,或改变蛋白质结构,促进蛋白质降解,触发炎性细胞的应答过程。因此,应关注尺寸效应与毒性的相关性,以进行风险评估。
纳米材料形貌对吞噬作用的影响:纳米材料的软硬度、刚性、拓扑结构对细胞摄取、细胞内定位、细胞内吞机制均具有影响。例如,球状纳米颗粒被细胞内吞的过程比棒状或纤维状纳米材料容易和迅速。对于这类纳米材料,应关注不同纳米形貌结构对细胞摄取与毒性的影响。
(三)生物相容性/毒理学试验
本指导原则旨在为经过培训的专业人员提供在医疗器械评价方面对应用纳米材料的医疗器械进行生物相容性/毒理学评价的通用方法,并在附录一中讨论如何基于GB/T 16886系列标准文件、ISO/TR 10993.22,及应用纳米材料的医疗器械特殊考虑点来设计试验,包括试验设计、细胞/动物模型选择、研究终点选择、结果解释等内容。
本指导原则代表了现有认知水平下监管部门对应用纳米材料的医疗器械生物相容性/毒理学评价终点的考虑及应对措施,未来随着毒理学和纳米材料转归方面的认知增长,更多试验方法的缺陷可能会显现出来,本指导原则的内容将随着纳米材料生物相容性/毒理学评价研究的不断推进而完善。因此,建议注册申请人关注研究最新进展,并在开展应用纳米材料的医疗器械生物相容性/毒理学评价时加以考虑,以保持对应用纳米材料的医疗器械生物学评价最新技术的持续更新。
五、参考文献
1. 欧盟新兴与新识别健康风险委员会《医疗器械中应用的纳米材料潜在健康效应指导原则》Guidance on the Determination of Potential Health Effects of Nanomaterials Used in Medical Devices, Scientific Committee on Emerging and Newly Identified Health Risks (SCENIHR)2015
2. ISO/TR 10993.22: 2017(等同转化为GB/Z 16886.22)医疗器械生物学评价第22部分:纳米材料指南
3. GB/T 16886.1-2022医疗器械生物学评价第1部分:风险管理过程中的评价与试验
4. 欧洲替代方法验证中心(EURL ECVAM):
https://joint-research-centre.ec.europa.eu/eu-reference-laboratory-alternatives-animal-testing-eurl-ecvam/alternative-methods-toxicity-testing/validated-test-methods-health-effects_en
5. GB/T 16886.12-2017医疗器械生物学评价第12部分:样品制备与参照材料
6. GB/T 16886.5-2017医疗器械生物学评价第5部分:体外细胞毒性试验
7. YY/T 0993-2015医疗器械生物学评价纳米材料:体外细胞毒性试验(MTT试验和LDH试验)
8. ASTM E2526-08(2013) Standard Test Method for Evaluation of Cytotoxicity of Nanoparticulate Materials in Porcine Kidney Cells and Human Hepatocarcinoma Cells
9. GB/T 16886.3-2019医疗器械生物学评价第3部分:遗传毒性、致癌性和生殖毒性试验
10. YY/T 0870.3-2019 医疗器械遗传毒性试验第3部分:用小鼠淋巴瘤细胞进行的TK基因突变试验
11. OECD 476 In vitro Mammalian Cell Gene Mutation Test
12. YY/T 0870.6-2019 医疗器械遗传毒性试验第6部分:体外哺乳动物细胞微核试验
13. YY/T 0870.2-2019 医疗器械遗传毒性试验第2部分:体外哺乳动物细胞染色体畸变试验
14. YY/T 0870.4-2014医疗器械遗传毒性试验第4部分:哺乳动物骨髓红细胞微核试验
15. YY/T 0870.5-2014 医疗器械遗传毒性试验第5部分哺乳动物骨髓染色体畸变试验
16. OECD 489 In vivo Mammalian Alkaline Comet Assay
17. OECD 483 Mammalian Spermatogonial Chromosomal Aberration Test
18. OECD 488 Transgenic Rodent Somatic and Germ Cell Gene Mutation Assays
19. GB/T 16886.11-2021医疗器械生物学评价第11部分:全身毒性试验
20. GB/T 21804-2008 化学品急性经口毒性固定剂量试验方法
21. GB/T 21757-2008 化学品急性经口毒性试验急性毒性分类法
22. GB/T 21826-2008 化学品急性经口毒性试验方法上下增减剂量法
23. GB/T 21605-2008 化学品急性吸入毒性试验方法
24. GB/T 28648-2012 化学品急性吸入毒性试验急性毒性分类法
25. GB/T 21606-2022 化学品急性经皮毒性试验方法
26. GB/T 21604-2008 化学品急性皮肤刺激性/腐蚀性试验方法
27. GB/T 16886.10-2017医疗器械生物学评价第10部分:刺激与皮肤致敏试验
28. OECD 430 In vitro Skin Corrosion Transcutaneous Electrical Resistance Test (TER)
29. OECD 431 In vitro Skin Corrosion: Reconstructed Human Epidermis (RhE) Test Method
30. GB/T 16886.4-2022医疗器械生物学评价第4部分:与血液相互作用试验选择
31. YY/T 1532-2017 医疗器械生物学评价纳米材料溶血试验
32. GB/T 16886.16-2021医疗器械生物学评价第16部分:降解产物与可沥滤物毒代动力学研究设计
33. YY/T 1295-2015 医疗器械生物学评价纳米材料:细菌内毒素试验
34. GB/T 16886.6-2022医疗器械生物学评价第6部分:植入后局部反应试验
35. OECD 421 Reproductive toxicity screening test
36. OECD 414 Prenatal Developmental Toxicity Test
37. OECD 415 One Generation Reproduction Toxicity Study
38. OECD 416 Two Generation Reproduction Toxicity Study
39. OECD 422 Combined Repeated Dose Toxicity Study
40. Guidance on risk assessment of the application of nanoscience and nanotechnologies in the food and feed chain: Part 1, human and animal health
41. 纳米药物非临床安全性研究技术指导原则(试行)
42. 药物遗传毒性研究技术指导原则
43. ISO/TR 22019:2019 Nanotechnologies—Considerations for performing toxicokinetic studies with nanomaterials
44. ICH S1B 药物致癌性试验
45. ICH S5(R3) 人用药物生殖与发育毒性检测
六、编写单位
本指导原则由国家药品监督管理局医疗器械技术审评中心牵头,国家纳米科学中心、广东粤港澳大湾区国家纳米科技创新研究院、山东省医疗器械和药品包装检验研究院、中国食品药品检定研究院参与编写,由国家药品监督管理局医疗器械技术审评中心负责解释。
附录一 应用纳米材料的医疗器械生物相容性/毒理学研究相关内容
(一)细胞毒性试验
作为生物相容性/毒理学评价的一部分,细胞毒性试验的结果可以作为纳米材料潜在暴露和危害的证据,并确定其作用机制,有助于体内试验的设计和解释。可按照GB/T 16886.5、YY/T 0993和ASTM E2526的要求,根据已有的数据和暴露信息合理开展应用纳米材料的医疗器械的细胞毒性试验。
纳米材料的细胞毒性依赖于细胞对其敏感性、特定受体的存在或摄取机制。纳米材料可通过氧化应激诱导细胞毒性,并在进入细胞后与细胞内不同成分相互作用并干扰细胞功能。此外,纳米材料也可能通过离子释放引起细胞毒性。根据应用纳米材料的医疗器械的预期接触部位和可能接触的细胞类型,一般可选择非吞噬性细胞(如3T3小鼠成纤维细胞,L929小鼠成纤维细胞,HaCaT人源角质形成细胞)和/或吞噬性细胞(如RAW264.7 小鼠巨噬细胞,THP-1人源已分化巨噬细胞)进行试验。为了获得纳米材料的危害和作用模式信息、以及暴露情况,鼓励注册申请人在能力可及范围内测试有代表性的靶组织部位细胞、接触部位细胞、免疫细胞等类型。
可以考虑的特定终点包括细胞活力/细胞毒性(MTS、LDH法)、氧化应激反应、DNA合成(BrdU法)、能量代谢(测定ATP)、(促)炎症反应(作为免疫毒性的一部分)和组织屏障穿透性等。
(二)遗传毒性试验
应用纳米材料的医疗器械的遗传毒性试验应遵循医疗器械GB/T 16886.1、GB/T 16886.3的一般性原则,同时考虑纳米材料的特性。
纳米材料可通过直接与DNA相互作用、干扰有丝分裂过程等产生遗传毒性,还可通过氧化应激反应在细胞外引起遗传物质损伤,产生间接的遗传毒性。所有的遗传毒性试验应始终包括对纳米材料在靶细胞/器官的暴露情况的评估。
1. 体外遗传毒性试验项目选择
在考虑应用纳米材料的医疗器械的体外遗传毒性试验组合时,应考虑的遗传毒性终点包括基因突变、染色体结构或数目畸变。因此,推荐的体外遗传毒性试验组合如下:
(1)哺乳动物细胞基因突变试验(如YY/T 0870.3小鼠淋巴瘤tk基因突变试验、OECD 476 CHO/HGPRT突变试验)。
(2)体外微核试验(YY/T 0870.6)或体外染色体畸变试验(YY/T 0870.2)
可以根据已获得的应用纳米材料的医疗器械相关信息,分别从以上两项目中任选一个试验进行组合,并提供科学判断。
2. 体外遗传毒性试验注意事项
(1)由于细菌细胞壁的屏障效应及缺乏内吞作用影响细菌对纳米材料的摄取,可能导致假阴性结果,而且部分纳米材料具有抑菌作用。因而,Ames试验不是研究纳米材料遗传毒性的推荐方法。对于可诱导产生活性氧的纳米材料,细菌回复突变试验仍可能提供有用信息。“改良的Ames波动试验”可能适合用于纳米材料的遗传毒性评价。
(2)在选择最合适的哺乳动物细胞试验系统进行体外遗传毒性试验时,细胞对纳米材料的摄取能力是研究其代谢动力学和毒性的关键。因此建议使用可摄取纳米材料且p53功能完整的细胞系开展体外遗传毒性试验,同时对细胞摄取能力进行分析。
(3)细胞松弛素B(cytochalasin B, CytoB)可干扰细胞骨架的形成,抑制细胞内吞纳米材料。因此体外微核试验中必须延迟向纳米材料处理的细胞培养物中加入Cyto B,从而保证纳米材料与细胞培养系统充分暴露。
(4)体外微核试验中,考虑到颗粒物进入细胞核的可能性较低,以及在有丝分裂过程中,为了促进核膜溶解后纳米材料与DNA的接触,建议处理时间覆盖两个细胞周期(至少为24小时),以保证纳米材料与遗传物质(直接或间接)充分地接触。
(5)体外微核试验中,采用高浓度纳米材料进行试验时,细胞中的纳米颗粒聚集体可能被误认为是微核碎片,干扰微核识别和细胞分裂阻滞增殖指数的评价。可考虑使用荧光标记DNA探针进行组织学染色来减少干扰。
(6)大多数难溶性纳米材料不会被代谢。然而,有些有机纳米材料、涂覆有机官能团的无机纳米材料在有和无代谢活化系统(S9)存在下的遗传毒性表现出差异。因此,试验中S9的使用应该遵循个案处理原则。
3. 体内遗传毒性试验
如果至少有一项体外遗传毒性试验结果阳性,在影响因素识别、化学表征以及证据权重判定浸提液或化合物有潜在遗传毒性风险时,应选择适宜的体内试验评价遗传毒性。如果体外试验不适合测试纳米材料(如所用分散介质与体外培养系统不相容),可考虑开展体内遗传毒性试验,除非能充分证明体外阳性结果与体内情况无关。
需要注意的是,纳米材料诱导的炎症反应可以产生活性氧自由基,可能触发二次遗传毒性,体外试验系统却无法检测。若纳米材料存在这样的效应,建议在全身毒性试验中结合体内彗星试验评价遗传毒性。
选择适当的体内遗传毒性试验需要基于现有信息进行专业判断,应与体外试验中已识别出的遗传毒性终点,以及合适的靶器官或组织、暴露情况相关联,并根据体外试验的结果逐步进行。在缺乏相关数据的情况下,如纳米材料没有到达靶组织,则相应试验方法不适用于检测遗传毒性。因此,以下任一体内遗传毒性试验可能是合适的:
体内微核试验(YY/T 0870.4)
体内哺乳动物骨髓染色体畸变试验(YY/T 0870.5)
体内彗星试验(OECD 489)
体内精原细胞染色体畸变试验(OECD 483)
转基因啮齿动物基因突变试验(OECD 488)
目前针对常规材料遗传毒性试验在纳米材料中的应用验证在不断开展中,故在本指导原则框架下,在开展遗传毒性试验前,应将此类进展考虑在内。
(三)急性毒性
医疗器械急性毒性试验相关标准(GB/T 16886.11、GB/T16886.12)的一般要求也适用于应用纳米材料的医疗器械。样品制备时,应说明分散体系选择的合理性。GB/T 16886.11以外的急性毒性试验信息可以在下面找到:急性经口毒性试验固定剂量法(GB/T 21804),急性毒性分类方法(GB/T 21757),或者上下增减剂量法(GB/T 21826)。吸入途径急性毒性分级方法在GB/T 21605和GB/T 28648中描述,体内急性皮肤毒性试验在GB/T 21606及 GB/T 21604中描述。
(四)刺激性
纳米材料的生物效应可能导致其穿透皮肤、眼睛或黏膜以及被摄取,应考虑适宜的模型评价纳米材料的刺激性。GB/T 16886.10 的一般要求也适用于纳米材料。此外,当局部组织生理状态改变时,如分泌汗液的皮肤、机械损伤的表面、病理学病症、光损伤等,对纳米材料的屏障效应也可能发生相应改变,导致不同的刺激性。因此,选择的试验方法应能充分模拟应用纳米材料的医疗器械的临床具体使用条件和暴露途径。
虽然已有一些体外替代试验(如大鼠皮肤经皮电阻抗试验,OECD 430;EpiSkin™, EpiDerm™, SkinEthic™, EST-1000,OECD 431)被验证用于评价化学品的刺激性,但无证据证明当前的替代试验适用于评价纳米材料。若注册申请人采用体外替代方法进行刺激性试验时,需要提供详细的研究资料和验证资料。关于体外替代方法的相关内容,将在本系列指导原则第五部分:体外替代测试方法/计算机模拟研究中给出。
(五)皮肤致敏反应
纳米材料的大比表面积,类佐剂效应以及与蛋白质形成的复合物都可能会导致过敏。GB/T 16886.10描述了评估医疗器械及其成分诱发皮肤致敏反应的试验方法,即鼠科动物局部淋巴结测定(LLNA)、豚鼠最大剂量试验(GPMT),以及封闭式贴敷试验。但这些试验对纳米材料的适用性有待验证。由于纳米材料的低皮肤穿透性,LLNA和/或封闭式贴敷试验可能检测不出致敏潜力,阴性试验结果不能被解释为纳米材料无致敏性。GPMT由于首次诱导为皮内途径,可能是目前检测纳米材料致敏性最相关的试验,尽管局部诱导期和激发均使用完整皮肤进行。
目前,采用GPMT试验评价纳米材料的实验数据非常有限。基于现有知识,不能依赖单一特定的试验方法来研究纳米材料。而且,这些试验仅用于测试皮肤致敏反应,尚未见评价由免疫球蛋白E介导的速发型超敏反应的方法的报道。
(六)血液相容性
目前缺乏专用于评价与血液直接或间接接触的应用纳米材料的医疗器械血液相容性的标准方法,体外条件下的溶血、血液学、凝血、血小板激活和补体激活试验均可以为纳米材料血液相容性提供有效的参考。
对于表面具有纳米材料/纳米特征的医疗器械,可直接按照GB/T 16886.4开展血液相容性评价,推荐以器械表面积/血液体积的比例计算接触体系。由于游离纳米材料比常规材料有更高的比表面积,其血液相容性评价更具有挑战性,在参考GB/T 16886.4、YY/T 1532进行试验时,需特别关注纳米材料特性对其进入血液后的级联反应的影响,以及纳米材料在介质中的表征结果。
若体外试验不足以评价纳米材料的血液相容性,可考虑结合体内试验进行评价,将纳米材料注射到循环系统并评价其分布以及任何局部和全身不良反应,如血管损害、血液学、血生化相关指标的改变,并参考GB/T 16886.4进行补体激活、凝血级联激活、血小板激活等试验评价纳米材料的血液相容性。
补体系统通过材料的调理作用,参与针对非自身实体的先天性免疫防御,从而令巨噬细胞对纳米材料进行识别和摄取。因此,除了血液相容性常规项目外,建议考虑纳米材料与吞噬细胞的潜在相互作用。目前尚无评价纳米材料与吞噬细胞相互作用的标准方法。推荐增加内皮细胞和/或单核细胞激活评估(如评价细胞黏附分子标志物、促炎因子、促凝因子等)。
此外,新技术(如微流控)可能用于评价纳米材料与内皮细胞和/或血管的相互作用。
(七)毒代动力学
1. 引言
纳米材料受其尺寸、表面性质和形状等理化性质的影响,与常规材料相比,转运模式及代谢动力学特征均可能发生明显变化。如果从医疗器械中释放的纳米材料可能被吸收、分布、代谢和/或排泄,即需要进行毒代动力学研究。
医疗器械接触途径可能影响纳米材料的动力学特征,因此需要重点关注。如当气管内接触金纳米颗粒(1.4 nm)时,肾显示出比肝更高的暴露量,而采用静脉接触后,肝成为最主要的靶器官。
纳米材料的释放动力学可能受到纳米材料表面分子粘附的影响。蛋白分子可能附着于纳米材料表面形成蛋白冠,并促进单核巨噬细胞系统(MPS)对纳米材料的识别和摄取。局部组织中的纳米材料主要通过淋巴迁移或转运至循环系统,也可能被吞噬细胞吞噬和二次组织分布,最终到达其他组织器官,如脾、肝等。
2. 逐级进行毒代动力学研究
基于风险评估的目的,以及提高效率、减少实验动物的使用,并提供更好的数据,推荐逐级进行毒代动力学(ADME)研究,对纳米材料进行暴露表征和暴露评估。
(1)收集特定纳米材料以及类似材料(如非纳米材料)的现有信息,包括与吸收/生物利用度、分布模式和清除相关的信息。
(2)在生物学评价/毒理学评价层级2的亚慢性毒性试验中增加卫星组进行毒代动力学研究,以研究纳米材料是否会蓄积以及蓄积到何种程度。建议注册申请人在研究结束后及一段消除期后检测纳米材料的组织分布。任何组织中暴露量的显著增加,或在消除期间的缓慢释放,都应进行讨论,并在层级3中进一步评估。若对试验方案的剂量、浓度、代谢动力学等研究内容的设计存在疑虑时,可在亚急性毒性试验中伴随进行单次及多次暴露的毒代动力学研究,初步获得纳米材料的吸收、分布、蓄积和消除特征,避免在后续步骤中使用过高毒性剂量。
(3)在层级3中需要进行深入的毒代动力学研究,以评估重复接触的效应,以及重复接触是否会导致纳米材料的暴露量达到稳态或在体内蓄积,并覆盖纳米材料暴露量达到稳态的时间点。必要时,可能需要伴随其他试验研究生殖系统、免疫系统、中枢神经系统、内分泌系统等特定系统的暴露情况,如伴随生殖/发育毒性试验开展毒代动力学研究,对胎盘、乳汁中的纳米材料进行定性和定量分析。
3. 纳米材料毒代动力学研究方法
GB/T 16886.16的一般性原则也适用于应用纳米材料的医疗器械。与常规材料不同的是,器官可能快速摄取纳米材料而不依赖于其在血液中的浓度,即使血液中的浓度很低,器官对纳米材料的摄取也可能发生。纳米材料在组织中的分布、蓄积以及消除可能比在血浆中的暴露特征更能代表真实的暴露情况,尤其是在典型的摄取器官、靶器官中的分布情况,如肝、脾、肺等。多次接触会导致纳米材料蓄积,特别是静脉接触后,在肝和脾中蓄积非常明显,这可能导致纳米材料在器官中长期保留。此外,肾可能是纳米材料排泄的重要器官。为了识别纳米材料的组织分布、蓄积和滞留潜力,有必要设计单次和多次接触的毒代动力学研究,并合理延长样本采集时间点。
目前,对生物样品中的纳米材料进行定量分析的方法有限。现有的检测方法中,金属纳米颗粒相比于其他纳米材料更容易被检测,且绝大多数纳米材料毒代动力学研究采用元素分析法对纳米材料化学组成进行定量分析。定量分析方法可以采用电感耦合等离子体质谱法(ICP-MS)或原子吸收光谱-质谱法(AAS-MS)等。但检测出特定的元素并不能证明材料以纳米形式存在。可考虑采用单颗粒ICP-MS技术检测生物样品中的纳米材料。具体研究时,建议先采用定量分析方法对组织中的元素进行检测,若有特征元素存在,再采用纳米材料特异性的方法进行定性分析,考察化合物是否以纳米形式存在。关于生物样品中纳米材料的理化表征方法,请参考本系列指导原则第二部分:理化表征。
放射性同位素或荧光染料标记方法可用于标记纳米材料,跟踪纳米材料的生物转化和生物转运过程。通过将标记添加到纳米材料中形成特定结合或利用纳米材料本身的放射性同位素可实现纳米材料的标记。但某些标记可以从纳米材料中脱离,干扰毒代动力学研究。因此,当使用任何特定的标记技术时,需要仔细评估标记-纳米材料组合的完整性,分别测定生物样品中母体物质和代谢物的总量。
标记方法可能引起纳米材料的表面化学变化,并影响其物理化学性质,以及毒代动力学特征和毒性。而且,放射性标记纳米材料具有可用性和安全性问题。因此,纳米材料的标记方法受到限制。尤其是在吸入毒性试验中,使用放射性标记的纳米材料可能造成设备的污染。当使用标记的纳米材料进行毒代动力学研究时,需要注意以下问题:
(1)确保在接触和进入体内后标记按预期发挥作用;
(2)确保标记不会改变纳米材料的毒代动力学行为。
4. 经皮肤接触的应用纳米材料的医疗器械的毒代动力学
评估医疗器械的皮肤穿透性可以采用多种哺乳动物模型,以及体外人体皮肤模型,但目前没有专用于评价应用纳米材料的医疗器械的模型。研究的难点之一是纳米材料的定量分析。一般来说,纳米材料穿透皮肤角质层的能力有限,然而,仍有一些纳米材料存在有限的摄取。例如纳米银敷料与体外皮肤模型接触后,检验血液中有低水平的银元素转移。影响皮肤穿透和吸收的因素包括皮肤损伤,如擦伤和UVB损伤(晒伤),机械压力(皮肤挠曲),以及溶剂和载体效应。
5. 非经皮肤接触的应用纳米材料的医疗器械的毒代动力学
(1)眼暴露摄入
纳米材料可能用于接触镜,以增强药物在眼中的摄入和靶向性,材料的纳米特性可能在使用后消失。然而,没有关于纳米材料在眼部的释放和代谢动力学数据。有报道表明含有甲壳素的纳米凝胶穿透到了猪角膜的更深部位,没有破坏角膜细胞和引起炎症反应。
(2)吸入暴露摄入
纳米材料经吸入途径暴露后(如与齿科操作相关),虽然大多数纳米材料保留在肺部,但仍有一小部分纳米材料可在全身被检测到。纳米材料从肺部清除的半衰期可能高达2个月。黏膜纤毛对肺部吸入颗粒的清除,可导致部分纳米材料进入胃肠道(GI-tract),并经粪便排泄。黏膜纤毛的清除和粪便排泄,是机体清除吸入纳米材料的主要途径。纳米材料粒径影响其在呼吸系统中的暴露部位,一般来说小尺寸(7 nm比20 nm)纳米颗粒有更高的肺部摄入,甚至特定尺寸纳米材料能通过嗅觉神经迁移至大脑。
(3)经口暴露摄入
与常规材料相比,纳米材料经口途径暴露的量通常较低,小尺寸纳米材料有更高的摄入量,粒径>100 nm的颗粒也可能被胃肠道吸收。可以使用胃肠道体外模型来研究纳米材料在肠道细胞的转运。例如使用Caco-2细胞常用的Transwell细胞培养系统。也可以使用胃肠道模型预测颗粒在体内的吸收。
(4)皮下暴露摄入(植入物)
应用纳米材料的医疗器械植入皮下后,可能在局部释放少量纳米材料。因此可以通过皮下注射作为经皮植入分布研究替代方法。应关注纳米材料在淋巴结、肝、脾和肺等器官的颗粒团聚现象。
(八)热原
由于纳米材料表面极易吸附微生物及其产生的细菌内毒素(LPS),干扰纳米材料与生物系统之间的相互作用,增加热原反应风险。应用纳米材料的医疗器械细菌内毒素检测可参考YY/T 1295给出的试验方法进行。除细菌内毒素介导的致热性外,也需考虑纳米材料介导的致热性,可参考GB/T 16886.11给出的试验方法进行测试。
(九)植入
GB/T 16886.6中提供了不同组织(皮下、肌肉、骨、脑)局部植入的标准方法,也适用于降解和非降解纳米材料、固体和非固体纳米材料如多孔材料、液体、凝胶、膏状和粉末等不同形态。
对于非降解纳米材料,组织反应通常在12周后可达到稳定状态,而对于可降解材料,组织反应的稳定状态通常取决于纳米材料在组织中的降解特性。纳米材料在降解过程中可能与局部组织持续发生相互作用,故需要监测更多的观察周期以覆盖典型的组织变化节点,还应关注所产生纳米颗粒在局部沉积引起的局部组织学效应,以及向引流淋巴结迁移及进入血液引发全身效应的风险。
尽管GB/T 16886.6不用于全身毒性、致癌性、致畸性或致突变性的评估,但如果在植入研究过程中,同步满足了GB/T 16886.11全身毒性的要求,则可以进行局部反应和全身反应的联合研究。
(十)亚慢性毒性试验
GB/T 16886.11中提供了医疗器械在适当的暴露途径和时间的多次接触毒性试验方法。由于医疗器械涉及的材料类型多、形态复杂、预期用途范围广等特点,故在全身毒性试验设计中应根据纳米材料的特性考虑特定的方法。
应当考虑临床预期用途/适用范围、终产品状态、暴露特征等因素,在最恰当的条件下开展亚慢性毒性试验,以便模拟人体暴露情况。如直接应用终产品不可行,应使用终产品的代表性样品进行测试。
短期的亚慢性毒性试验可提供初步的剂量探索和毒代动力学数据,用以发现重点关注的靶器官。对于经血液接触的应用纳米材料的医疗器械,最低要求是改良的28天毒性试验(伴随毒代动力学研究),对于其他途径接触的应用纳米材料的医疗器械,最低要求是改良90天毒性试验(伴随毒代动力学研究),并应根据所研究的纳米材料特性,评估28天或90天试验是否足够。在该试验中,除了关注一般全身毒性反应外,还应重点关注心血管系统(如纳米尺度团聚物在血管内形成)、炎症指标、涉及吞噬系统的组织/器官(如肝、脾、肾、骨髓和肺等),以及需要尽可能评估纳米材料的潜在神经毒性、免疫毒性、生殖毒性或内分泌介导效应,进行初步危害表征和危害评估,为风险评估提供信息,为进一步深入研究提供依据。与组织、器官存在长期、持久接触的应用纳米材料的医疗器械,需要重点关注接触组织、器官的潜在毒性风险,如与生殖组织、胚胎或胎儿长期或持久接触的应用纳米材料的医疗器械,可能需要重点关注潜在的生殖发育毒性风险。
(十一)需要附加考虑的试验
1. 慢性毒性/致癌性试验
慢性毒性和致癌性研究一般是在单一物种中进行,通常选择大鼠,可以单独进行研究,也可联合进行研究。当首选物种出现可疑结果或者特定发现,或需要专门研究所观察到的毒性或者致癌性的作用机制时,则需要进行第二个物种的致癌性研究。
GB∕T 16886.3描述了致癌性试验,但没有证据表明试验对于纳米材料的适用性。因而,开展试验时必须基于个案处理的原则。应在获得应用纳米材料的医疗器械潜在暴露的基础上阐明开展致癌性试验的理由。
2. 生殖和发育毒性试验
亚慢性毒性试验可获得应用纳米材料的医疗器械的生殖系统毒性信息,如对生殖器官、动情周期(如果需要)、性激素(如果需要)的影响等,但不能评估对生育力和整个生殖周期(从性成熟到受孕、妊娠、分娩和分娩后发育)的影响,即发育毒性。需根据层级2中改良亚慢性毒性试验的毒性特征及暴露情况,综合考虑是否在层级3中开展生殖和发育毒性试验。
在缺乏证据可以排除生殖/发育风险的情况下,应考虑进行多代生殖/发育毒性试验和/或扩展一代生殖发育毒性试验(EOGRTS)。
(1)多代生殖/发育毒性试验
如果需要进行测试,应按照OECD 421(生殖/发育毒性筛选试验)提供关于生殖和/或发育的初始信息。如果基于筛选试验结果需进行额外的试验,应按照OECD 414 (胎儿发育毒性试验), OECD 415 (一代生殖毒性试验), OECD 416 (二代生殖毒性试验)或OECD 422 (重复给药生殖/发育毒性筛选联合试验)开展试验,并对方法的适用性进行个案处理。
(2)扩展一代生殖发育毒性试验
结合了生殖/发育、神经系统发育、免疫系统发育等数个毒性终点,可能包括额外的试验,例如内分泌研究、神经系统发育毒性和行为学研究,评估妊娠期、哺乳期和青春期前暴露对生育和生殖功能的短期到长期的影响,以及对离乳前仔代和离乳后仔代的影响。当需要充分表征人体暴露风险时,可能需要考虑EOGRTS评估到F2代。如果能提供足够的关于神经毒性和免疫毒性的信息(例如超过90天的试验),可采用多代生殖和发育毒性试验替代扩展一代生殖毒性试验(EOGRTS)。
(3)生殖/发育毒性试验注意事项
a.不推荐使用可能影响胎儿发育的暴露途径。例如,腹膜内接触可能导致纳米材料直接注射到子宫或穿过子宫壁,影响发育中的胚胎/胎儿。压力环境及每天超过6小时不进食水,导致经鼻吸入暴露途径不适用于怀孕雌性动物。
b.在发育毒性研究中,纳米材料可能经母乳暴露于子代,故应对母乳中纳米材料进行表征。
3. 免疫毒性
免疫反应在层级2的研究中可能会被扩大或首次出现,评价纳米材料对免疫系统的作用可以基于层级2中的试验结果对免疫毒性进行综合评估,在个案处理原则上考虑层级3的试验内容。
在亚慢性和慢性毒性试验中,通常提供血液学和血生化数据,以及脾细胞(T-、B-、NK细胞)和骨髓细胞的表型分析。EOGRTS试验需设置额外的组用于评估暴露对免疫系统发育的潜在影响,并提供免疫球蛋白IgM对T细胞依赖抗原(如绵羊红细胞(SRBC)或血蓝蛋白 (KLH))反应的信息。
如果需要进一步评估纳米材料的免疫毒性,可采用体外模型进行评估,可考虑评估免疫细胞的吞噬功能、趋化性、炎性因子、一氧化氮产生和信号通路等指标。
由于没有单一的试验方法能提供免疫毒性的决定性证据,因此建议采用证据权重方法综合评估纳米材料的免疫毒性风险。
4. 神经毒性
纳米材料的潜在神经毒性信息可从改良的亚慢性毒性试验中获得,相关指标包括临床体征的改变、功能性观察组合试验(FOB)和自主活动、脑脏器系数(在没有明显毒性的情况下),以及神经系统组织病理学改变,如有必要,可增加神经递质、神经元结构及炎症因子等指标。其他如体外神经毒性试验、交叉参照或提示具有神经毒性潜能的物理化学性质等信息也应予以综合考虑。
层级2发现潜在神经毒性时,应基于个案处理原则考虑在层级3进行深入的神经毒性试验,从而确认或表征纳米材料诱发的神经毒性反应。在设计这些研究时也应充分考虑其他试验的信息,以尽量减少全身毒性继发的效应。在完成风险评估时,还可以进行机制研究,以提高从动物到人体的外推把握度。
5. 内分泌介导效应
纳米材料可能对内分泌系统产生不利影响,特别是对生殖系统,可能改变激素水平,还可能具有性别差异。改良的亚慢性毒性试验可用于研究内分泌干扰效应。额外的参数应关注内分泌相关毒性终点(如甲状腺激素的测定、与内分泌系统相关的大体解剖检查和组织病理学检查)和动情周期的评估等。