您当前的位置:检测资讯 > 行业研究
嘉峪检测网 2022-08-13 21:34
摘 要Abstract
药品连续制造作为一种生产领域的新兴技术,是美国、欧盟、日本和英国等发达国家和地区、国际人用药品注册技术协调会和世界卫生组织高度重视的先进生产模式。瞄准我国通过智能制造建设制药强国的发展趋势,聚焦生产领域的“连续制造”推动医药产业技术变革和优化升级,是落实国家药品监督管理局药品监管科学行动计划的重要举措。本文通过对国内外药品连续制造监管实践与发展的梳理和思考,提出了对我国药品连续制造发展的监管建议,以期对我国药品连续制造的监管工作提供借鉴,不断提高我国药品监管科技化、法治化、现代化和国际化水平,加快我国由制药大国向制药强国转变。
As an emerging technology in the field of production, continuous pharmaceutical manufacturing is an advanced production mode, which is highly valued by the United States, European Union, Japan, Britain and other developed countries,the International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use and World Health Organization. Aiming at the development trend of building a strong pharmaceutical industry through intelligent manufacturing,and focusing on technological reform and upgrading driven by “continuous manufacturing” in Chinese pharmaceutical industry are the important measures to implement China's Drug Regulatory Science Action Plan launched by the National Medical Products Administration. Through combing and considering the regulatory practice and development of continuous pharmaceutical manufacturing in China and abroad, some regulatory suggestions on the development of continuous pharmaceutical manufacturing in China are put forward, so as to provide a reference for the supervision on continuous pharmaceutical manufacturing and continuously improve the levels of science and technology, legalization, modernization and internationalization of drug regulation in China, as well as accelerating China's transition from a big country to a strong country in terms of drug manufacturing.
关键词Key words·
药品连续制造;监管科学;监管实践与发展;监管思考与建议
continuous pharmaceutical manufacturing; regulatory science ; regulatory practice and development; regulatory considerations and suggestions
2021 年5 月, 国务院办公厅发布的《关于全面加强药品监管能力建设的实施意见》指出:“对标国际通行规则,深化审评审批制度改革,持续推进监管创新,加强监管队伍建设,按照高质量发展要求,加快建立健全科学、高效、权威的药品监管体系,坚决守住药品安全底线,进一步提升药品监管工作科学化、法治化、国际化、现代化水平,推动我国从制药大国向制药强国跨越。”[1]2019 年, 国家药品监督管理局就已启动了“中国药品监管科学行动计划”,监管科学的核心是研发、预测、评价和检定药品安全性有效性的新标准、新工具和新方法的创新实践活动。2021 年6 月, 为贯彻落实《关于全面加强药品监管能力建设的实施意见》,加快推动我国药品监管科学行动计划实施,国家药品监督管理局发布了《关于实施中国药品监管科学行动计划第二批重点项目的通知》,其中有关“连续制造”的监管项目是本次监管科学行动计划的任务之一[2]。在过去的半个世纪中,制药行业一直采用传统批量生产模式进行药物生产,但随着全球化、信息化、现代化步伐加快,能够缩短生产周期,在一定程度上提高药品质量和生产效率,具备敏捷性和灵活性特点的连续制造(continuous manufacturing,CM)生产模式已成为美欧日等发达国家和地区、国际人用药品注册技术协调会(International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use,ICH) 和世界卫生组织(World Health Organization,WHO)高度重视的新兴技术,这些监管机构和组织纷纷聚焦与连续制造相关的监管科学难题,创新监管政策、法规和制度,以其监管体系和监管能力的现代化促进药品的创新和发展。
1 药品连续制造在国外的监管实践与发展现状
1.1 美国
美国食品药品监督管理局( Food and Drug Administration,FDA) 自21世纪初将药品监管科学作为重点推动学科,通过解决医药等产品监管中遇到的问题,履行科学决策的职责,推动药品监管事业的发展。对于生产领域的监管科学研究,FDA 鼓励和支持采用连续制造生产模式来提高药品质量,最大限度地解决药品短缺问题,截至目前美国是上市连续制造药品数量最多的国家。2004年9 月,FDA 发布《行业指南:过程分析技术(PAT)- 用于规范创新药研发,生产及质量保证的框架》(Guidance for Industry:PAT-A Framework for Innovative Pharmaceutical Development,Manufacturing, and Qualit Assurance)[3], 认为连续制造是一种基于风险的科学方法进行过程设计的生产方式,旨在通过监管框架,鼓励自愿实施创新药物研发、生产和质量保证,并根据现有法规制定了创新办法,帮助企业解决预期的技术和监管问题。2015 年,FDA 开始鼓励药品连续制造的产业化应用。此外,FDA 药品审评与研究中心(Center for Drug Evaluationand Research,CDER) 成立新兴技术团队(Emerging Technology Team,ETT)助力企业实施创新技术,而连续制造正是ETT 主要关注和大力推动的新兴技术之一[4],这表明美国对药品连续制造的重视程度进一步提高。
2019 年2 月, FDA 发布《行业指南:连续制造的质量考量》(Quality Considerations for Continuous Manufacturing Guidance for Industry) 草案, 该草案阐明了当前FDA 对于创新连续制造生产模式的思考,并解决了企业在计划实施连续制造时遇到的潜在问题,如运用连续制造生产模式可能影响FDA 对新产品申请材料的评估和现有产品从传统批量生产模式转换为连续制造生产模式的审批时间问题[5]。即使连续制造生产模式有许多优点,但FDA 也意识到一些企业在实施前仍有顾虑,如新设备的成本问题和监管问题,FDA 局长Scott Gottlieb 和CDER 主任Janet Woodcock 也在该草案发布的声明中一再强调连续制造的优势,他们表示“连续制造系统的封闭性和连续性使其比几十年前传统批量生产模式更容易控制”。连续制造将有助于确保始终如一的产品,使制造商能更轻松地扩大生产规模以满足药物市场需求。
2020 年9 月, 美国众议院批准建立国家连续制造卓越中心(National Center of Excellence for Continuous Manufacturing,NCECM) 的立法, 法案题为《2019 年国家连续药物制造卓越中心》(National Centers of Excellence in Continuous Pharmaceutical Manufacturing Act of 2019),该法案授权FDA 认证NCECM,NCECM 将与FDA合作为连续制造的实施制定国家框架,该法案包括支持与连续制造相关的额外研发、劳动力发展、标准化及与制药商合作等内容[6]。2021 年1 月,FDA 在《2021年FDA 监管科学进展:监管科学重点领域》(2021: Advancing Regulatory Science at FDA: Focus Areas of Regulatory Science)中指出:“先进制造可以应用智能制造的概念,采用自动化、数字化和人工智能来简化生产方法,收集更多的过程控制数据,并使用智能算法来控制产品生产和放行或做出相关的决策”[7]。2021年11 月,FDA 药品质量办公室主任Michael Kopcha 表示,FDA 正在制定先进制造评估框架(Framework for Advanced Manufacturing Evaluation,FRAME),FRAME 是FDA 实施先进制造的举措之一, 未来5~10 年内,连续制造将会在药品生产中扮演重要角色[8]。
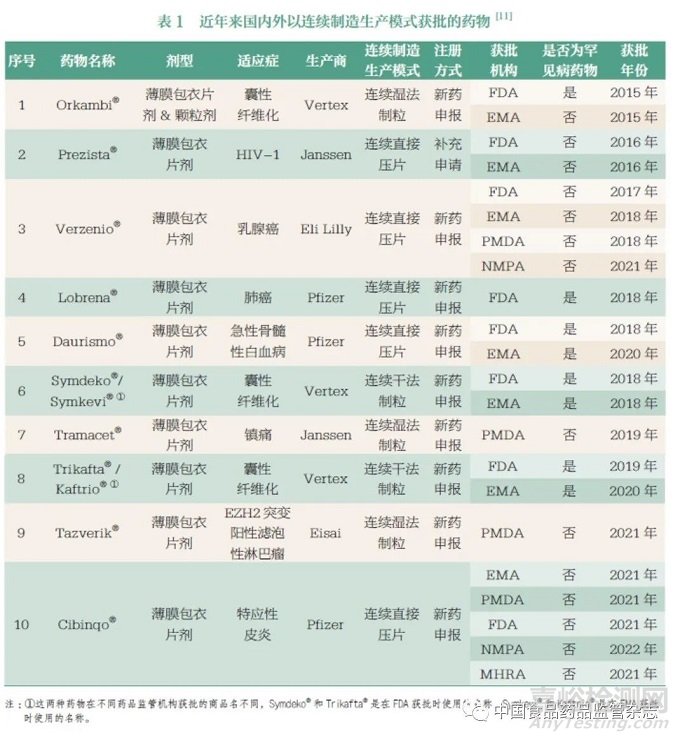
在FDA 对药品连续制造生产模式的产业化应用鼓励下, 2015年7 月,美国福泰公司的一款治疗囊性纤维化药物(Orkambi®)成为首个被FDA 批准的连续制造药品,采用该技术可1 小时内生产10 万片,而传统批量生产模式加工同样的产能则需要4~6 周[9]。美国辉瑞公司也于2015 年开发出便携式、连续式、微型和模块化的(Portable,Continuous,Miniature and Modular ,PCMM) 连续制造系统。2016年,美国强生公司的一款抗艾滋病毒药物(Prezista®)通过上市后变更程序,成为首个被FDA 批准的由传统批量生产模式变更为连续制造生产模式的新药。2021年7 月,FDA 药品质量办公室生物技术产品办公室审评员CyrusAgarabi 在化学生产和控制战略论坛上表示:“尽管在FDA 批准的药品中,连续制造药品申请数量很少,但这种生产模式的实施进展一直很稳定,未来将有更多的连续制造药品申请上市。”[10] 截至目前,从FDA 公布的药物审评信息来看,已经批准了8 种连续制造药品,具体药物信息见表1。
1.2 欧盟、日本、英国
药品监管科学自20 世纪90年代初步完成学科构建后,在欧盟、日本和英国等发达国家均得到了高度重视。针对生产领域的监管科学研究,欧盟、日本、英国的药品监管机构自2014 年以来也陆续对药品连续制造采取监管措施,用以支持引入连续制造生产模式作为医药行业现代化的策略, 并先后成立了相关团队,向实施连续制造生产模式的企业提供建议。这些监管团队包括欧洲药品管理局(European Medicines Agency,EMA)的过程分析技术(Process Analytical Technology,PAT)团队、日本药品及医疗器械综合机构(Pharmaceuticals and Medical Devices Agency,PMDA)的创新制造技术工作组以及英国药品和保健产品监管机构(Medicines and Healthcareproducts Regulatory Agency,MHRA)的创新办公室。这些药品连续制造监管团队倡导医药企业在引入连续制造生产模式或以此提交上市申报材料之前,应尽早地多次与监管机构进行沟通和交流。医药企业和监管机构之间的对话有助于监管机构了解连续制造生产模式,减少监管的不确定性,并提醒企业潜在的生产问题,减少注册审评期间对连续制造生产模式的疑虑问题[12]。
EMA 鼓励在连续制造生产模式实施过程中进行早期对话,进而成立了PAT 团队和创新工作组,为其顺利实施提供支持。PAT 团队负责解决连续制造生产模式中PAT 的实施和监管问题,具体工作内容见表2。创新工作组则汇集了多方专家,可解决与连续制造生产模式相关的生产质量、安全性、有效性、药物警戒、科学建议、罕见病药品以及法律和监管事务等问题。EMA 已经将连续制造生产模式纳入到当前的监管框架内,在《欧洲药典》(European Pharmacopoeia) 中也增添了与连续制造相关的PAT内容,如近红外光谱(2.2.40)、拉曼光谱(2.2.48)、使用大量样品证明制剂均匀性(2.9.47)、化学计量学方法用于数据分析(5.21)、化学成像(5.24)等章节[13]。截至目前,从EMA 公布的药物审评信息来看,已有7 款连续制造药品被EMA 获批上市(表1)。
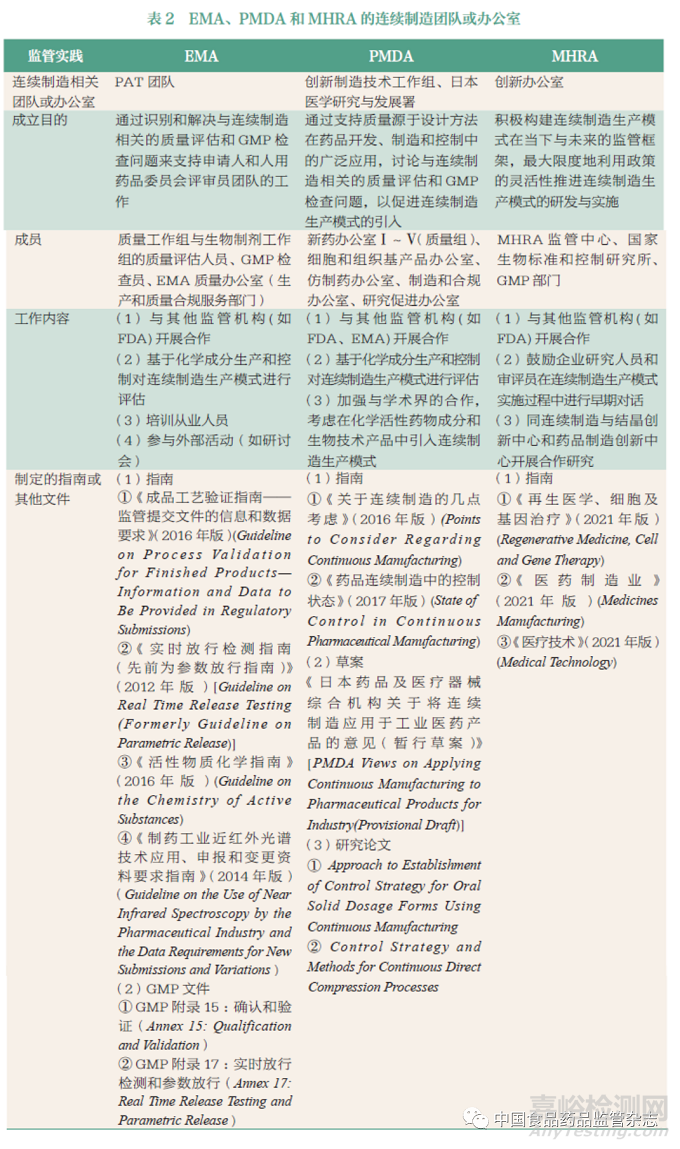
PMDA 为促进有关连续制造创新制造技术的引入,于2016年成立了创新制造技术工作组,并在日本医学研究与发展署赞助下于2016 年和2018 年发布了两项连续制造指南,探讨连续制造生产模式与GMP 检查有关的监管问题,并将连续制造生产模式作为主要的推进目标。创新制造技术工作组和日本医学研究与发展署的具体工作内容见表2。同时,在最新的《日本药典》(Japanese Pharmacopoeia) 附录中还定义了与连续制造相关的PAT、实时放行检测(Real Time ReleaseTesting,RTRT)技术、连续工艺验证(Continuous Process Verification,CPV) 和关键工艺参数(Critical Process Parameter,CPP)等一系列术语[14-15]。通过监管部门的指导,目前已有4 款连续制造药品获得了PMDA 的上市销售许可(表1)。
MHRA 则通过建立“ 准入联盟”与澳大利亚、加拿大、新加坡和瑞士的监管机构联系在一起, 这也是更为广泛的国际药品检查组织(Pharmaceutical Inspection Co-operation Scheme,PIC/S) 的一部分,用以促进更全面的连续制造监管协作,实现监管要求的一致性。MHRA 创新办公室作为其联络点,实现了从监管者向推动者角色的转变,不断推动与连续制造相关的创新工艺和上市药物的产生,创新办公室的具体工作内容见表2,目前已有1 款连续制造药品被MHRA 批准上市(表1)。此外, 在《英国药典》(British Pharmacopoeia)中也提到针对连续制造生产模式,应有完备的产品设计、控制策略及生产过程验证数据,进而证明运用该生产模式的药物符合《英国药典》规定的质量标准[16-17]。
1.3 ICH 和WHO
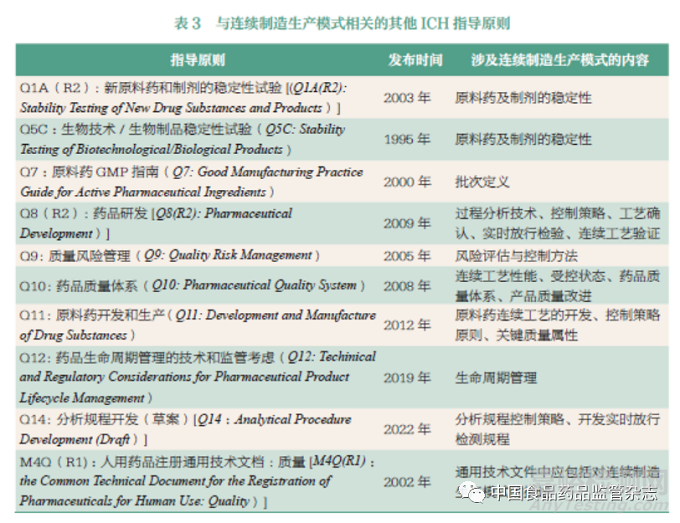
除了以上所梳理的美国、欧盟和日本等发达国家和地区的监管机构外,由这些发达国家和地区发起的并联合医药企业管理协会共同组成的ICH 也针对药品连续制造开展了众多工作。ICH 于2018 年将在药品连续制造监管方面具有充分背景、专业知识和经验的监管者和行业代表组建成新的工作组,同年6 月在日本神户批准了《Q13 :原料药和制剂的连续制造》(Q13: Continuous Manufacturing for Drug Substances and Drug Products)议题,该议题是药品监管科学研究的成果,同时也是药品监管科学研究的新挑战。2018 年11月该议题被正式通过,认可了其概念文件和商业计划。2021 年7 月27 日到达ICH 流程的第2步,签署了Q13 指导原则草案。2021 年10 月进入第3 步公众咨询期和讨论期,主要是对ICH监管机构成员所收集本地区关于指导原则草案的反馈意见进行讨论。按照工作计划,2022 年5月会通过面对面会议审查和解决公众意见,2022 年11 月的面对面会议则进行第3 步的文件签署和第4 步的指导原则通过。Q13指导原则描述了连续制造生产模式的开发、实施、操作和生命周期管理的科学和法规注意事项。鉴于目前连续制造生产模式的成熟度,ICH 在未来工作中将讨论关于上市申请、现场检查、上市后变更等的监管考虑,同时也将考虑相关的其他ICH 指导原则(表3)对药品连续制造生产模式的适用性[18]。
自监管科学概念在20 世纪90 年代正式确立后,便受到了WHO 的认可。WHO 认为监管科学是监管决策的基础,用于评估人用药和兽药在整个生命周期内质量、安全性和有效性。在其编纂的《国际药典》(International Pharmacopoeia)第九版中也提到了药品连续制造所涉及的全过程质量控制理念,其中对关键质量属性及有关控制方法的阐述有助于指导连续制造药品的质量风险管理工作[19]。
2 药品连续制造在我国的监管实践与发展现状
原国家食品药品监督管理总局在2017 年以成员身份加入ICH,2018 年6 月国家药品监督管理局当选为ICH 管理委员会成员。自加入ICH 后,国家药品监管部门推动我国充分实施了46个ICH 指导原则,借鉴国际经验深化药品审评审批制度改革,吸引全球创新资源加速流向中国。2021 年6 月,国家药品监督管理局再次连任ICH 管理委员会成员,本次连任也显示了国际社会对我国药品监管工作和药品审评审批制度改革成效的认可,是我国药品监管国际化进程中的又一里程碑事件。对于ICH Q13 的转化实施工作,国家药品监督管理局ICH 工作办公室也相应成立了关于连续制造的专家工作组, 在充分讨论了Q13 指导原则在我国实施可行性的基础上,制定了转化实施时间表和路线图,确保其稳健和充分的实施,现阶段已完成了众多的实施转化工作。按照ICH相关章程要求,2021 年10 月,国家药品监督管理局药品审评中心发布《关于公开征求ICH 指导原则〈Q13 :原料药和制剂的连续制造〉意见的通知》。2021 年11 月,我国ICH 工作办公室邀请国家药品监督管理局药品注册管理司、药品审评中心、食品药品审核查验中心、中国食品药品检定研究院的相关专家和各家医药企业代表召开连续制造转化实施研讨会,并就后续转化实施工作的问题及建议倾听意见。ICH 工作办公室人员表示,后续将增加对Q13 的宣传解读和培训指导,使企业对连续制造生产模式的监管要求有更深入的认识和理解。同时,专家工作组也会关注Q13在国内现有监管体系中的适应性,评估是否需要起草或更新与ICHQ13 配套的相关法规和指导原则,如可能涉及的GMP、PAT、上市后变更内容等[20]。从表1 中可以看出,目前,已有2 种药物(Verzenio®和Cibinqo®) 分别在2021 年和2022 年以连续制造生产模式在我国得到获批。对于中国这样一个有4000 多家医药企业、11 万个化学药品和生物制品文号,并且自身的审评审批体系运行了30 多年的制药大国来说,短时间内推进如此多的实施转化工作,难度远超于其他ICH成员。
自2019 年国家药品监督管理局发布启动实施中国药品监管科学行动计划后,国家药品监督管理局不断增强能力储备,依托国内知名高等院校、科研机构建立了12 个药品监管科学研究基地,同时国家药品监督管理局批准了117 家国家药品监督管理局重点实验室,这些监管科学研究基地和重点实验室,围绕药品全生命周期,聚焦药品监管和医药产业高质量发展需要,对药品各个领域深入开展药品监管科学基础理论和重点项目研究。在药品连续制造方面,北京大学通过举办连续制造研讨会,分享来自FDA、EMA 等的审评专家对于连续制造的思考。此外,北京大学药学院联合国内制药装备公司及国际制药工程协会,共同推进药品连续制造的项目研究[21]。山东大学基于药品连续制造所运用的PAT 和药物制剂技术,搭建药物制剂研发监管科学平台,以制剂生产的“物质基础正确、过程控制准确、体系设计科学”为理念,通过利用近红外光谱分析技术和拉曼光谱技术,实现了药用原辅料实时放行、流化床混合过程原料药含量的在线监测、流化床制粒干燥和包衣过程的在线分析以及流化床制粒过程智能控制系统构建等,探索了灵活性更强的科学监管工具。这些研究进一步夯实了我国药品连续制造的监管科学基础,助力药品监管科学可持续发展[22]。2021 年6 月,在国家药品监督管理局发布的《关于实施中国药品监管科学行动计划第二批重点项目的通知》中,在“恶性肿瘤等常见病、多发病诊疗产品评价新工具、新标准和新方法研究”项目里提出了要针对“连续制造技术实施和技术要求”进行研究,形成临床评价、药物研发等相关技术指导原则和审评路径[23]。该项目体现了国家药品监督管理局着力引导药品连续制造的监管新技术、新业态和新模式发展的决心。在当下新冠肺炎全球大流行药品紧缺的环境下,连续制造因其生产速度快、质量稳定、绿色环保等优点使其更具有特殊且重要的意义。
在国家药品监督管理局中国药品监管科学行动计划的引导下,医药企业和医药行业协会都纷纷加入到药品连续制造的推进工作中。同时集中带量采购政策也对药品生产成本的降低提出了更高的要求,给医药企业的生产能力提出了新的挑战。浙江海正药业股份有限公司根据当地政府转型升级的要求,在台州总部建成自动化、密闭化、管道化、信息化、连续化、可视化的原料药制剂一体化示范项目,开展对速释片剂的连续制造研究。上海东富龙科技股份有限公司针对冻干机在无菌核心区域连续制造的潜力已展开研究。创胜集团已在高度灵活的模块化制造工厂中,开发启用了一体化生物药连续制造的工艺平台,在采用相同细胞株的情况下,此工艺可使原液年产量与传统分批补料工艺相比增加15 倍以上,这一成绩已处于业界领先地位。上海医药集团股份有限公司与星德科包装技术( 杭州) 有限公司签署共建制剂连续化生产技术实验室合作协议,双方将推动连续制造生产模式在国内的应用,缩短新药研发周期,减少新药开发成本,持续提升国内新药尤其是罕见病药物的可及性。2019 年,由上海触界数码科技有限公司主办,药明生物技术有限公司支持的首届“亚洲生物制药连续生产及工艺创新峰会”在上海召开,探讨了连续制造在未来生物制药生产应用的可能性及挑战。2021年,中国医药设备工程协会举办“药品连续制造行业调研工作启动会”,高等院校的专家学者以及协会高级顾问、40 多家知名医药企业和医药互联网企业负责人等共同围绕药品连续制造的调研工作进行深入研讨。上海医药行业协会承担了“应用连续制造技术促进医药产业转型发展研究”课题,并就研究内容在上海药品审评核查中心进行调研交流。该协会还召开了“药品连续制造技术及科学监管”研讨会,讨论连续制造生产模式在国内外最新进展,以促进药品连续制造产业链互动交流,推动生物医药企业向先进制造转型[24]。
3 对我国药品连续制造发展的监管思考与建议
目前我国药品监管框架鼓励连续制造生产模式的发展,但其指导体系还未完全确定,相关法规或指导原则亦有待更新,尚存在法规适用性和技术合规性的偏差,连续制造生产模式的实施、监管批准和产品生命周期管理的手段还有待提升,尤其是当有关产品计划上市销往国际市场时,企业可能会陷入被动。故笔者对未来我国药品连续制造的监管实践与发展提出以下建议。
3.1 依托药品监管科学研究基地继续开展药品连续制造相关的监管科学研究
药品连续制造已在国外发展十余年, 从FDA 在2004 年发布的《行业指南:过程分析技术(PAT)- 用于规范创新药研发,生产及质量保证的框架》,2014年欧盟、日本监管机构对药品连续制造采取监管措施,到2018年ICH 批准Q13 连续制造的议题,国外已就药品连续制造生产模式提出了众多新工具、新方法、新标准,我国药品连续制造工作想要有“质”的发展,完善法律法规体系需排在首位,有关药品连续制造的配套法律法规和政策文件的制定发布工作亟待开展。应以国家药品监督管理局ICH 工作办公室为主体,依托国家药品监管科学研究基地继续开展药品连续制造的监管科学研究工作,通过深刻解读欧美国家监管政策,整合上文所提到的FDA、EMA、PMDA、MHRA、ICH 和WHO的重要法规或指南内容,从形成集合政策和研究案例的国内药品连续制造的白皮书开始,再到结合国家药品监管科学研究基地对生产领域监管科学的研究成果,制定发布我国药品连续制造标准、指导原则或将其写入《中国药典》,以此在监管部门、高等院校和企业之间形成相关知识储备并进行广泛传播,促进相关工作人员、科研人员和研发人员对药品连续制造生产模式的理解和研究。
3.2 多部门联动推进药品连续制造的重点专项试点研究工作
工业和信息化部等八部门联合印发《“十四五”智能制造发展规划》,该规划指出“十四五”及未来相当长一段时期,推进智能制造是我国建设制造强国的主攻方向,而我国想实现从制药大国向制药强国的转变,毫无疑问贯彻智能制造理念的药品连续制造生产模式是其强有力的抓手。建议国家药品监督管理局联合工业和信息化部、科技部共同推进药品连续制造的重点专项试点研究工作,从连续工艺研发、设备创新、智能过程控制和监管体系建设等角度,发挥国家重点实验室或国家药品监督管理局重点实验室的主力军作用,开展药品连续制造的基础研究和应用研究,形成良好的资源配置,以重点专项试点研究工作经验和成果指导企业开展连续制造工艺变更、设备改造和验证等的实施工作,开发出经GMP 认证的连续制造生产线。力争在2030 年, 出现5~10 家药品连续制造领头羊企业,协同带动更多的医药企业实现产业升级。
3.3 以药品上市许可持有人制度政策激发医药行业对药品连续制造的研发创新活力
2019 年新修订的《药品管理法》最大变化和最大亮点就是药品上市许可持有人(Marketing Authorization Holder,MAH)制度的全面引入,实现了药品上市许可与药品生产许可分离,允许药品生产企业、研发机构或科研人员成为独立的MAH,有权自行或委托其他药品生产企业生产药品,并对生产、销售的药品质量承担主要法律责任。该制度更是为药品连续制造在我国的发展提供了契机,可激发医药行业对药品连续制造生产模式的研发创新活力,使得药品生产企业、研发机构或科研人员可以发挥自主能动性,对临床应用较广的药物品种和新药进行连续制造生产模式的研发、设备创新、智能过程控制的探索研究,使其通过GMP符合性检查,推进连续制造药品的注册上市和销售。MAH 制度可以从源头上抑制企业的低水平重复建设,促进药品连续制造生产模式的委托发展和规范性管理,让医药市场各要素灵活流动。为鼓励医药行业对连续制造药品的研发热情,建议国家药品监督管理局在药物审评过程中针对药品连续制造生产模式,开设药品注册快速审批通道,加快药品注册上市进度。同时建议鼓励国外以连续制造获批的药物在我国注册上市,以“引进”促“自研”,形成内外循环的合力,共同推进国内药品连续制造在技术、工艺与监管方面的共同进步。
3.4 加强药品连续制造监管人才培养
基于国家药品监督管理局在国内知名高等院校、科研机构建立的12 个国家药品监管科学研究基地的研究方向,建议在与药品连续制造相关的药品监管科学研究基地从培养方式进行改革,将药品连续制造相关专业的理论指导与丰富的实践经验相结合,培养一批有知识、懂技术的药品连续制造专业人才。药品连续制造作为一种多学科交叉的研究方向,需要多学科交叉应用的创新融合转化,可按照教育部、财政部、国家发展改革委联合印发《关于深入推进世界一流大学和一流学科建设的若干意见》,促进学科交叉融合,加强急需学科专业人才培养,形成跨学科的药品连续制造合作研究平台,开展高水平学术交流,培养具有国际视野、通晓国际规则的卓越监管人才。
4 结语
当前, 中国正处于“ 两个一百年”奋斗目标的历史交汇期,面临着世界百年未有之大变局,这是一个机遇与挑战并存、变革与创新激荡的时代,也是我国从制药大国向制药强国转变的关键时期。药品连续制造作为被美欧日等发达国家和地区高度重视的新兴技术,也是未来全球药品生产模式的大趋势和战略需求,我国一直坚持国际化监管视野,在未来可进一步聚焦药品连续制造关键性、基础性、应用性和前瞻性的监管科学难题,持续创新我国监管政策、法规和制度,持续提升我国药品监管能力,增强我国在国际药品监管领域的话语权,使我国更多的新药好药造福大众。

来源:中国食品药品监管杂志


