您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-06-24 10:46
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
石药RANKL抗体新药报产。石药集团子公司津曼特生物的1类生物药纳乐舒单抗注射液的上市申请获CDE受理。根据公开信息,推测该新药为JMT103。JMT103是一款创新型全人源RANKL单抗,通过对同靶点药物地舒单抗的结构进行优化,在增强亲和力的同时简化了生产工艺。一项关键JMT103CN03研究结果显示,JMT103治疗不可切除或手术困难的骨巨细胞瘤有较好的临床疗效,肿瘤反应率高达93.5%,且起效时间较快。
国内药讯
1.默克西妥昔单抗获批新适应症。NMPA批准德国默克抗肿瘤新药西妥昔单抗注射液(商品名:爱必妥)联合放疗用于治疗局部晚期头颈部鳞状细胞癌(LA SCCHN)。在国际Ⅲ期临床(Bonner)中,与单独放疗相比,联合治疗显著提高局部控制(主要终点)并显著延长患者总生存期,3年局部控制率达到47%,5年总生存率达到45.6%。西妥昔单抗是全球首款靶向EGFR的IgG1单抗药物,目前已在中国获批4项适应症。
2.正大天晴三靶点激酶抑制剂报产。正大天晴TQ-B3101胶囊的上市申请获国家药监局受理,推测适应症为ROS1阳性局部晚期或转移性非小细胞肺癌(NSCLC)患者。TQ-B3101是一款靶向ALK/ROS1/MET的新型小分子受体酪氨酸激酶抑制剂。公布于欧洲肺癌大会上的II期临床(TQ-B3101-II-01)结果显示,在这类患者中,TQ-B3101的ORR达到78.4%,DCR为87.4%。中位PFS为15.6个月,中位DoR为 20.3个月,中位OS尚未达到,12个月和24个月OS分别为98.1%和88.1%。
3.神州细胞2价新冠疫苗加强针数据积极。神州细胞自主研发的重组新冠病毒Alpha+Beta变异株S三聚体蛋白疫苗SCTV01C在阿联酋开展的针对已接种灭活疫苗人群接种1针SCTV01C加强免疫的I/II期临床期中结果积极。SCTV01C接种28天后,可产生广谱交叉中和抗体反应,数值上均明显高于国内I期临床中未免人群接种2针SCTV01C的交叉中和抗体滴度值。SCTV01C加强免疫的安全性良好。详细数据将公布于科学期刊上。
4.IL36R抗体首次在华报IND。AnaptysBio公司与上海百利佳生物联合申报的IL36R抗体Imsidolimab(ANB019)的临床试验申请获CDE受理。Imsidolimab是AnaptysBio开发的一款抑制白细胞介素36受体或IL-36R功能的抗体,拟开发用于泛发性脓疱型银屑病、PRIDE综合征、化脓性汗腺炎等适应症。该新药此前曾在用于治疗中重度掌跖脓疱病和重度痤疮的两项II期临床相继失败。此次为Imsidolimab首次在国内申报临床,适应症暂时未知。
5.凡恩世FIC双抗获FDA孤儿药认定。凡恩世公司“first-in-class”抗体药物PT217获FDA授予孤儿药资格,拟用于治疗小细胞肺癌。PT217是该公司的双特异性抗体平台PACbody™开发的一款靶向DLL3和CD47的双抗。这是一种不需要蛋白质工程来构建天然IgG结构的双特异性抗体专有方法,从而使抗体分子保持具有卓越CMC特性的天然结构。此前该公司开发的两款新药CD73单抗PT199和Claudin18.2/CD47双抗PT886已获得FDA临床许可。
国际药讯
1.诺华不限癌种组合疗法获FDA加速批准。FDA加速批准诺华BRAF抑制剂Tafinlar(dabrafenib)联合MEK抑制剂Mekinist(trametinib),用于治疗携带BRAF V600E的无法切除或转移性实体瘤成人和6岁以上儿科患者。在一项临床研究中,这一组合在携带BRAF V600E的实体瘤患者中达到80%的总缓解率,患者包括高级别和低级别胶质瘤、胆管癌,以及某些妇科和胃肠道癌症。在儿科患者中,Tafinlar+Mekinist同样显示出临床获益和可接受的安全性特征。
2.默沙东15价肺炎球菌疫苗获批用于儿童。FDA批准默沙东15价肺炎球菌结合疫苗Vaxneuvance扩展适用范围,用于在6周至17岁的儿童中预防因为肺炎球菌感染导致的侵袭性疾病。Vaxneuvance是由与CRM197载体蛋白结合的肺炎链球菌血清型1、3、4、5、6A、6B、7F、9V、14、18C、19A、19F、22F、23F和33F纯化荚膜多糖组成,此前该疫苗已获得FDA批准,在18岁以上成人中预防由疫苗中所含肺炎链球菌血清型引起的侵袭性疾病。
3.外用基因疗法B-VEC报BLA。Krystal Biotech公司基因疗法B-VEC(beremagene geperpavec)已向FDA递交生物制品许可申请(BLA),用于治疗营养不良性大疱性表皮松解症(DEB)。B-VEC旨在通过基因工程改造的HSV-1载体,将两个具备正常功能的COL7A1基因拷贝直接递送至患者的皮肤细胞中。在关键性GEM-3临床试验中,与安慰剂相比,B-VEC治疗组6个月时患者伤口完全愈合的比例更高(67%vs22%,p<0.005)。B-VEC的总体耐受性良好,可重复给药。
4.奥拉帕利治疗mCRPC最新Ⅲ期结果积极。阿斯利康与默沙东开发的PARP抑制剂奥拉帕利(Lynparza)与标准治疗联用,一线治疗转移性去势抵抗性前列腺癌(mCRPC)的Ⅲ期临床PROpel研究成果发表于《新英格兰医学杂志》子刊NEJM Evidence上。与安慰剂联合abiraterone和强的松(prednisone)相比,Lynparza联合治疗使疾病进展或死亡风险降低34%(HR=0.66,95% CI:0.54-0.81,P<0.0001),两组的中位rPFS分别为24.8个月和16.6个月。而且联合治疗的安全性与已知研究一致。
5.诺华近15亿美元布局体内基因编辑疗法。诺华与Precision BioSciences将利用后者独特的ARCUS基因组编辑技术平台,合作开发ARCUS核酸酶候选疗法,用于在患者体内直接对造血干细胞的基因组进行编辑,在基因组的安全位点插入用于治疗镰刀型细胞贫血症和β地中海贫血等转基因,以达到一次性治愈镰刀型细胞贫血症和β地中海贫血等多种血红蛋白病。根据协议,Precision将获得7500万美元的前期付款,以及高达14亿美元的里程碑潜在付款。诺华将拥有候选疗法的独家研发权益。
6.盐野义新冠口服药S-217622被暂缓批准。日本厚生劳动省宣布暂缓批准盐野义新冠口服药S-217622上市,理由是“需要进一步仔细讨论”。S-217622是由北海道大学和盐野义共同开发,药物原理与辉瑞新冠药Paxlovid相似,均为通过抑制3CL蛋白酶活性来抑制病毒自我复制。今年4月,盐野义在欧洲临床微生物学和传染病大会上宣布,Ⅱb期研究结果显示该新药对新冠病毒“快速的清除能力”。
医药热点
1.河南计划培养1万名骨干医生。河南省卫健委日前透露,河南省正式实施“栋梁521计划”,即投入近2亿元专项资金,利用5年时间,为市、县两级医疗机构培养1万名骨干医生,以加强医疗队伍建设。据悉,该省今年将为县(市)属医疗机构培养1200名左右的骨干医生,涵盖专业包括心血管、神经、儿科、肿瘤、医务管理、医技等。
2.国家随机监督抽查将启动。6月22日,国家卫健委发布《关于印发2022年国家随机监督抽查计划的通知》,部署今年国家随机监督抽查任务。《通知》明确,监督抽查内容主要包括:医疗卫生机构预防接种管理情况,重点检查新冠疫苗的接收、储存、接种等;医疗卫生机构传染病疫情报告、疫情控制、消毒隔离措施落实、医疗废物管理等;加大对开展医疗美容、医学检验、健康体检、近视矫正等服务的医疗机构及养老机构内设医疗机构的抽查力度等。
3.医疗机构自然指数排名发布。2022年6月自然指数(Nature Index)最新排名发布,此次数据纳入了2021年3月1日至2022年2月28日期间的统计数据,四川大学华西医院论文计数*得分119,分数计数*得分49.38,位列全球医疗机构第14位,中国医疗机构第1位。在nature index纳入的研究产出数据中,华西医院主要包含生命科学、化学和物理学领域,其中生命科学领域论文计数贡献最高,而化学领域分数计数贡献最高。
评审动态
2. FDA新药获批情况(北美06月22日)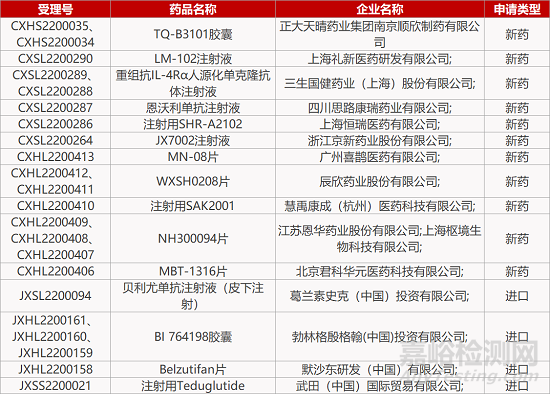
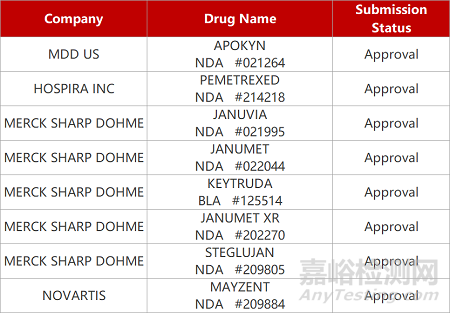

来源:药研发


