您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-11-21 23:26
摘 要
Abstract
在药物研发过程中,临床研究报告的撰写和向监管部门的递交标志着药物研发从临床试验阶段进入审评审批阶段,这一过程的规范实施对提高药物研发效率、保障后续审评审批工作的顺利开展有重要意义。新修订《药品注册管理办法》实施后,国家药品监督管理局通过发布实施一系列规范性文件,对临床研究报告的撰写和递交要求进行了调整和优化。本文将从技术和管理两个方面,探讨《药品注册管理办法》实施后临床研究报告撰写和递交要求的变化,以及临床研究各相关方需要关注的问题。
Writing a clinical study report and submitting it to the regulatory department is an important milestone in the pharmaceutical R&D process, marking the transition from clinical trials to review procedure. The effective writing and submission of clinical study reports is of great significance to improving the efficiency of drug review and accelerating the R&D process. Since implementation of the newly-revised Provisions for Drug Registration, the National Medical Products Administration has adjusted and optimized requirements for writing and submitting clinical study reports by issuing a series of supporting documents. This article discusses the technical and administrative adjustments in the requirements for writing and submitting clinical study reports as well as issues related to clinical trials that deserve attention.
关键词
Key words
药品注册管理办法;临床研究报告;申办方;研究者;临床试验机构;注册受理审查
Provisions for Drug Registration; clinical study report; sponsor; investigator; clinical research site; registration acceptance review
在药物研发过程中,申办方完成临床试验后,临床研究报告的撰写和向监管部门的递交是临床试验结束的关键里程碑,标志着药物研发从临床试验阶段进入审评审批阶段。这一过程的规范实施对提高药物研发效率、保障后续审评审批工作的顺利开展具有重要意义。一方面从技术角度,临床研究报告作为传递临床试验数据的最重要媒介,其结构和内容应系统完整地呈现临床试验结果,以帮助药品审评部门准确评价试验药物的安全性、有效性;另一方面从管理角度,临床研究报告的审核、保存和递交程序涉及申办方、研究者、临床试验机构、监管部门等各相关方,是药物临床试验管理体系的重要环节,科学的程序管理有助于在确保各相关方对临床试验完成情况和报告内容达成共识的同时,提高申办方的递交效率。
按照国家药品监督管理局(以下简称“国家药监局”)2019 年11 月发布的《关于适用〈E1 :人群暴露程度:评估非危及生命性疾病长期治疗药物的临床安全性〉等15 个国际人用药品注册技术协调会指导原则的公告》(2019 年第88 号),2020 年5 月起受理的新药上市申请(NDA)已经适用《ICH E3 :临床研究报告的结构与内容》[1]。同时,随着新修订《药品管理法》和新颁布《疫苗管理法》的实施,2020 年,国家药监局发布了新修订《药品注册管理办法》及一系列相关配套文件(表1),对临床研究报告的保存和递交要求进行了调整和优化。本文将从技术和管理两个方面,探讨《药品注册管理办法》实施后临床研究报告撰写和递交要求的变化,以及临床研究各相关方需要关注的问题。
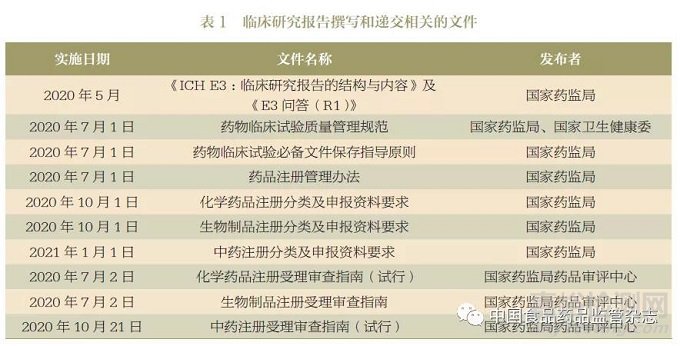
一、临床研究报告的内容要求与国际接轨,报告内容更加详实,结构更加合理
ICH E3 在我国完全实施前,临床研究报告的格式和内容要求主要参考《化学药物临床试验报告的结构与内容技术指导原则》[2]、《中药、天然药物临床试验报告的撰写原则》[3] 和《疫苗临床研究报告基本内容书写指南》[4] 等。上述指导性文件尽管对报告细节的要求略有差异,但对总体结构和内容的要求基本一致。报告正文内容包括:①临床试验的基本信息,如研究概要、伦理学相关资料、研究者和研究机构等研究管理信息;②临床试验的设计和实施情况,如人群选择、试验过程记录、统计方案和数据质量控制等;③临床试验结果,如有效性、安全性、方案变更和偏离等。除了报告正文,申办方还应在附件中提供临床试验的统计分析报告和分中心小结。随着国内药物临床试验规模的扩大和复杂程度的不断提高,以及国际多中心临床试验总结和跨国申报需求的增加,上述临床研究报告的要求逐渐无法适应药物注册申报的需要,例如报告格式的标准化和数据精细程度不高,不同申办方报告正文内容的详细程度差别较大,正文和附件的内容可能存在重复,而且试验信息分散在各个附件中,不利于提高技术审评的效率。
ICH E3 完全实施后,临床研究报告结构和内容的要求有两个显著变化。一是报告内容更加详细,实现“研究总结报告”向“研究报告”的转变。在既往要求的基础上,除了对研究结果进行总结性描述,申办方还应根据临床试验设计对研究结果进行多层次的深入分析和描述。例如,安全性评价部分细化了对不良事件列出方式和分析描述的要求,增加严重不良事件或重要不良事件的描述和分析讨论;有效性评价部分细化了对个体疗效数据、剂量-效应关系、药物- 疾病作用等分析的要求。二是研究报告的整体性更高,ICH E3 实施后临床研究报告不再要求单独提交统计分析报告和分中心小结表,而是将统计分析和分中心研究信息并入研究报告的相应章节,临床试验结果的整合程度更高,数据展示的逻辑和层次更加清晰,有助于提高审评人员的工作效率(图1)。同时,ICH E3 完全实施后我国对临床研究报告的结构和内容要求与ICH 其他成员基本相同,将显著提高申办方在不同国家或地区开展注册申报的效率。
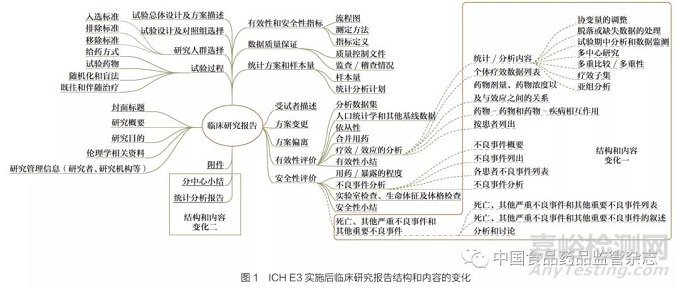
二、优化临床研究报告递交程序,提高申报效率
按照我国既往发布的化学药、中药和生物制品临床试验报告撰写相关的技术指南以及受理审查要求,申办方开展药品注册申请时,向药品审评部门递交的临床研究报告除申办方盖章外,还需临床试验机构和统计单位审核盖章,上述行政审批流程在一定程度上加强了临床试验实施和数据分析单位对临床研究报告内容的审核。但另一方面,临床研究报告作为递交给药品审评部门的技术资料,增加申办方之外的行政印章程序,并不能为技术审评部门提供更多临床研究信息,同时,实际操作中行政审批流程需要付出额外的精力和时间,降低了申报效率,不利于落实申办方统筹实施药物临床试验和注册申报的主体责任。
随着我国药物临床试验相关法律法规文件的健全,以及药物临床试验质量管理体系的推广落实,申办方在临床试验过程中开展的临床监查、稽查,数据的记录、处理和保存,以及研究者实施的临床试验记录和报告等都是保证临床研究报告内容真实、可靠和可溯源的重要手段。2020 年,为落实《药品管理法》《疫苗管理法》《药品注册管理办法》等法律规章中关于临床试验和注册申报的相关要求,国家药监局药品审评中心在化学药、中药和生物制品注册受理审查指南[5-7] 中明确了临床研究报告的递交要求:临床试验报告应符合相关技术指导原则要求,临床试验报告标题页应提供药品注册申请人(签字及盖章),主要或协调研究者(签字)、负责或协调研究单位名称、统计学负责人(签字)和统计单位名称及ICH E3 要求的其他信息;临床试验报告附录II 中应提供申办方负责医学专员签名。递交给药品审评部门的临床试验报告不再要求临床研究机构和统计单位盖章。
对申办方向药品审评部门递交临床试验报告前行政审批流程的简化,并不表示药品监管部门放松对临床试验报告的要求,而是基于强化临床试验过程管理、明晰临床试验各环节责任主体、提高药品研发和注册申报效率的要求,是“质量源于设计”的药品质量控制理念在临床试验管理中的体现。申办方与研究者和研究机构的充分沟通,是保证临床研究报告质量、维护临床试验各参与方合法利益的重要前提。申办方向药品审评部门递交临床研究报告前,应与临床试验参与人员和机构确认报告内容的真实性、完整性、准确性和可溯源性,并确认各相关方对临床试验完成情况和报告内容达成共识。研究者和临床试验机构等相关方须按照国家药监局发布的《药物临床试验必备文件保存指导原则》[8] 的要求,妥善保管确认记录,如临床试验的完成文件和总结报告等,供申办方稽查或药品监督管理部门检查(图2)。
三、临床研究报告内容和递交要求变化对临床试验各相关方的影响
(一)申办方
ICH E3 实施后,既往由临床试验不同参与者提供的总结资料,如统计分析报告和分中心小结,整合入临床研究报告,使得临床研究报告的整体性显著提高,同时也增加了报告撰写的复杂程度,需要研究者、数据处理和核对人员、统计分析人员更加密切地配合,这一变化要求申办方强化对临床试验过程和研究报告撰写的统筹协调和质量管理,确保临床研究报告能够提供药品审评部门开展技术审评所需要的全部信息。
药品注册受理相关要求中大幅简化临床研究报告向药品审评部门递交前的盖章审核流程要求,是基于申办方对于包括临床试验在内的药物研发全过程负有主体责任的认识。一方面,简化行政审批流程可以显著提高申办方的递交效率;另一方面,申办方作为临床试验质量管理体系的责任人,注册申报前应与研究者和临床试验机构就临床试验的完成程度、受试者权益保护、临床研究报告内容等达成共识,确保研究者和临床试验机构按照相关要求保存临床试验原始记录和必备文件。
(二)研究者和临床试验机构
我国实施ICH E3 后,临床研究报告内容更加细化,对研究者记录、报告和分析临床试验信息的能力提出更高要求,也需要研究者更加重视临床试验的设计和实施过程。例如,有效性分析中除了主要和次要疗效指标的分析,还应关注剂量- 效应关系、伴随用药或并存疾病对疗效的影响等。
药品注册受理审查要求中临床研究报告不再要求临床研究机构盖章后,如何确保临床研究机构及时知晓申办方的注册申报计划,避免临床研究机构与申办方产生沟通滞后,并配合申办方做好临床试验项目管理、受试者权益保护、配合接受临床核查等,是临床试验各相关方共同关注的问题。简化申报资料的行政审批要求不意味着降低试验机构在临床试验管理中的重要性,首先,《药物临床试验质量管理规范》(GCP)[9] 中明确了研究者、临床试验机构和申办方等相关方的责任和义务,各方严格按照GCP相关要求履行各自职责是保证临床试验质量的基本要求;其次,试验各相关方需充分认识临床试验必备文件中试验完成文件和试验总结报告的重要性,它们是研究者和临床试验机构知晓并认可临床试验完成状态和临床研究报告内容的重要证明,也是临床试验监查或者药品监管部门核查的重点内容。研究者应按照《药物临床试验必备文件保存指导原则》的要求,在临床试验完成后及时向伦理委员会递交临床试验完成文件,并保存试验总结报告。
需要注意的是,随着我国创新药研发越来越活跃,很多药物临床试验需要对受试者进行长达数年甚至更长时间的随访,申办方可能在完成临床试验主要终点的阶段性研究目标、但受试者随访未完全结束前向药品监管部门递交注册申请,因此,临床试验完成文件中有必要对临床试验的完成阶段、后续研究任务或随访计划等进行说明。
四、总结
国家药监局通过发布实施一系列与临床研究报告撰写和递交相关的规范性文件,完善了涵盖临床试验质量管理、临床试验必备文件保存、临床研究报告撰写和递交的管理体系,申办方、研究者和机构等临床试验各相关方在临床试验管理和注册申报中的责任和义务更加清晰。各方在及时了解临床研究报告内容和递交要求变化及对自身影响的基础上密切沟通、协调配合,对于保证临床试验报告的质量、提高注册申报效率有重要意义。

来源:中国食品药品监管杂志


