您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-01-12 09:10
FDA申报3.2.P.3.4中包括三个内容,见下图1所示:
1.注册批次的可接受标准及检测结果;
2.注册批次与商业批次所用的设备及控制标准的对比表;
3.中间体存放信息。

图1. FDA申报3.2.P.3.4中截图
其中第一、二条的内容大家可能比较熟悉,因此,本文主要结合WHO和GMP介绍第三条即中间体存放信息的关键点。
为什么要做存放时间考察?
GMP要求所使用的原料、中间体粉末或颗粒、待包装成品以及最终的成品均是在恰当的存储条件下储存的,因此,所选的存储条件应能确保原料、中间体或待包装样品的安全性(如有关物质、微生物)、有效期(如含量),同时要保证这些非最终的产品在后续生产工序中能顺利、稳定的进行下去,不影响后续生产工艺(这里是指已经过验证的、既定的生产工艺)。因此,若是非连续性生产的样品,在生产之后与进行下一步生产前的这个过渡期,应确保最大存放时间是有效的,不会产生任何对质量和工艺有影响的副作用。而这个时间的确定是需要数据来支持的,以支持我们的样品存储于这个时间内不会对整个生产周期有影响。
什么时候建立存放时间考察?
存放周期(或时间)的考察研究应在产品上市前就确定下来。它的研究过程可以在研发过程中的中试规模或放大过程中进行,并在商业化规模的工艺验证中进行验证确认,也可以考虑从生产过程中的偏差调查中收集更多信息。此外,涉及工艺、设备、存贮条件、起始物料和包材发生变更的风险评估,也应包括是否需要对存放周期进行研究。
我们可以借用一个完整的工艺流程图来对整个生产过程进行回顾审核,然后将生产工艺的关键工序根据是否需要特殊存贮和加工过程时间,以及环境和存贮条件是否存在潜在影响进行划分。一般而言,物料在生产周期中都会进行停顿,接下来以常见的口服固体片剂为例,如图2所示:
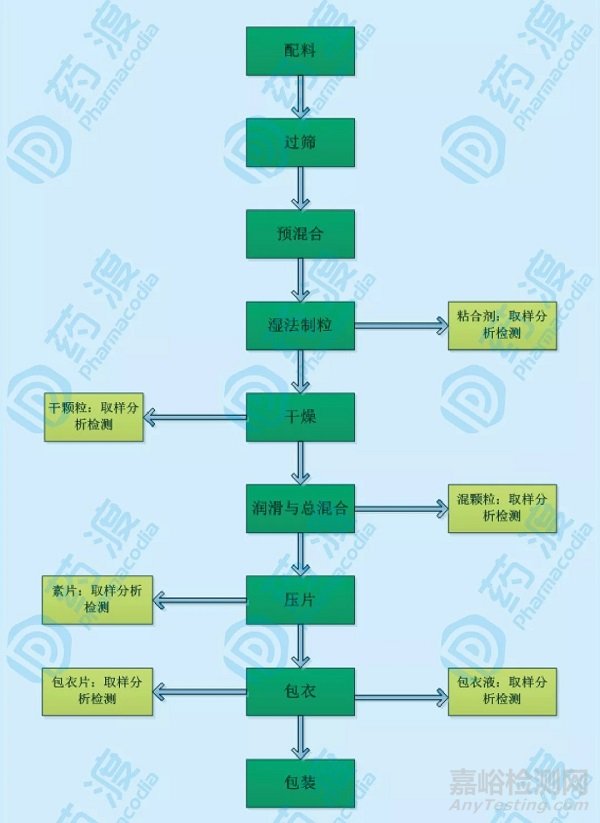
图2:常见口服固体片剂的生产工艺图及取样点考虑
上图口服片剂的生产工序,包括配料、(原辅料)过筛、预混合、制粒、干燥、加润滑剂后的总混合、压片、包衣,至最后的成品包装。对于这个含有包衣的片剂生产,图2中标黄的部分可以考虑进行存放周期考察,考察项目如下:
用于制粒的粘合剂:可考虑检测项目包括微生物、外观、粘度;
干燥后的干颗粒:可考虑检测项目包括性状、含量、有关物质、LOD、水份含量、PSD、堆密度、振实密度、休止角;
加入润滑剂后的混颗粒:可考虑检测项目包括微生物检测、LOD、BU、PSD、堆密度、振实密度;
压片后的素片:可考虑检测项目包括性状、硬度、片厚、脆碎度、崩解时限、溶出度/溶出曲线、含量、有关物质、剂量均匀度、微生物;
用于包衣的包衣液或包衣混悬液:可考虑检测项目包括物理性状、比重、粘度、沉积物、pH值、微生物;
包衣后的包衣片(未包装):可考虑检测项目包括性状、硬度、片厚、脆碎度、崩解时限、溶出度/溶出曲线、含量、有关物质、水分含量、微生物;
可参考的检测项目及考察存放周期取样点可参见下图3:
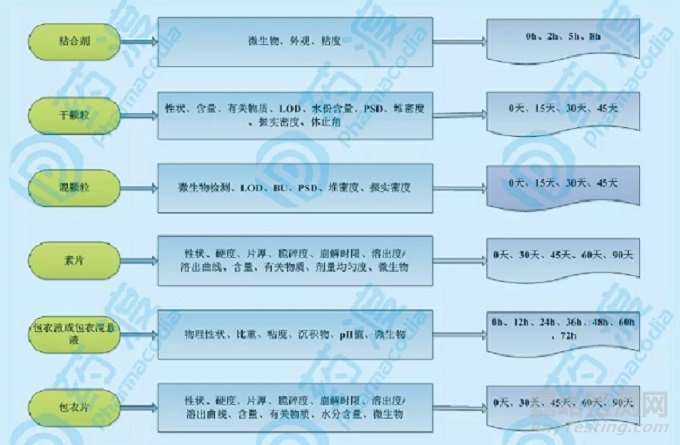
图3:口服固体片剂可参考的检测项目及考察存放周期取样点
待需要考察的检测项目确定后,其可接受标准一般严于注册标准,以保证物料更好地受控。对于某些样品或产品,必要的时候也应将微生物考察项列入其中。上图中列出的考察点、考察时间及检测项目并非强制性的内容,仅供参考使用。
案例一:包衣液的hold-time study
缓释微丸在进行缓释层包衣时,因包衣周期较长,且包衣过程中包衣液需持续搅拌,因此包衣液的粘度对产品的最终释放度起着非常重大的作用,为此,对包衣液的持续搅动做了一个hold-time study的考察,考察结果见下图4:
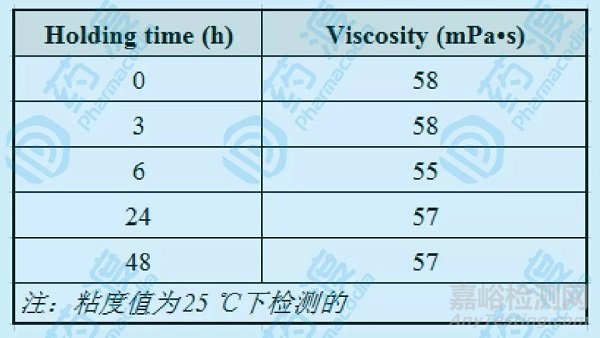
图4:包衣液hold-time考察
包衣液在配制好即0h时,粘度(25℃)为58mPa•s,此后在3h、6h、24h以及终点48h分别取样检测包衣液的粘度,从图4的检测数据可以看出,包衣液在持续搅拌48h的过程中,包衣液的粘度基本维持在55-58 mPa•s范围,也就是说在持续搅拌的48h内粘度未发生变化。这组数据即可用于生产工艺的可行性支持。
案例二:总混颗粒的hold-time study
总混颗粒在总混完后,有时因车间排产情况,不会立即进行压片或填胶囊,企业可根据自身的生产经验及车间排产经验,对颗粒进行存放周期验证。如在某车间里,颗粒一般在混合完7天内能确保进行压片(或有相关的内部文件强制要求),那么可对颗粒存放7天或9天做一个存放周期的验证,以确定总混物料在车间正常条件下存放7天或9天后仍可进行后续工序的完成。
考察方法:取验证批的一部分物料,把物料置于车间存放一定的周期;
考察项目:颗粒的形状、水分、含量、有关物质;
取样位置:颗粒表面下X厘米(有代表性的位置);
接受标准:颗粒无结块,水分符合要求,含量、有关物质符合要求
同样的,对于压片完后的素片,若后续需包衣,但又不立即包装,也可根据车间实际的生产经验进行相应存放周期考察,以确定素片在车间正常条件的存放周期内仍可继续用于后续工艺。考察项目可包括素片的外观、水分、脆碎度、含量、有关物质、崩解、溶出等,可接受标准为上述考察项均应符合要求。
存放时间考察其它注意点
一般而言,可使用一个批次或多个批次的原料、中间体、待包装样品来确定他们的可存放时间。样品存贮的环境条件应与暂存区域或生产工序的条件相同,如素片在考察时可放在车间中间站中考察。进行存放时间考察的包装材料应与实际生产中所用的包装相同,例如,素片在进行下一步工序前是放置于双层聚乙烯袋中,那么考察时,素片应是放在双层聚乙烯袋中进行研究的,而不是放在瓶子或其它容器中。
保存时间的研究应基于其在生产中使用的原装或模拟容器中物料的研究制定,然后建立并遵守取样计划,以在不同时间间隔取样检测。考察样品在检测时间点时所测的数据应与起始数据(0天数据)进行对比,通过最终结果的分析来预测样品可接受的存放周期。
后记
本文所述的内容主要是针对非无菌固体制剂的设计策略,而其中有些原理也可以应用在其它剂型(如液体制剂、乳剂、软膏剂等)。另外,本文所述的存放周期考察内容,不适用于清洁验证中的存放周期考察问题(如已清洁设备的存放周期考察),也不适用于原料药和生物制剂生产过程中的存放周期考察。
此外,本文所述hold-time考察也只是起一个引导性的作用,并非具体流程。而且最长保存时间的最终选择应有相应的数据来支持,而不是靠其它的经验。
主要参考资料:
1.WHO 第992号技术报告 附录4:保存时间研究通用指南
2.口服固体制剂GMP实施指南
3.QbD MR案例

来源:药渡


