您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-07-03 11:54
为保证口服固体制剂的体外溶出试验数据的准确性和重现性,除了溶出度仪需要进行机械验证和性能确认外,还应对溶出方法进行方法学验证,溶出方法验证主要包括两个部分,即溶出过程(溶出参数)的验证和数据分析的验证。
溶出过程的验证主要是评估供试品溶液制备的精密度和耐用性。数据分析的验证包括专属性、线性和范围、精密度、准确度/回收率、耐用性和溶液稳定性,数据分析的验证主要是测定方法的准确性和耐用性。
1、溶出过程(溶出参数)的验证
1.1溶出过程主要包括介质的配制、介质温度、介质体积、转速、取样时间点、取样量、补液量(如有需要)等。一般验证介质是否脱气、介质温度浮动、转速浮动、表面活性剂用量等。下表为例:
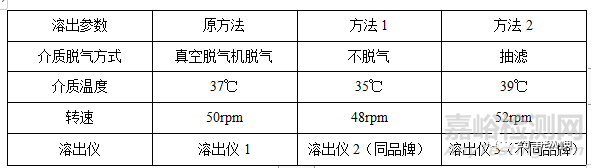
1.2溶出液的滤膜吸附试验
根据前期的滤膜吸附预实验筛选的滤膜,重新对所用滤膜进行滤膜吸附试验。
对于标准溶液,比较过滤溶液(弃去的适当体积后)和未过滤溶液的含量测定结果;对于样品溶液,比较过滤(弃去适当体积后)、离心、未过滤样品溶液的含量测定结果。一般吸附率小于2%,认为滤膜对溶液无吸附作用。
2、数据分析(以色谱参数为例)的验证
2.1专属性
空白辅料是指除了活性成分外的所有辅料和包衣材料空白辅料的干扰可以通过加标的空白辅料进行评估,加标空白辅料指称取一定量的空白辅料混合物,用溶出介质溶解或分散至试验浓度,再加入已知量的原料药溶液。优选在37℃条件下进行,通过与试验浓度的对照品溶液对比计算干扰量,干扰量不能超过2%。
一般是进空白溶液、空白辅料溶液、加标空白辅料溶液;对比色谱图或者吸光度,看是否有干扰。
2.2线性与范围
线性一般通过制备系列浓度的对照品溶液,药物浓度范围为低于药物溶出释放过程中的最低点浓度至高于药物溶出释放过程中最高点的浓度,一般至少包括5个浓度点。通常情况下,系列浓度溶液由同一储备液配制得到,并且不得超过方法的线性范围以及仪器的测量范围。
线性方程一般通过最小二乘法计算,相关系数(R2≥0.98),此外,y轴截距应接近于0。
2.3准确度/回收率
准确度/回收率一般通过制备含有药物和制剂中组成成分(如辅料、包衣材料、胶囊壳)的多规格样品建立的,浓度的下限为药物释放时预期浓度的最低值,上限为预期浓度的最高值。准确度/回收率可以结合线性一起进行测定,可以采用标准品加入法。在此之前,过滤器的评估应该已经完成,而且药品在玻璃上的吸附已经排除。缓释制剂回收率范围采用浓度下限、100%点、浓度上限;速释制剂回收率范围一般为溶出度限度的±20%,如本品溶出度限度定为80%,一般回收率范围为60%、80%、100%。
2.4溶液稳定性
标准溶液贮藏在能确保其稳定性的条件下,应在指定的时间内分析标准溶液的稳定性,在每个时间间隔使用新配制的标准溶液进行比较,标准溶液稳定性可接受的范围受浓度的影响,通常是预期最终浓度的98%-102%。
样品溶液一般在室温下贮存,样品应在指定时间段进行分析,与最初分析的样品溶液进行比较,样品溶液稳定性通常的可接受范围98%-102%,,如果溶液不稳定,需要考虑温度(需要冷藏)、避光、以及容器材料(塑料或玻璃)。
2.5精密度
2.5.1重复性
推荐重复性测定用覆盖浓度范围的九个确定的浓度点(三个浓度点,每个浓度点重复制备三份样品)或在100%测试浓度点至少制备6份样品溶液进行测试,可接受的验收标准为RSD<2%。通过采用质量完好的制剂或与制剂相等组成(原料+辅料)的溶解步骤的独立单元进行溶解步骤重复性的证明。
2.5.2中间精密度
由同一实验室另一分析人员使用不同分析仪器进行,按重复性试验步骤操作。
使用相同浓度,在任何两个条件之间溶出结果平均值的差,在单点的溶出小于85%点,差值不能超过10%,大于85%的时间点,差值不能超过5%。
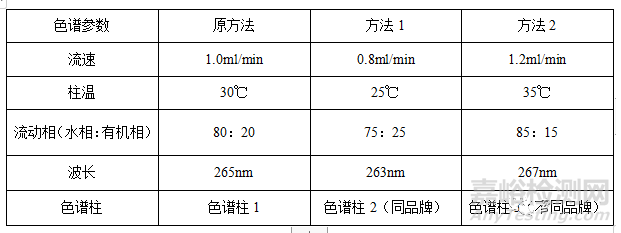
2.6耐用性
将色谱条件中的参数作适度变化后,如色谱条件中的流速、柱温、流动相组成比例、波长及色谱柱的厂家等参数作微小调整对测定结果基本不会产生显著性影响。
下表为例:
以上仅个人工作经验总结,如有不同意见,欢迎交流。
参考文献:
1. USP <1092> THE DISSOLUTION PROCEDURE: DEVELOPMENT AND VALIDATION
2. 2015版中国药典

来源:药事纵横


