您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2018-04-16 10:38
对于一个试验究竟需要开展多少例?不是盲从以往项目的经验,也不是随随便便就开展,还是从科学的角度,进行设计和计算。具体还是要重视统计专家。
一、CFDA对于医疗器械病例数的要求(不含IVD)
1.1《医疗器械临床试验质量管理规范》
第二十七条未在境内外批准上市的新产品,安全性以及性能尚未经医学证实的,临床试验方案设计时应当先进行小样本可行性试验,待初步确认其安全性后,再根据统计学要求确定样本量开展后续临床试验。
1.2《产品注册指导原则》
对于有指导原则的产品,可以参考指导原则。虽然有指导原则,具体还是要根据产品的特点、特性进行评估。
例如:某指导原则对于样本量要求:样本量根据受试产品的临床试验设计类型、主要评价指标等因素来确定。需详细写明样本量估算采用的软件或公式,以及公式中的所有参数及其估计值,还应结合临床实际情况考虑试验对象的可能脱落率等因素。对于非劣效试验设计,应由临床专家和统计学家事先给出具有临床意义的非劣效界值。对于单组目标值设计,亦需明确给出目标值确定的合理依据。
所以具体多少例还是要根据产品特点、设计类型,设计方法、主要疗效终点多方位因素进行统计计算。
二、历年注册CFDA提出的医疗器械方案病例数的问题
2.1 未提供样本量的具体计算过程及确定依据。
2.2未提供样本量计算公式中各参数的确定依据,如:非劣效界值。
2.3未提供临床随访时间的确定依据。
2.4未明确主要评价指标、次要评价指标及其相关依据。
2.5未明确主要终点指标及时间窗的选择依据。
可见CFDA对于病例数还是很重视的,千万要重视。
三、如何开展一项临床试验,并保证病例数合适
3.1《医疗器械临床试验设计指导原则》
临床试验收集受试人群中的疗效/安全性数据,用统计分析将基于主要评价指标的试验结论推断到与受试人群具有相同特征的目标人群。为实现样本(受试人群)代替总体(目标人群)的目的,临床试验需要一定的受试者数量(样本量)。样本量大小与主要评价指标的变异度呈正相关,与主要评价指标的组间差异呈负相关。
样本量一般以临床试验的主要评价指标进行估算。需在临床试验方案中说明样本量估算的相关要素及其确定依据、样本量的具体计算方法。后文提供了样本量估算公式的样例,供参考。确定样本量的相关要素一般包括临床试验的设计类型和比较类型、主要评价指标的类型和定义、主要评价指标有临床实际意义的界值、主要评价指标的相关参数(如预期有效率、均值、标准差等)、Ⅰ类和Ⅱ类错误率以及预期的受试者脱落和方案违背的比例等。主要评价指标的相关参数根据已有临床数据和小样本可行性试验(如有)的结果来估算,需要在临床试验方案中明确这些估计值的确定依据。一般情况下,Ⅰ类错误概率α设定为双侧0.05或单侧0.025,Ⅱ类错误概率β设定为不大于0.2,预期受试者脱落和方案违背的比例不大于0.2,申请人可根据产品特征和试验设计的具体情形采用不同的取值,需充分论证其合理性。
3.2计算公式
决定样本量的关键因素有:产品特点、研究类型、主要评价指标、对照组与试验组主要评价指标的预期疗效、非劣效界值或目标值、显著性水平(α)、把握度(β)、预期失访率等。
3.2.1 平行对照设计样本量估算
以下公式中,nT、nC分别为试验组和对照组的样本量;Z1-α/2、Z1-β为标准正态分布的分数位,当α=0.05时,Z1-α/2=1.96,当β=0.2时,Z1-β=0.842;(Z1-α/2+Z1-β)2=7.85
(一)优效性试验
当试验组和对照组按照1:1随机化分组,主要评价指标为事件发生率,其方差齐且不接近于0%或100%时,其样本量估算公式为:
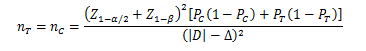
PT、PC分别为试验组和对照组预期事件发生率;为两组预期率差的绝对值, = ;Δ为优效性界值,取正值。
当试验组和对照组按照1:1随机化分组,主要评价指标为定量指标且方差齐时,其样本量估算公式为:
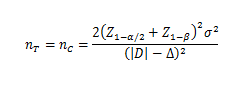
σ为对照组预期标准差;为预期的两组均数之差的绝对值, = ;Δ为优效性界值,取正值。
使用该公式计算样本量为Z值计算的结果,小样本时宜使用t值迭代,或总例数增加2—3例。
(二)等效性试验
当试验组和对照组按照1:1随机化分组,主要评价指标为事件发生率,其方差齐且不接近于0%或100%时,其样本量估算公式为:
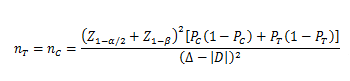
PT、PC分别为试验组和对照组预期事件发生率;为两组预期率差的绝对值, = ;∆为等效界值(适用于劣侧界值与优侧界值相等的情形),取正值。
当试验组和对照组按照1:1随机化分组,主要评价指标为定量指标且方差齐时,其样本量估算公式为:
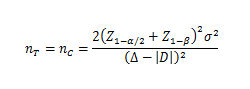
σ为对照组预期标准差;为预期的两组均数之差的绝对值, = ;∆为等效界值(适用于劣侧界值与优侧界值相等的情形),取正值。
使用该公式计算样本量为Z值计算的结果,小样本时宜使用t值迭代,或总例数增加2—3例。
(三)非劣效试验
当试验组和对照组按照1:1随机化分组,主要评价指标为预期事件发生率,其方差齐且不接近于0%或100%时,其样本量估算公式为:
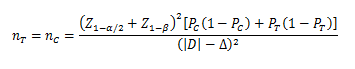
PT、PC分别为试验组和对照组预期事件发生率;为两组预期率差的绝对值, = ,∆为非劣效界值,取负值。
当试验组和对照组按照1:1随机化分组,主要评价指标为定量指标且方差齐时,其样本量估算公式为:
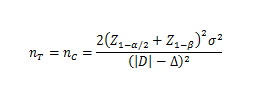
σ为对照组预期标准差;为预期的两组均数之差的绝对值, = ;∆为非劣效界值,取负值。
使用该公式计算样本量为Z值计算的结果,小样本时宜使用t值迭代,或总例数增加2—3例。
3.2.2、单组目标值试验的样本量估算
以下公式中,n为试验组样本量;Z1-α/2、Z1-β为标准正态分布的分数位,当α=0.05时,Z1-α/2=1.96,当β=0.2时,Z1-β=0.842。
当主要评价指标为事件发生率,统计发生率的研究周期相同,且发生率不接近于0%或100%时,其样本量估算公式为:
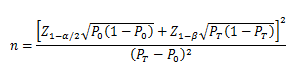
PT为试验组预期事件发生率,P0为目标值。

来源:AnyTesting


