您当前的位置:检测资讯 > 生产品管
嘉峪检测网 2017-12-27 09:50
随着美国对进口医疗器械的工厂审核次数在逐年增加,对进口医疗器械的要求也越来越严格。每年的FDA医疗器械工厂审核后的483观察项和警告信中的严重缺陷项非常值得相关企业鉴戒。而在对这些结果分析的过程中,我们发现P&PC(生产与过程控制)与CAPA(纠正和预防措施控制)两个子系统涉及的483观察项和严重缺陷项居高不下。
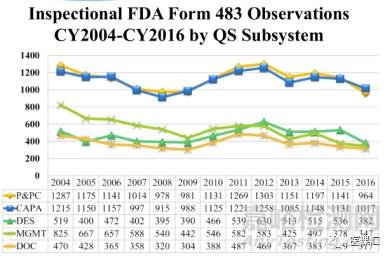
483观察项方面,根据上图所示,自2004年至2016年,FDA医疗器械工厂审核中,P&PC与CAPA涉及483观察项基本不相上下,但远远高于其他几个子系统涉及的观察项,具体观察项数基本超过其他子系统观察项的一倍以上。 2016年P&PC子系统的483观察项占总数比例32%,CAPA占比34%。七大子系统中,P&PC与CAPA两个子系统的483观察项占了总数约66%的比例。
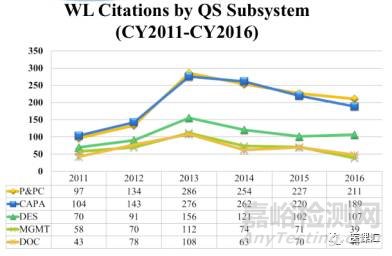
而在警告信的数据中,2016年文件控制设计的严重缺陷项只有48项,管理控制39项,设计控制107项,而纠正预防措施控制189项,生产与过程控制211项(最高)。其他年份的数据也基本如此。P&PC占比36%,CAPA占比32%,也就是说总共7个子系统,而P&PC与CAPA两个子系统的严重缺陷项约占了68%的比例。显然,P&PC与CAPA涉及的严重缺陷项远高于其他子系统涉及的严重缺陷项。
另外,根据FDA官网统计,2016年FDA医疗器械工厂审核(依据法规CFR21 QSR820)Warning letter缺陷项中,排名前十的QSR820条款如下表所示:
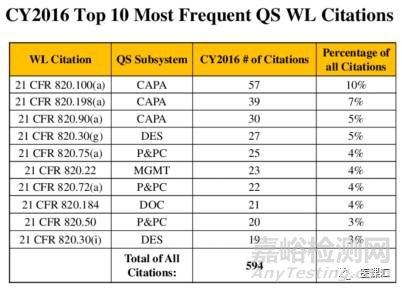
根据上表所示:排名前三的严重缺陷项条款都是 CAPA下的条款,分别是:21CFR 820.100(a)、21CFR 820.198(a)、21CFR 820.90(a)。生产与过程控制子系统下的条款则分别排名在第5、7、9,且条款分别是21CFR 820.75(a)、21CFR 820.72(a)、21CFR 820.50.(具体条款见FDA官网: CFR - Code of Federal Regulations Title 21 https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfcfr/cfrsearch.cfm?cfrpart=820 )
警告信前十排行榜中,P&PC与CAPA两个子系统占了6项,排名靠前,足见这俩大子系统的重要性和紧迫性。P&PC与CAPA两个子系统已成为了FDA医疗器械工厂审核重灾区,对此企业需要在日常及内审等过程中,重点关注这两大子系统。

来源:AnyTesting


