您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-05-14 08:09
您的医疗器械产品正在等待上市吗?是否为复杂的注册流程和漫长的审批周期感到头疼?尤其是涉及生物源材料或高风险类别的产品,病毒灭活验证环节是否让您感到挑战?监管机构对于动物源性和同种异体医疗器械病毒灭活验证的要求又是如何的呢?
医疗器械病毒灭活验证是确保产品安全、满足法规要求的关键步骤,但其复杂性也常常成为产品快速获批的“拦路虎”。从CMDE共识问题回答可以了解,监管机构对于动物源性或同种异体医疗器械是否需进行病毒灭活研究的要求是日渐趋严。2021年,监管机构的回复中说明可以通过文献或历史数据对病毒灭活效果进行评价,对额外的病毒灭活验证没有硬性要求,但2024年的回复中明确表明需要提交病毒灭活研究的相关材料。具体答复见图1。同时FDA明确要求动物源性医疗器械需提交相关申报注册资料。由于病毒灭活验证可以从根源上防止病毒通过医疗器械传播,是医疗器械安全性的基石,因此CMDE和FDA等国内外监管机构对上述类别医疗器械的病毒灭活/去除验证有明确规定,如申报过程提交的资料病毒污染风险评估不足、灭活验证方案不合理或验证数据不符合要求,将直接导致注册申请被驳回、要求补充资料甚至面临召回风险。
本文将为您深入解析医疗器械病毒灭活验证的重要性,更重要的是,告诉您如何通过专业、高效的验证流程,显著加速产品通过审批,抢占市场先机!

图1. 2021年和2024年监管机构对于动物源性医疗是否需要进行病毒灭活研究的回答
1.为什么说病毒灭活验证如此重要? 哪些产品适用呢?
医疗器械可能包含动物源的材料,这些材料不仅可以构成器械的主要部件(如牛/猪源心脏瓣膜、羊肠缝合线、止血材料等),还可以作为涂层或浸渍剂(如肝素、胶原等),或在生产过程中作为辅助材料使用(如牛脂等)。虽然动物组织及其衍生物在性能上可能优于非生物来源材料,但其在人体中的应用可能增加病毒传播和免疫原性的安全风险。因此,动物源性医疗器械的安全性评估需要考虑更多的因素。同种异体植入性医疗器械是以同种来源组织为原料加工或组成的产品。尽管供体经过严格筛选,但仍存在漏检和未知病毒的风险,以及生产过程中外源病毒的引入风险(图2)。因此,高病毒污染风险的医疗器械产品在生产过程中需要采用有效的病毒灭活工艺,并对其有效性进行科学的验证,病毒灭活验证是医疗器械安全评价的重要环节,充分、合理的病毒灭活验证数据可以有效消除监管机构对于产品病毒安全问题的疑虑,降低补充资料、延迟审批的风险。
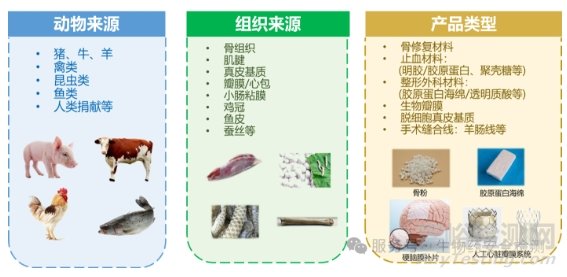
图2. 同种异体和动物源性医疗器械的来源和产品类型
病毒清除验证的具体做法是有目的地将一定量的模型病毒加入(即“加标”)到未加工收获液或各工艺步骤的中间体中,然后定量测定经特定工艺步骤或者技术方法处理后病毒滴度下降的幅度,并由此评估下游纯化工艺步骤的除病毒能力。病毒清除验证的目的是:(1)评估有效灭活或去除病毒的工艺步骤;(2)定量估计生产工艺的整体病毒降低水平。病毒灭活工艺的控制是关键的考量点,两类产品均需通过工艺控制降低病毒污染风险,但具体实施标准可能因材料来源和监管框架而异。
2.满足法规要求,国内外病毒灭活验证差异解析
NMPA主要参考国内标准(YY/T 0771.3-2009系列)和相关指导原则例如《动物源性医疗器械注册技术审查指导原则(2017 年修订版)》和《同种异体植入性医疗器械病毒灭活工艺验证技术审查指导原则(2020年修订版)》;FDA主要参考其发布的指导文件《Guidance for Industry on Medical Devices Containing Materials Derived from Animal Sources>和ISO标准;欧盟参考MDR/IVDR附录要求及ISO标准(如ISO 22442系列等涉及动物源材料的标准)。国内外法规对于同种异体和动物源性医疗器械产品国内外申报的差异对比主要集中在模型病毒的选择、灭活降低系数的考量、试验分组设计、病毒灭活动力学要求和病毒负载这几个方面,具体见图3和图4。

图3. 组织源性医疗器械产品国内外申报要求对比(指示病毒/LRV/试验分组设计)

图4. 组织源性医疗器械产品国内外申报要求对比(病毒灭活动力学/病毒负载)
上述差异给企业中外双申报带来一定的复杂性,例如需要理解多套法规体系、可能需要针对不同市场进行不同的验证设计或报告调整、应对这些国际差异,需要具备全球视野和多区域法规经验的专业团队支持。将病毒灭活验证纳入产品研发和注册的早期阶段,并从一开始就考虑未来可能进入的市场,制定兼顾多区域需求的验证策略可显著降低研发时间和成本。而专业的灭活验证服务才可以无痛解决这一难题,一份报告,多地申报。
3.病毒灭活验证的“坑”在哪里? 病毒灭活验证实操指南
1.方法选择困难:针对不同产品、不同病毒类型,如何选择最合适的验证方法和病毒模型?
a)模型病毒选择
模型病毒的选择是医疗器械的病毒灭活研究设计中非常关键的步骤,直接决定了方案是否科学合理,并最终影响申报成功率。但针对众多的模型病毒种类,如何选择合适的模型病毒?基于此,下面将为大家分享同种异体和动物源性医疗器械的病毒灭活研究中对于模型病毒选择的考量:
优先选择与潜在污染病毒密切相关的病毒,如某医疗器械产品的病毒污染来源于猪、牛等动物原材料,因此应着重考虑伪狂犬病毒(PrV)、牛病毒性腹泻病毒(BVDV)等。
表征生产工艺灭活病毒的总体能力(即表征病毒灭活工艺的稳健性)时,应使用具有不同理化特性的非特异“模型”病毒。
通常会选择使用高纯度高滴度(≥7 log)的常用指示病毒,高纯高滴的模型病毒可确保样品中加入同等病毒总量时体积变化最小化,能最大限度减少病毒加入对样品产生的稀释效应引发样品性状或参数改变,帮助准确评估工艺清除效果。
同种异体和动物源性医疗器械的模型病毒选择可参考表1和表2,可根据不同病毒的理化特性和产品的生产工艺条件选择合适的模型病毒,如酸碱灭活工艺中通常选择对酸碱较为敏感的包膜病毒,而辐照灭活工艺对包膜和非包膜病毒均有一定的灭活效果。
表1:同种异体医疗器械用于病毒灭活研究的指示病毒推荐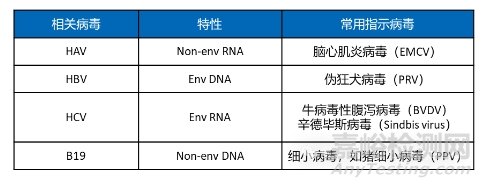
表2:动物源性医疗器械用于病毒灭活研究的指示病毒推荐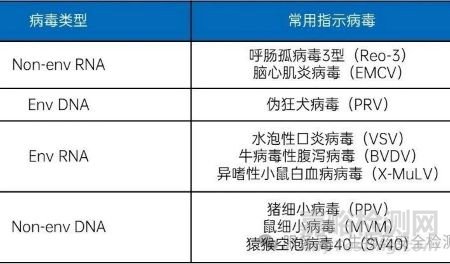
b) 常见灭活工艺及灭活效果
国内外相关法规均要求同种异体和动物源性医疗器械产品的生产工艺中均需包含经过验证能有效灭活病毒的工艺步骤,以确保相关产品的安全性。《北京市医疗器械病毒灭活工艺检查指南(2022版)》中推荐常见的病毒灭活方法有酸碱灭活法、巴氏消毒法、热灭活法、乙醇灭活法、过氧化物灭活法、辐照灭活法和有机溶剂/去污剂灭活法。不同灭活方法的病毒灭活效果见表3。
表3:动物源性医疗器械灭活的主要工艺
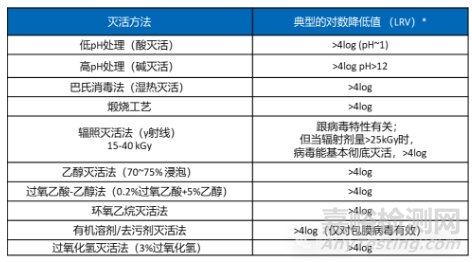
* 数据来源于药明检测内部RD及研究文献
2.实验设计复杂:如何设计科学严谨的验证方案,确保数据的有效性和可信度?
那么,在同种异体和动物源性医疗器械的病毒灭活研究中有哪些挑战点呢?其中最关键的考量点有病毒负载方式选择、工艺缩小模型的设计和实验设计。
因部分同种异体和动物源性医疗器械产品的材质较特殊,为固体的形式。对于特殊性质的材料,病毒负载与浸提难度大,需重点关注病毒回收效率。尽可能考量材料的特性如重量、密度、硬度、孔隙结构、大小、可溶性等、选择合适的负载浸提温度与时间、使用高纯高滴度病毒,并增加负载病毒量,以保证病毒负载的回收率。
对于一些特殊的产品生产工艺,应考虑该工艺对病毒的杀灭效果和对材料性能的损害程度。不同的产品类型需选择进行灭活的病毒种类可能不同,应根据产品本身特性及对病毒灭活方法的耐受性,选用合适的病毒灭活工艺。此外,对于工艺步骤参数,需关注最差条件的考量。
实验方法设计是同种异体和动物源性医疗器械的病毒灭活研究中至关重要的考量点。在产品的生产工艺中可能存在高浓度的过氧化物残留、酸碱残留、有机溶剂/去污剂和特殊的缓冲体系,这些特殊情况会对细胞检测产生毒性且对病毒侵染细胞产生干扰。因此,在设计中应包括完善的预实验(毒性研究、干扰研究)和组别设计(包括工艺处理和未处理组),避免特殊工艺对病毒灭活研究的影响。在此基础上也可通过增加终点大体积测试的方法,增加灵敏度,提高病毒的对数降低值(LRV)。

来源:生物药安全检测


