您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-04-19 08:37
癌症是一个重大的全球健康问题。它是全球主要死亡原因之一。根据美国癌症协会2019年的统计数据,预计仅在美国就将发生约1,762,450例新发癌症病例和606,880例癌症相关死亡。可见抗肿瘤药物发现和开发领域的研究规模巨大,在2023年,CDE批准化学药品IND 1448件中,抗肿瘤药物占了35.98%(图1),而建议批准的化学药品NDA 186件中,抗肿瘤药物占了22.04%(图2)。癌症治疗的负担不断增加,需要发现和开发新的抗肿瘤药物,未满足的临床缺口依旧存在,虽然无论是国际巨头还是Biotech都在投入巨大的资源在抗肿瘤药物的研发上,但是抗肿瘤药物的成功率多年来一直很低。
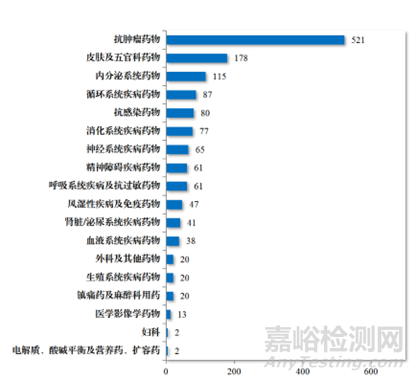
图1.2023年CDE批准化学药品IND适应症领域分布情况(件)(参考文献1)
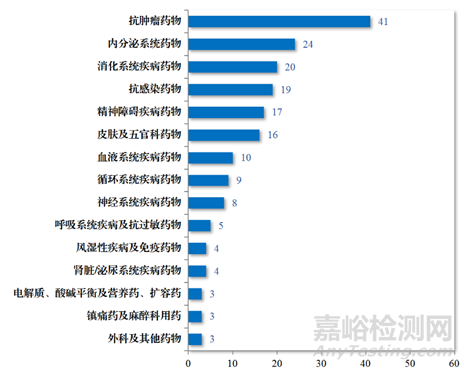
图2.2023年CDE批准化学药品NDA适应症领域分布情况(件)(参考文献1)
据估计,每5,000-10,000种潜在抗肿瘤药物中只有1种获得FDA批准,进入I期临床试验的抗肿瘤药物中只有5%最终获得批准。在最近的一项研究中,发现新抗肿瘤药物从I期到成功通过批准的总体概率低得令人无法接受,仅为3.7%。新抗肿瘤药物失败率如此之高的原因之一是其药代动力学差,这主要源于其水溶性差。据估计,约75%的新药开发候选药物水溶性较差,其中许多是抗肿瘤药物。
造成这个局面缘由主要是在抗肿瘤药物发现过程中,很少关注候选药物的理化性质。“纳摩尔法则”在癌症药物发现中被广泛采用。该规则涉及选择具有纳摩尔效力的化合物进行开发。该规则基于这样的假设,即这些化合物在低剂量下是必需的且安全有效。该规则忽略了一个关键参数:这些化合物的物理化学性质,这会影响它们的药代动力学不佳,从而影响它们的安全性和有效性。药物研发关注点的失衡,厚此失彼,造成药物从一个安全有效的极端走向了一个具有难溶性理化性质的另一端。很明显的例子,在大多数体外实验中,将药物溶解在有机溶剂(而不是生理相关的水溶液)中,并评估其对细胞系的抗肿瘤活性。在临床前阶段,对水溶性差的抗肿瘤药物没有关注与强调。其次,抗肿瘤药物的渗透性、活性和稳定性需要某些必不可少的疏水结构特征,这些特征使得药物的水溶性较差。抗肿瘤药物水溶性差的还有一个因素是药物的结晶形式。晶型具有纯度高、稳定性好等优点。新药开发中优先选择优势晶型。然而,这样的优势晶型为了溶解,必须克服其晶格能垒,这是具有挑战性的,很可能最终导致药物溶出速度减慢。
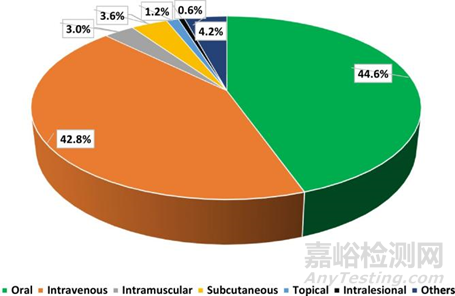
图 3.2000 年至 2018 年间获得美国 FDA 批准的肿瘤药物产品,根据给药途径分类。(参考文献2)
对2000年1月至2018年9月期间美国 FDA 批准的肿瘤药物产品进行了调查。根据给药途径对这些药物进行分类。图3显示了调查结果,在接受调查的167种肿瘤药物产品中,口服给药应然占据着最大的比例。口服是抗肿瘤药物最优选的给药途径。它有几个优点,例如易于管理和降低治疗成本。口服给药允许可行的连续给药。口服化疗成功的先决条件之一是获得药物可靠和一致的药代动力学特征,从而实现最大的药物疗效和最小的毒性。但是一些挑战与药物的理化特性和胃肠道的生理学有关。这些挑战限制了理想药代动力学的实现,因此也限制了口服水溶性差的抗肿瘤药物的药效。所以也可以清楚看到,约42.8%是静脉注射的。
据有关报道,大约40%的市场批准药物和近70-90%的已发现分子的水溶性较差,这可能导致传统制剂的生物利用度较低。随着各种药物递送技术的引入,许多溶解度差、生物有效性低的药物已被配制成成功的药物产品。一个很明显趋势,最近在505(b)(2)项下的NDA文件的增加越来越重要。巨大的抗肿瘤药物市场,巨大抗肿瘤药物投入和申报上市,可是巨大的难溶性抗肿瘤药物未能得到妥善的安置。
如何破局?
抗肿瘤药物的平衡溶解度不仅取决于药物与溶剂之间的相互作用,还取决于药物固态内的分子间相互作用。大多数抗肿瘤药物都以结晶状态提供,具有很强的分子间相互作用。这些分子间相互作用导致强烈的晶体堆积,因此必须破坏它们才能溶解药物。因此,抗肿瘤药物固态下的晶体堆积是影响其溶解度的主要挑战。抗肿瘤药物可以存在多晶型现象。这些多晶型化合物具有相同的化学成分,但内部结构不同。当一种或多种溶剂或水分子掺入药物晶格中时,就会形成溶剂化物或水合物。因此,抗肿瘤药物可以以不同的多晶型物、溶剂化物或水合物的形式存在于固态下,这会影响其稳定性和溶解度。
甲苯磺酸索拉非尼表现出多晶型,它可以结晶成三种不同的晶型(即Mod I、Mod II和Mod III)。Mod I存在于相应的商业产品Nexavar®中。此外,根据其制备方法,甲苯磺酸索拉非尼可以结晶成不同的溶剂化物形式,这些溶剂化物具有不同的溶解度和化学稳定性。已经证明,甲苯磺酸索拉非尼晶型II的溶解度优于晶型I,但它是亚稳态的,具有物理不稳定性。一般来说,如果使用抗癌药物的亚稳态结晶形式,它有转变为热力学稳定形式的倾向,从而加剧了水溶性差的问题。
无定形系统是制剂中一种很有前途的策略,因为它能够提高水溶性较差药物的溶出率和生物利用度。与结晶药物相比,无定形药物具有更高的自由能,从而改善了水溶性并维持了高过饱和度水平。所涉及的无定形材料具有热力学亚稳态,可以转化为更稳定形式的晶体。此外,它们通常被描述为一种玻璃状和过冷液体,可以通过快速冷却到达。当材料冷却时,粘度增加,分子迁移率同时降低。该过程称为温度玻璃化转变,该材料称为玻璃。与无定形形式类似,玻璃是一种没有晶体结构的脆性固体,也是亚稳态的,与药物的结晶形式有关。使用数学方程来预测溶解度的增加。但是,实验结果的值可能较低。由于其更大的自由能导致无定形形式具有更高的溶解度。
由于无定形药物不稳定,容易重结晶。因此,添加聚合物等辅料对于固体制剂以抑制药物再结晶是必要的。聚合物作为载体,通过其相互作用在提高溶解度和生物利用度方面也起着关键作用。它们可以稳定ASD系统,防止药物通过药物-聚合物之间的相互作用进行再结晶,并在各种加速条件下提高物理稳定性。无定形形式的药物可以转化为无定形固体分散体,从而提高其生物利用度。在此过程中,聚合物载体通过提高溶出速率、增强药物溶解度、提高固态的物理稳定性发挥了重要作用。此外,它可以降低分子迁移率并提高玻璃化转变温度,从而在从晶体转化为无定形形式的过程中提高稳定性。药物-聚合物相互作用通过破坏药物晶格之间的分子间相互作用来促进稳定。聚合物的存在改变了晶格的性质,进而影响了无定形固体分散体的稳定性。这种方法中生物利用度的提高是由热力学和动能共同驱动的。
高分子载体材料空间位阻导致产生更大的表面积,这反过来又抑制了结晶并阻止了晶体生长的成核。溶出的第一步涉及分子的润湿,这一过程由水溶性聚合物促进。尽管没有达到完全的溶出释放曲线,但过饱和溶液的产生和胃肠道转运时间的改善增强了分子的吸收动力学。此外,无定形固体分散体(ASD)通过促进微粒、纳米颗粒或胶束在胃肠道中的自发形成来提高渗透率。
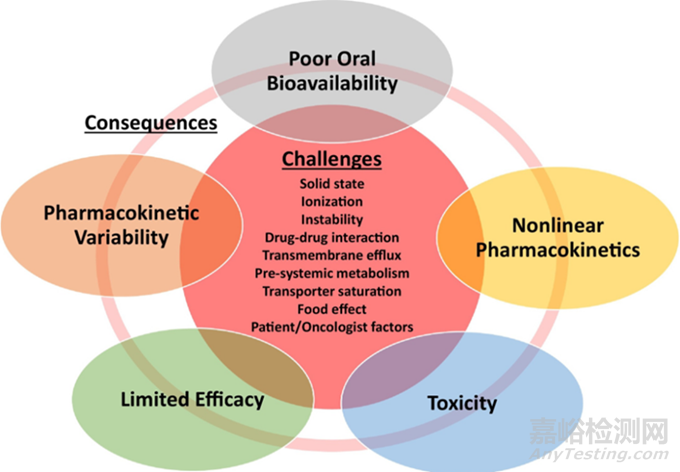
图4 抗肿瘤药物开发的挑战和不好的结果(参考文献3)
案例分享
奥拉帕尼(olaparib)是多聚二磷酸腺苷核糖聚合酶抑制药,获得欧盟医药局和美国食品药品管理局优先审查资格,于2014年12月批准上市,商品名LynparzaTM,用于治疗妇女与BRCA基因缺陷相关的晚期卵巢癌。2017年8月17日,阿斯利康(AstraZeneca)奥拉帕尼Lynparza(olaparib)新型制剂片剂(原为胶囊)被FDA批准用于复发性上皮卵巢癌、输卵管癌、或原发性腹膜癌成人患者(无论BRCA基因突变情况)的维持治疗,这些患者在对当前的铂类为基础的化疗处于完全缓解或部分缓解。除了适应症的扩大,药物的开发剂型也有胶囊转变成片剂。剂量由从胶囊400mg,bid改为片剂300mg,bid,即由患者从每天早8粒晚8粒的大剂量吞服改为早2片晚2片的小量吞服,对患者的给药顺应性带来了极大的便利。
奥拉帕尼是一种白色至淡黄色的不吸湿结晶粉末。活性物质结晶固体,在生理pH值范围内具低溶解度,极微溶于水,溶解度仅为0.1mg/ml,单剂量50mg来算,化合物溶解也需要500ml介质,大于250ml,可以判定为难溶性药物。化合物熔点接近200℃,LogP为1.96,为高熔点,低LogP化合物,可判断熔点高,即晶格能较强限制化合物溶解,进而导致化合物体内生物利用度的问题。
为了提高病人服药顺应性,阿斯利康进行了固体分散体的开发。在片剂形式中,奥拉帕尼被迅速吸收,给药后0.5至2小时达到最大血浆浓度。重复片剂给药后,奥拉帕尼300mg或更高的稳态暴露与奥拉帕尼胶囊400mg剂量的稳定状态暴露相匹配或超过,表明固体分散体技术可以极大的提高奥拉帕尼的生物利用度,降低每日给药频率和剂量,提高病人的顺应性(表1)。
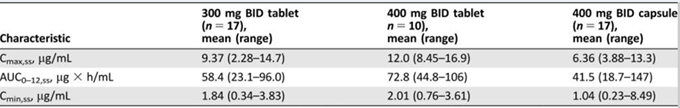
表1.奥拉帕尼胶囊和片剂在剂量扩展阶段的药代动力学和生物利用度的比较(参考文献5)
总结
抗肿瘤药物开发仍然是各大医药公司的研发重点,从申报上看亦是如此。但是,抗肿瘤药物从发现之初,自身带着特有的光环-药物难溶性。在新药申报的过程中,可能为了加速申报不会采取增溶的这种相对具有技术壁垒的技术。但是不得不说ASD技术通过提高水溶性较差的抗肿瘤药物的溶解度,为肿瘤治疗提供了潜在的益处,研发仍在继续,即使想通过505(b)(1)快速推荐上市,仍然还能通过505(b)(2)去弥补遗憾。
参考文献
1.2023年度药品审评报告
2. Amorphous Solid Dispersion as Drug Delivery Vehicles in Cancer
3. Harnessing the therapeutic potential of anticancer drugs through amorphous solid dispersions
4.Insights on the Dissolution Evaluation and Optimization of Amorphous Solid Dispersions
5.奥拉帕尼片剂在卵巢癌患者中的给药:实践指导和期望

来源:药事纵横


