导语:本文为学习性总结,主要参考山东省医疗器械和药品包装检研究院孙晓霞老师对GB/Z 16886.22-2022《医疗器械生物学评价 第22部分:纳米材料指南》国家标准指导性技术文件解读以及《应用纳米材料的医疗器械安全性和有效性评价指导原则》,主要从纳米材料的介绍、涉及标准、理化表征和生物学评价等方面进行介绍,以为诸君提供点滴参考。
第一部分涉及标准简介
相关指导原则:
应用纳米材料的医疗器械安全性和有效性评价指导原则第一部分:体系框架
应用纳米材料的医疗器械安全性和有效性评价指导原则第二部分:理化表征
应用纳米材料的医疗器械安全性和有效性评价指导原则第三部分:生物相容性/毒理学评价(征求意见稿)
相关标准:
GB/Z 16886.22 《医疗器械生物学评价 第22部分:纳米材料指南》
ISO /TR 16197 -2014 《Nanotechnologies — Compilation and description of toxicological screening methods for manufactured nanomaterials》
YY/T 1295《医疗器械生物学评价 纳米材料:细菌内毒素试验》
YY/T 0993《医疗器械生物学评价 纳米材料:体外细胞毒性试验(MTT试验和LDH试验)》
YY/T 1532《医疗器械生物学评价 纳米材料 溶血试验》
YY/T 1863《纳米医疗器械生物学评价 含纳米银敷料中银颗粒和银离子的释放与表征方法》
GB/T 38261《纳米技术 生物样品中银含量测量 电感耦合等离子体质谱法》
GB/T 39261-2020,纳米技术 纳米材料毒理学评价前理化性质表征指南
ISO/TR 13014:2012 纳米技术——工程纳米材料理化特性毒理学评估指南Nanotechnologies-Guidance on physico-chemical characterization of engineered nanoscale materials for toxicologic assessmen.
ISO 21363:2020, Nanotechnologies - Measurements of particle size and shape distributions by transmission electron microscopy.
GB/Z 10886.22是指导性技术文件,它等同于ISO10993.22。根据新修订的GB/T 16886.1-2022,新增了关于纳米材料的生物学评价。纳米材料的生物学评价内容中,新增了8项内容,分别是3.15的纳米材料以及6.1生物学风险分析的物理化学信息等相关内容。关于纳米材料生物学评价和风险的内容,由于纳米材料具有潜在独特性,如生物持久性和生物蓄积,因此对生物学评价和风险评估提出特定挑战。GB/Z16886.22标准全面考虑了医疗器械领域的纳米材料和纳米技术可能带来的风险,并对如何评价这些风险提出了指导性建议。
第二部分应用纳米材料的医疗器械介绍
现有的医疗器械中应用的纳米材料包括添加到医疗器械中的游离态纳米材料,利用纳米材料特性增加生物学活性(如医用纳米羟基磷灰石/聚酰胺66复合骨充填材料)或者预防感染(如纳米银创伤贴)的固化纳米材料以及利用纳米技术设计制备成纳米结构的医疗器械(如口腔种植体材料表面纳米化处理)等。此外,即使医疗器械本身不含有纳米材料,其使用/植入过程也有可能导致纳米颗粒的产生。
也就是说有纳米材料组成或包含纳米材料的医疗器械,以及在医疗器械或组件生产过程中未使用纳米材料,但降解磨损或在机械处理过程中,如医疗器械原位研磨抛光等产生的纳米物体。同时,GB/Z 16886.22内容也提出了不适用情况:例如未经设计制造或加工应用于医疗器械中的天然和生物纳米材料以及块体材料内部的纳米结构;在设计制造加工过程中,非预期产生的医疗器械表面的纳米结构(如挤压划线和机加工/工具标记)。
常用的概念或术语
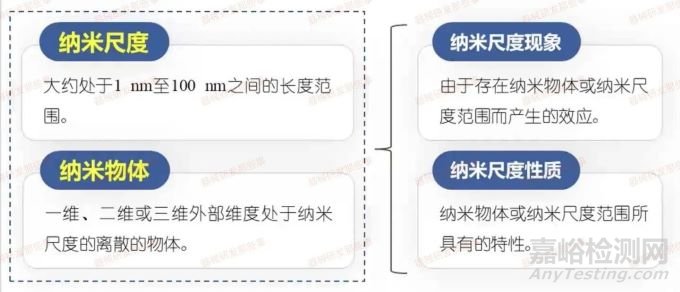
首先,大约处于1纳米到100纳米之间的长度范围的纳米尺度,包含纳米尺度现象,即由此尺度范围产生的效应和纳米尺度性质。纳米物体是指一维、二维或三维外部维度处于纳米尺度的离散物体,而纳米材料是任意外部维度、内部或表面结构处于纳米尺度的材料,包括工程化、伴生纳米材料和人造纳米材料。
其次,纳米结构和纳米颗粒是所有外部维度均在纳米尺度的纳米物体,其中纳米物体的最长和最短轴的长度没有显著差异。这里涉及到纳米片和纳米纤维,它们都是纳米颗粒的一种内容。纳米纤维包含纳米棒和纳米管,纳米棒是固体的纳米纤维,纳米管是中空的纳米纤维。


这种团聚体,如范德华利或简单的物理团结,聚集体团聚体被称为次级颗粒,原颗粒则被称为初级颗粒。另一个重要定义是测试参考材料,它是一种或几种特定性质足够均匀或稳定的材料,适用于目标量值测量和测定测试方法的开发。与其他特定性质相比,该目标量值尚未进行均匀性和稳定性评估。
第三部分 纳米材料的风险评估
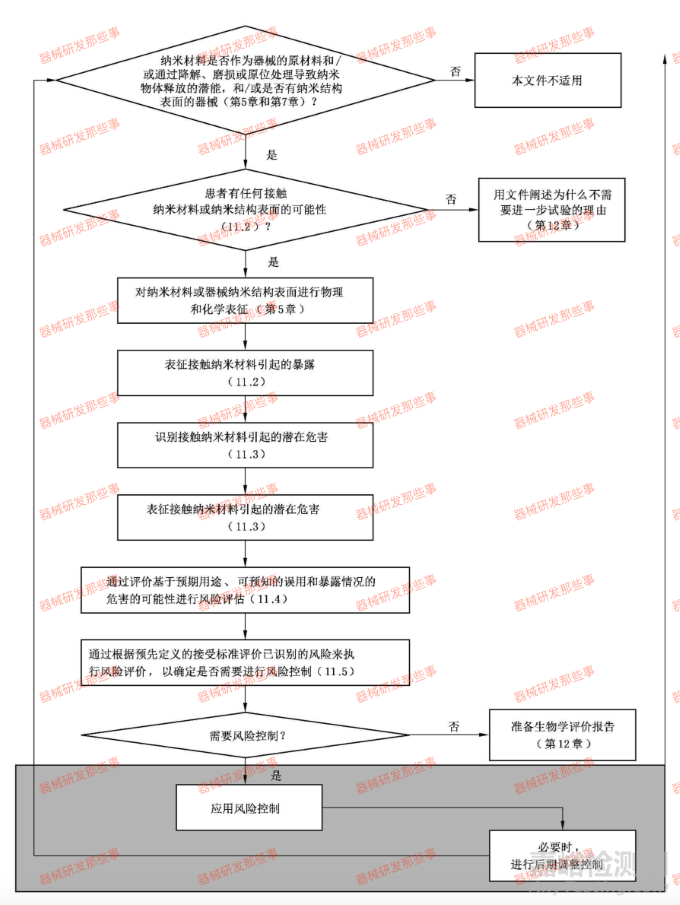
关于纳米材料的风险管理,首先要明确适用范围,包含由纳米材料组成的器械降解磨损或从器械处理工艺过程中产生的纳米材料。风险管理首先要发现危害,并考虑危害识别。医疗纳米材料的物理、化学和毒理学特性,包括添加剂和加工助剂。作为应用纳米材料医疗器械风险评估组成部分的安全性评价流程图如下图所示。
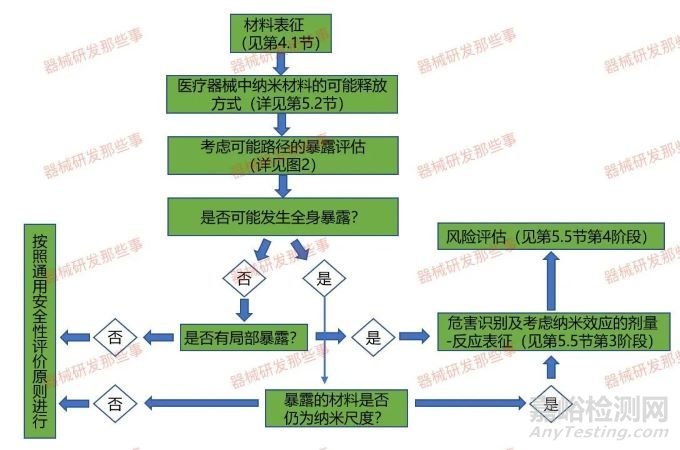
应用纳米材料的医疗器械风险评估:阶段法
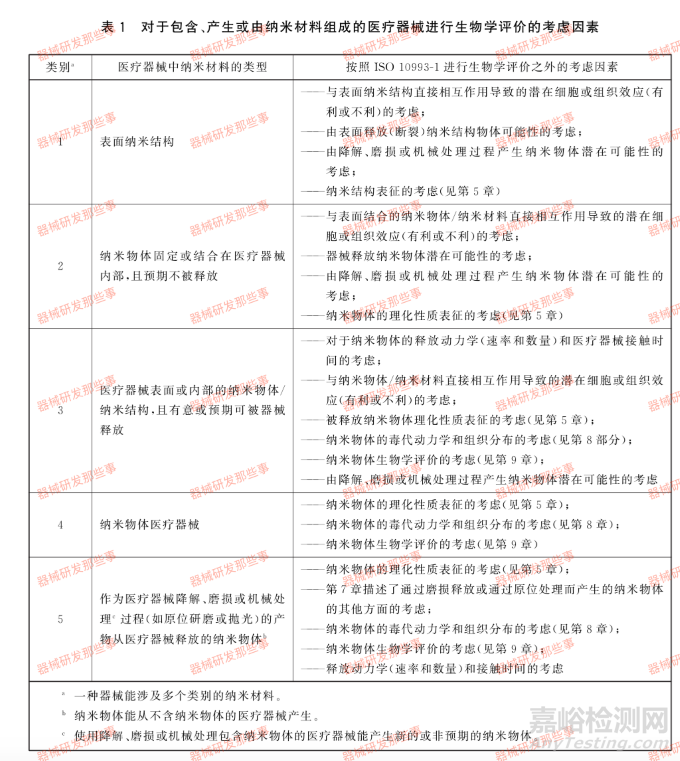
在技术评估时,需考虑纳米材料在医疗器械中的浓度、预期用途、接触途径、释放速率和模式以及对患者接触情况的估计。GB/Z16886.22中已明确了由纳米材料组成的医疗器械进行生物学评价的考虑因素。我们将医疗器械中的纳米材料分为5类。然而,我们需要指出一种器械可能涉及多个类别的纳米材料,例如除表面结构外,还包含器械表面或内部的纳米物体,纳米结构有意义或者预期可能被器械释放。纳米物体可以从不含纳米物体的医疗器械中产生。对于使用降解磨损或处理包含纳米物体的医疗器械,我们在评价生物学时需要对其产生额外的新的非预期纳米物体。
第四部分 应用纳米材料医疗器械的理化表征
纳米材料因其独特的尺寸小、比表面积大和化学活性高等特点,在医疗器械领域具有广泛的应用前景。然而,这些特性也使得纳米材料在不同环境中的表面特性和聚集状态容易发生变化,给纳米材料的生物学效应评估带来了挑战。
为了确保应用纳米材料的医疗器械的安全性和有效性,全面而准确的理化性质表征以及使用过程中纳米材料理化性质变化的测量至关重要。
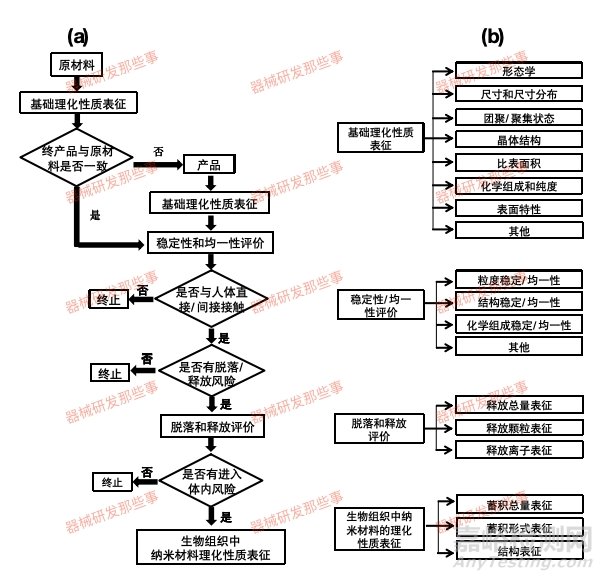
首先,表征对象是最终器械上具有代表性的样品,或与最终医疗器械同样方式加工而成的材料。根据产品及纳米材料的性质,可以选择不同阶段的理化检测项目,以对纳米原材料、医疗器械终产品中的纳米材料以及生物组织样本中的纳米材料三个层次进行表征。
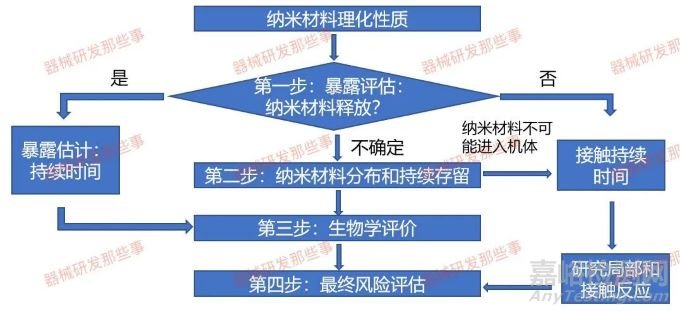
纳米材料的理化表征流程图可以参考下图(a)。流程图(b)中给出了各阶段理化表征的建议检测项目。该理化表征可分为三个层次:
纳米原材料:对纳米材料的基本特性进行表征,包括尺寸、形状、表面特性等。
医疗器械终产品中的纳米材料:对医疗器械中的纳米材料进行表征,包括纳米材料的稳定性、分布情况等。
生物组织样本中的纳米材料:对应用纳米材料的医疗器械释放的纳米材料在生物组织样本中的分布和转化情况进行表征,以评估纳米材料的生物分布和生物转化情况。
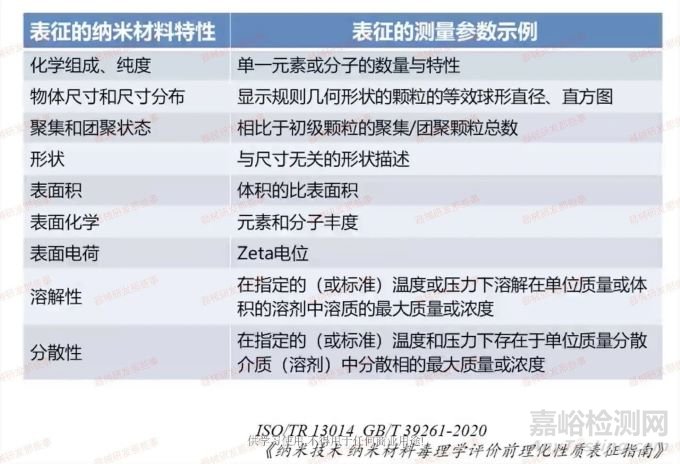
GB/T 39261-2020《纳米技术 纳米材料毒理学评价前理化性质表征指南》中也提到了纳米材料特性的参考参量值以及测量参数示例,具体如下表所示。此外,我们还需要对纳米材料的结晶度、孔隙率等附加属性进行评估。对于含纳米多孔材料,我们还需要考虑由于孔隙或者空隙造成的尺寸、结构密度分布等特性的特定区别。
纳米材料的表征和实验结果的描述如下图所示,我们提供了关键数据,包括样品制备、实验条件、标准分析、检验方法的描述。医疗器械材料降解和潜在纳米物体的释放评估、实验方法步骤、降解产物的定性和定量研究、讨论和结论。
第五部分 应用纳米材料医疗器械的生物学评价
在进行纳米材料生物安全性测试时,首先要根据器械设计、用途和磨损特性来考虑。实验时,要考虑实验介质与纳米材料之间的相互作用,以及与体液接触可能改变纳米材料的表面表征,从而改变其生物学行为的可能性。同时,要判断实验系统是否具有临床代表性,例如体外模拟原位磨损产生的纳米材料或纳米物体是否符合生物学安全性实验测试体系。
5.1参照材料
纳米材料生物学评价的重要内容是参考材料,即实验系统对照品的选择。测试参考材料的定义是一种或几种特定性质足够均匀和稳定的材料,适用于目标量值的测量和测试方法的开发。
目前,纳米材料缺少阳性和阴性对照样品,但对照样品的测试可重复性和可靠性至关重要。因此,我们需要针对纳米材料的尺寸、形状、度量值进行标准化测试参考材料。全球数据库http://www.nano-refmat.bam.de/en/为纳米尺度的参考材料提供了数据库,目前可用的纳米尺度参考材料包括二氧化钛、胶体二氧化硅、金和单壁碳纳米管。
5.2测试样品的制备
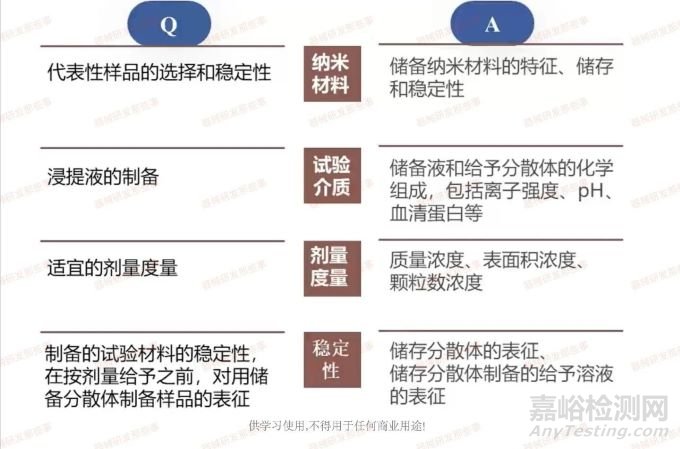
我们已经确定纳米材料的来源、风险、参考材料等方面。在样品制备过程中,我们需要确定4个方面的内容。
对于纳米结构材料和分散体,按照ISO 10993.12样品制备,通常采用极性和非极性介质浸提。然而,需要注意基于介质的临床相关性和分散性,选择纳米物体和分散体。大多数纳米分散体在极性溶液中制备和使用,在特定测试系统中递送纳米物体时,需要注意增加纳米物体反应性的表面特性,如聚集或团聚体的形成,这些小尺寸对理化性质的潜在影响。

我们需要区分溶解性和分散性,这两种内容对毒性反应具有关键影响。当可溶或部分缓慢可溶时,纳米物体以分子形式存在于实验系统中;当微溶或难溶时,则以分散体形式存在于实验系统中。这两种存在形式不同,导致生物学反毒性反应的影响也有所不同。此外,实验样品的稳定性是关键因素,也是导致实验结果具有典型可代表性和可重复性的关键因素。刚才提到聚集体和团聚体的定义,这两种存在形式的分散受纳米物体之间的相互作用和与环境相互作用的影响。
同时,我们需要特别关注纳米物体的样品,样品中的纳米物体的分散情况和尺寸分布会随时间发生改变。纳米结构材料有两个方面的内容,首先是表面积,纳米结构的表面增加了器械的总表面积。二是纳米材料可能会从纳米结构上释放出来,即嵌入式纳米材料和固定在基质或表面的纳米材料的释放形式。因此,增加了储备纳米材料的相关表征内容。首先是储备分散体的制备,其次分散方法可以选择超声或搅拌,并考虑是否适用于活性剂等稳定剂。在储存条件上,我们要注意避免极端温度、亮度、湿度对储备分散体的储存稳定性的影响。

稳定性评价包括两个方面:一是纳米材料的溶解、降解或转化是否随时间变化;二是纳米粒度的分布或表面电荷是否随时间变化。在此,我们单独提出了内毒素的观点:内毒素污染可能会干扰生物学评价实验导致错误结论。同时,我们还需强调,传统的内毒素定量实验并不适用于纳米材料,这是因为纳米材料会干扰内毒素等试剂的反应性。通过测定实验溶液中磷脂的存在和组成来排除内毒素。预防内毒素污染有以下几些措施:一是在制造过程中防止污染;二是注意,灭活内毒素的方法可能会改变或导致纳米材料降解。
灭菌方式可能会影响纳米材料降解,进而产生杂质。同时,纳米材料中存在的各种不同杂质会影响其功能、生物相容性、存在状态、聚集状态和稳定性等因素。若纳米材料或者结构颗粒中存在灭菌工艺,将会再次表征灭菌后的纳米材料或者产品。另外,伽马辐照或环氧乙烷灭菌方法可能产生自由基,影响纳米材料的安全性,导致产生有毒降解产物。同时,无菌过滤不适用于包含220纳米或者更大粒径片的纳米材料或者高粘度悬浮液。
5.3纳米物体在医疗器械中的释放,涉及动力学研究
包括释放数量是否发生迁移以及是否有生物蓄积。这种释放可能是降解产物的释放,如含银辅料中纳米银成分的释放,以及磨损导致的纳米物体释放,如关节置换植入物在使用过程中磨损颗粒的纳米物体释放。此外,还包含原位处理,如齿科材料,在机械抛光和研磨过程中也可能产生纳米制作材料。
5.4 毒代动力学
毒代动力学即吸收、分布、代谢和排泄的内容。这部分内容依据ISO 10993-16毒代动力学研究,其危险源是组成单个纳米材料的游离、纳米物体离子或组分的存在或释放。这种存在形式包括游离、固定或嵌入。影响毒代动力学的因素有很多,从理化性能、尺寸、电荷聚集等方面进行总结。生物分子吸附,例如纳米颗粒可吸附蛋白质,形成蛋白冠,增强单核巨噬细胞识别和摄取。
接触途径决定了生物分布可能存在血液、肝、脾及局部和组织淋巴结的相互贯通过程。第四方面是剂量,当摄入大于清除时可能存在生物蓄积。在进行毒理学毒性动力学研究时,需关注物种和性别。例如,雌性大鼠比雄性大鼠更容易发生纳米银及其衍生物的肾脏蓄积。纳米材料的表面结构能影响纳米材料与蛋白质的相互作用、吸附、循环和分布,最终影响毒代动力学。
5.5 毒理学评价
对于评价终点,我们需基于纳米材料在临床使用时的接触时间、部位和特性进行考虑。对于纳米材料的特殊考虑,它在人体内可能会发生全身分布,或者在组织中的分布。纳米材料可通过细胞核线粒体膜干扰或阻断DNA合成。它可与蛋白等结合形成蛋白冠,导致生物分子吸附,容易被机体内的巨噬细胞、炎症细胞吞噬或识别。
在实验过程中,首先要注意纳米物体的剂量,包括质量、颗粒数量和表面积。其次,实验介质的pH值、血清浓度是否发生分散或聚集?悬浮液、重悬液和混悬液等,悬浮状态是实验系统的重要因素。容器材料也关键,纳米物体是否易被容器材料吸附,从表面解离或释放,这些都是实验过程中需关注的关键因素。
接下来,我们来探讨毒理学评价终点。
(1)体外细胞毒性实验
物体在体细胞内的定位取决于其物理、化学性质、尺寸和计量。首先,细胞毒性实验涉及到的细胞可能包括吞噬和非吞噬性两种类型。除了常规的毒性细胞毒性外,还可能存在氧化应激和干扰因素,如生物吸附。另外,常见的MTT实验或LDH实验中的染料是否受到纳米材料的干扰而影响结果比色。对于细胞毒性实验,计量度量包括纳米颗粒,可能存在三个参数质量、表面积和数量以及可能会影响通过沉淀、团聚扩散而接触细胞的过程。其中,纳米颗粒受培养基和培养条件的影响是实验中需要关注的内容。
(2)对于遗传毒性、致癌和生殖毒性
间接毒性包括促氧化作用和DNA修复抑制。当一些研究显示为阳性,而其他研究没有显示时,基于风险评估原则,纳米颗粒被认为具有潜在遗传毒性。另外,一些研究结果为阴性,但并无相关性。这是因为细菌缺乏内吞作用能力,纳米材料不易透过细菌壁,Ames实验不适用于纳米材料的致突变性研究。对于纳米物体引起的非遗传毒性,如炎症反应、氧化应激和细胞凋亡,这些作用可能诱发细胞癌变。在遗传毒性实验时,由于纳米物体本身不被机体代谢,因此在实验时不需要加入S9肝代谢活化成分。
在开展体内遗传毒性实验时,我们需要根据ISO 10993-16毒代动力学研究,特别关注纳米物体靶器官的体内实验。对于致癌性实验,除了遗传毒性,还需关注由于DNA损伤突变引起的慢性炎症反应和由氧化应激导致的致癌性。对于生殖毒性,我们需要强调纳米颗粒能穿透生物屏障,因此它们可以穿透生殖系统屏障,从而影响精子的活力、功能以及胚胎的发育。免疫毒性方面,纳米与蛋白质结合形成蛋白冠,可被单核细胞计数系统吞噬。这涉及巨噬细胞、输出状细胞和朗格汉斯细胞。
不同形状的纳米物体的渗透性有所区别,球形纳米材料比细长的纳米材料具有更高的渗透性。血液相容性首先涉及纳米器械与器械和血液接触表面积的关系。纳米器械表面积与全血接触体积的比率是血象性评估的重要因素。这里分别从三个方面进行关注:一是补体系统的激活可以引起巨噬细胞吞噬纳米材料,从而导致急性超敏反应。二是尺寸和表面粗糙度在血液血清蛋白吸附程度、血小板粘附和激活以及及全血液凝固动力学方面起到重要影响作用。纳米颗粒与内皮细胞和单核细胞相互作用,激活相应的炎症因子和表面标志物,从而通过内皮细胞或单核细胞导致激活,影响血液相容性。
植入实验包括皮下肌肉和颅内等,游离纳米物体需考虑注射至适宜组织。在纳米物体从医疗器械释放的情况下,需特别关注纳米物体向局部引流淋巴结的迁移,即材料介导的致热性。
5.6生物学评价报告
通常一份生物学评价报告包括如下内容:
结束语:本文详细介绍了医疗器械纳米材料的相关指导原则和标准、应用纳米材料的医疗器械简介、应用纳米材料的医疗器械的物理化学表征和生物学评价等内容。