美国 FDA 医疗器械与放射健康中心(CDRH)主任 Jeff Shuren 于 3 月 19 日发布声明通告有关 FDA 对中国产塑料注射器相关质量和性能问题的最新评估进展,警告公众除非没有其它选择,否则不要使用此类注射器。
FDA 最初于去年 11 月发布安全通讯,内容涉及 FDA 对某些中国产塑料注射器潜在器械故障的评估。FDA 此前收到了有关这些注射器的性能和安全性担忧的信息,包括它们单独使用或与输液泵等其它医疗器械一起使用时输送正确剂量药物的能力。
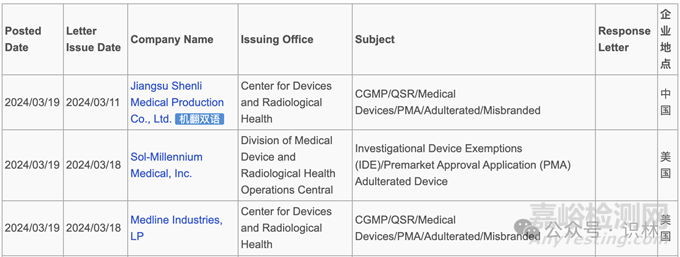
FDA 在最新的声明中表示,FDA 广泛评估了中国产塑料注射器的问题,包括对 Medline Industries 公司和 Sol-Millennium Medical 公司的设施进行检查,在边境检查和扣留产品,对注射器进行实验室测试,并与相关生产商合作确保采取适当的纠正措施。FDA 表示,“我们正在进行的评估已证实,中国产塑料注射器的质量问题及其在美国的销售比最初所知的更为普遍。”
同时,FDA 还公布了分别发送给中国塑料注射器生产商江苏神力医用制品有限公司,以及在美国分销中国产塑料注射器的两家公司 Medline Industries 公司和 Sol-Millennium Medical 公司的警告信。所有三封警告信均描述了与销售和分销未经 FDA 批准或许可在美国使用的未经授权的中国产塑料注射器相关的违规行为。FDA 在给两家销售商的警告信中还注意到其设施存在质量体系违规行为。
阅读 FDA 发给江苏神力的警告信发现,江苏神力通过了申请号为 K103830 的 510(k) 申请,获得了 FDA 对其生产的 5cc 鲁尔锁活塞式注射器的许可。但神力在美国分销的产品具有显著不同的技术特征,包括:尺寸不是 5cc 的注射器,用鲁尔接头代替鲁尔锁头,用于特殊药品的注射器,不同颜色(着色剂)和对照的注射器。FDA 在警告信中指出,这每一种都构成设计的重大变更或修改,可能会显著改变器械的安全性或有效性。关于对影响安全性和有效性的预期用途或设计的变更需要进行新的上市前通知或“510(k)”的进一步解释。神力未能为这些注射器提交 510(k),从而这些产品被 FDA 认定为掺杂和错标。
另外,FDA 在给 Medline Industries 公司的警告信中还提到了江苏采纳医疗科技公司生产的塑料注射器的质量问题和性能测试失败的问题。FDA 了解到江苏采纳的几款塑料注射器的性能测试显示出现意外且无法解释的故障。FDA 的评估正在进行中,FDA 表示将酌情采取额外措施。
FDA 建议美国供应商、消费者和医疗机构,在过渡到替代品之前,除非绝对必要,应立即停止使用江苏采纳生产的塑料注射器和江苏神力生产的未经许可的塑料注射器(包括除 5mL 鲁尔锁注射器以外的所有型号)。
对于中国产的所有其它塑料注射器,FDA 建议仅根据需要继续使用,直至能够过渡到替代品,并且应密切监测泄漏、破损和其它问题,并向 FDA 报告。FDA 表示,警告不涉及玻璃注射器、预充式注射器或用于口服或局部用途的注射器。FDA 补充指出,可通过检查标签、外包装或联系供应商或集团采购组织来确认注射器的生产地点。
FDA 表示,并不担心该问题会导致供应链问题,因为有足够的国内和其它国际生产商可以供应塑料注射器。