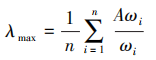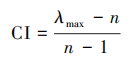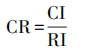摘要
目前我国药品生产质量管理规范(GMP)检查质量评价方面没有特别统一的标准和可实施的参照标准,为进一步推进和完善我国药品 GMP 检查制度,提升药品 GMP 检查质量,本研究通过文献研究和专家访谈的方法设计出调查问卷,然后通过调查研究形成我国药品 GMP 检查质量评价指标,构建了药品GMP 检查质量评价体系。本文新构建的 GMP 检查质量评价体系和可行性的实证方案建议有助于进一步推进我国药品 GMP 相关检查工作,提升检查水平。
关键词: 生产质量管理规范;检查质量;评价指标;评价体系
我国药品生产质量管理规范(GMP) 检查在监督药品企业合规性生产和保障药品质量安全方面一直发挥着重要作用。随着科学监管的推进,对于药品 GMP 检查的质量也提出了更高的要求,如何科学合理地对检查质量进行评价和考核就非常重要,因此应该从我国药品 GMP 检查质量风险管理的角度出发并结合我国 GMP 国际化发展理念,依据药品检查合作组织(PIC/S)的一些指南文件,建立一个可以由国家级和各省级药品检查机构通用的评估模型,具有纵观全局、系统性、实用性的评价指标体系。因此本研究从检查前的发起依据、被评估机构的质量管理体系建设等方面进行考量,构建了评估体系,对推动我国药品 GMP 检查能力和水平的提升具有一定参考作用。
一、药品 GMP 检查质量评价指标的构建
1.1 我国药品 GMP 检查质量评价指标初选
研究初期根据文献研究法和专家访谈的方法设立相应的评价指标体系。文献研究法主要是通过搜集、整理与药品 GMP 检查领域的相关文献,对文献进行调研有助于全面了解此领域的情况,为评价指标体系的构建提供理论参考。专家访谈则是邀请药品 GMP 领域中有代表性、权威性的专家,10人为 1组,对我国药品 GMP 检查质量评价指标进行商讨与意见征询,意见征询过程包括评价指标的初选、指标的修改和指标的判定3步,最终整理出我国药品GMP 检查质量评价体系,见表 1。
1.2 调查问卷结果统计分析
通过发放调查问卷,邀请专家和业内人士对最初选取的一级指标与二级指标进行评价,最终获得有效问卷总数共 76 份。调查对象盖挑选的医药专业人士、药品监管部门工作人员、专/兼职检查员,企业质量管理人员、高校科研人员以及外企质量管理人员等。
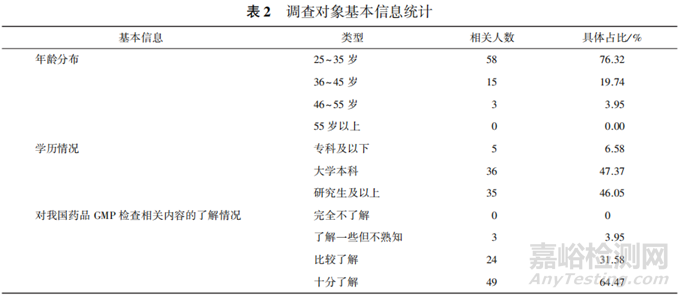
1.2.1 调查对象基本信息结果统计
在有效调查人群中,有 64.47%的调查对象对我国药品 GMP 检查的相关内容十分了解,31.58%的人比较了解,见表2。
1.2.2 一级指标权重分析
各项一级指标的平均分为:检查依据指标为 4.2分,检查机构质量管理体系指标为 4. 14 分,检查员管理指标为 4.08分,检查方法与程序指标为 4.2分,检查结果指标为 4. 18分,检查信息化水平指标为3.96分。根据公式,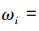
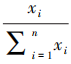 可求各项指标权重,式中
可求各项指标权重,式中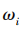 为权重,
为权重,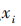 代表各项指标数值。求得各指标数值之和为 24.76,将每一指标数值除以 24.76,即得到各指标权重,见图1。
代表各项指标数值。求得各指标数值之和为 24.76,将每一指标数值除以 24.76,即得到各指标权重,见图1。
由统计数据可知,检查依据和检查方法与程序权重相同,均为 0.1696。这说明此2项指标在进行GMP 检查质量评价时至关重要,所以首先建立生产检查法律法规并依据相应标准执行才能确保后续GMP 检查工作的顺利实施;同时,确立检查方法与程序,确保检查程序的科学性、合理性、有效性是保障 GMP 检查工作有效施行的重要内容。
其次为检查机构质量管理体系、检查信息化水平和检查员管理,权重分别为 0.166 8.0.167 2 和0.1648。这3项指标所占权重总体相差不大且只略小于检查依据、检查方法与程序2项指标,说明健全的检查机构质量管理体系、高质量的检查信息化水平和科学的检查员管理对药品GMP 检查工作的执行具有重要影响,是检查工作顺利执行的重要条件。
最后为检查结果,所占权重为 0.1599。虽然检查结果所占权重较小,但确保检查结果的客观性、真实性是对检查工作的重要反馈,是不容忽视的重要指标。
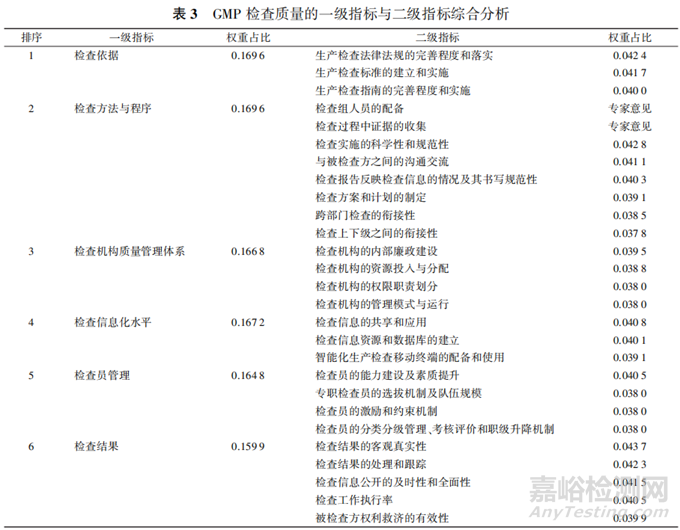
1.2.3 一级指标与二级指标综合权重占比及分析
表3为对影响药品GMP 检查质量的一级指标与二级指标综合权重占比,其中根据专家意见在“检查方法与程序”一级指标中增设“检查组人员的配备和“检查过程中证据的收集”2项指标,检查组人员的配备是组织活动有效的保证,合理、完善的人员配置能够确保检查项目的各司其职与顺利实施;检查过程中证据的收集不仅有利于得到客观、真实、令人信服的结果,也是后续复盘检查、总结经验的重要方式。因此根据专家的建议增设的2项指标可以使药品 GMP 检查质量评价指标体系得以健全。
对影响我国药品 GMP 检查质量的一级指标与二级指标进行综合分析如下。
检查依据:检查依据下设3项二级指标,权重由高到低依次为:生产检查法律法规的完善程度和落实(0.0424)、生产检查标准的建立和实施(0.041 7)、生产检查指南的完善程度和实施(0.0400)。3项指标总体权重相差不大,说明科学建立并有效实施药品生产检查的相关法律法规、标准和指南是保证药品检查工作顺利执行的充要条件,科学合理的法规准则可以为后续的检查计划的制定和检查工作的实施提供可靠依据。
检查方法与程序:除根据专家意见增加的2项指标外,检查方法与程序下设6项二级指标,其中检查实施的科学性和规范性、与被检查方之间的沟通交流、检查报告反映检查信息的情况及其书写规范性3项指标权重相对较高,达 0.0400以上。这表明科学、规范的实施检查程序,并在检查过程中全面且有序与被检查方沟通对于整项检查工作的有效实施至关重要:同时规范、客观地书写检查报告也是获得真实检查信息的基础。
检查方案和计划的制定、跨部门检查的衔接性,检查上下级之间的衔接性所占权重在 0.0400以下虽然权重相对较小,但也需在检查前依据相应准则制定科学合理的检查计划并配备检查组人员;在检查过程中注重证据的收集,加强检查机构与被检方、检查机构部门和上下级之间的沟通交流,促进检查工作的规范执行。
检查机构质量管理体系:检查机构质量管理体系下设4项二级指标,指标所占权重均小于 0.0400并大于 0.0380,分布较为均匀,表明4项指标具有同等的重要性,均是保证检查机构质量管理体系高效运作的重要条件。检查机构自身的内部廉政建设、资源投入与分配和权限职责划分关系到机构自身的发展,也是保证检查工作质量的重要前提。因此,检查机构应当加强人力、物力和财力的投入与分配,并对各层级、各部门进行合理的权限职责划分,确保落实主体责任,在自身创新发展的基础上致力提升检查水平,保证质量管理体系的高效运作。
检查信息化水平:检查信息化水平反映了检查机构对于网络的培养、利用和维护能力。下设各项二级指标权重相差不大,检查信息的共享和应用与检查信息资源和数据库的建立2项指标权重分别为0.0408和 0.0401,指标智能化生产检查移动终端的配备和使用所占权重为 0.039 1,仅略小于 0.040 0,说明检查机构应当科学建立信息数据库、保证信息资源的充沛并促进信息的共享与应用,同时做好网络的维护和信息的安全保障工作,以此实现检查工作的高效率和高质量。提升检查信息化水平对于提高检查效率、改善检查效能具有重要作用。
检查员管理:检查员是在执行检查工作时的主要责任人,检查员的能力与素质对于检查工作的有效性和真实性具有重要影响。各项二级指标中,检查员的能力建设及素质提升权重为0.0405,其余3项专职检查员的选拔机制及队伍规模、检查员的激励和约束机制、检查员的分类分级管理、考核评价和职级升降机制3项指标权重均为 0.0380。因此,检查机构要对专职检查员进行严格选拔,确保专职检查员在检查员队伍体系中的主体责任意识和能力水平。同时采取适当的激励与约束机制推进专职/兼职检查员队伍建设,加强检查员队伍监管能力水平由此逐步构建起以监管高效、职能明确、协作顺畅覆盖全面为导向的职业化、专业化的检查员队伍体系和药品监管工作体系。
检查结果:检查结果的客观真实性不仅是对整项检查工作的反馈,表明检查工作的质量,同时也关系到药品的安全情况,与生命健康息息相关。虽然检查结果指标在各项一级指标中所占权重最小,但其下各项二级指标中,检查结果的客观真实性、检查结果的处理和跟踪、检查信息公开的及时性和全面性与检查工作执行率4项指标权重分别为 0.043 7,0.0423,0.0415,0.0405,均高于0.0400;被检查方权利救济的有效性所占权重为 0.0399,近似于0.0400。因此,检查机构应当确保检查结果的真实有效性,加强对检查结果所得信息、数据的处理,并合理、全面、及时地公开相关信息,同时对检查中发现的问题进行跟踪,确保及时整改。
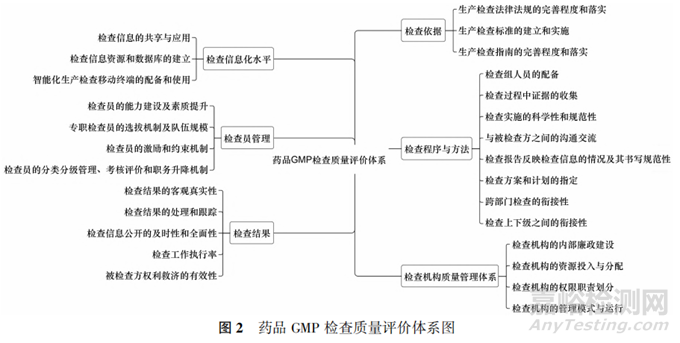
二、构建药品 GMP 检查质量评价体系
根据文献研究法和调查问卷法最终形成了药品GMP 检查质量评价指标,上述指标是对我国药品GMP 检查质量特性及相互联系的表征,依此构建出更为科学化、规范化、系统化的我国药品 GMP 检查质量评价体系,见图2。评价体系是将所有指标按照一定关系构成整体,将权重较大的检查依据、检查方法与程序和检查机构质量管理体系3项指标放于右侧,检查信息化水平、检查员管理和检查结果3项权重相对较小,放于左侧,并在每一项一级指标下按权重由高到低的顺序进行二级指标的排列,由此构建出的我国药品GMP 检查质量评价体系更加系统化,能够准确把握评价逻辑,为药品 GMP 检查工作提供有效参考。
三、评价指标体系的运行
3.1 运行标准
检查机构在药品 GMP 检查过程中,不仅要遵循上述药品 GMP 检查质量评价体系中的各项指标,确保指标的落实和有效实施;同时也应当达到以下准则,以确保体系的科学、规范运行。
3.1.1 有效性
药品GMP检查质量体系在运行过程中应当确保药品生产企业质量检查过程和检查结果的科学有效性。以科学合理的架构布局明确管理战略,按照预期的目标和方向进行 GMP 检查。
3.1.2 客观性
药品GMP检查质量体系在运行过程中要强调客观依据,注重检查过程中证据的收集和检查结果、结论的客观量化,避免因检查主体的主:观评价产生影响。
3.1.3 全面性
药品GMP检查质量体系在运行时要考虑到影响任务展开的所有环节和因素,从原料药的购人、中间产品的产出以及最终产品包装全过程进行质量检查,确保检查工作得到全面落实、检查内容和检查结果全面公开。
3.1.4 系统性
系统性是指检查质量管理体系内部检查机构与被检查方之间的要有清晰的逻辑关系,确保整个检查机构和质量管理体系的系统性、有序性。
3.1.5 可行性
体系内各项指标应当切实可行,具有一定的可操作性,全面考虑时间、空间的限制,具有实际运用的基础。
3.1.6 高效性
在依据 GMP 对药品生产企业发起检查时,应兼顾检查质量与检查效率。以药品生产企业质量检查为导向,在确保检查质量的同时对监督检查时已反复关注的一些检查内容作出适当精简:通过建立的评价方法,评价主体可直观、快速、便捷地得出评价结论。
3.2 运行方式
检查机构可根据上述我国药品 GMP 检查质量评价体系进行检查工作。以体系下每项指标的权重作为检查过程中的评判准则,权重越高指标在检查过程中应当给予越高度的关注并严格按照指标评价执行。在依照评价体系检查过程中,检查机构可采取直接赋分法或层次分析法进行评价结果的计算、即邀请评价人员对体系中的各项指标按照落实程度进行打分,以分值乘以相应权重得出评价结果,使评价体系得到有效运行。
四、对评价指标体系运行效果进行验证的建议
对于药品监管机构 GMP 检查评价指标体系运行效果的验证可以采用直接赋分法和层次分析法进行实际操作。
4.1 层次分析法
层次分析法是主观赋权评价方法的一种,它将与决策有关的元素分解成目标层、准则层、指标层和方案层等多个层次,并在此基础上进行定性和定量分析,是一种实用、简单,有效的决策方法。层次分析法的主要分析过程通常包括构建层次模型、构造判断矩阵、计算权重向量和一致性检验4个步骤,通过邀请专家对我国药品GMP 检查质量的各项评价指标进行赋值,然后利用层次分析法对指标的权重进行量化计算、比较分析,从而判断各项指标的相对重要性。将依据权重得出的评价结果与未构建指标评价体系之前的评价结果进行对比,并进行依据的实证分析。
4.2 构建层次评价模型
目标层:我国药品 GMP 检查质量评价体系;指标层:各一级指标;准则层:各二级指标。
4.3 构造评价矩阵
邀请专家组对我国药品 GMP 检查质量的各项评价指标进行赋值,以1~9级判断矩阵标度法为依据,对获得的数据取平均值后,可构建出如下评价矩阵。
1~9级判断矩阵标度法见表4。
4.4 指标相对权重的计算
首先计算每行乘积的n次方更,得到一个n维向量 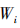 ,公式中n为指标的数量,
,公式中n为指标的数量,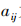 为第i和第j指标的重要性之比。
为第i和第j指标的重要性之比。
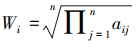
其次将向量求和归一化处理得到权重向量,即第i项指标的权重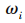 。
。
4.5 一致性检验
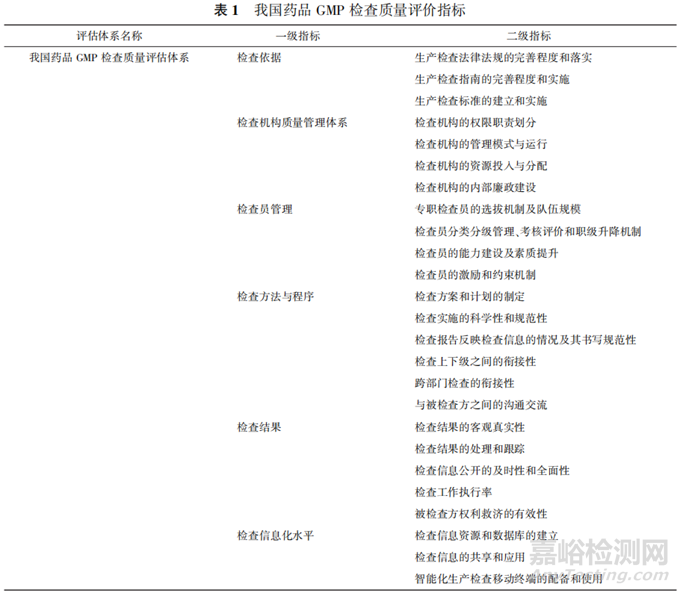
一致性检验需计算出一致性比率(CR)值,若最终得出结果为 CR<0.1,则说明判断矩阵 A 的一致性程度在容许的范围内,可用A的特征向量开展权向量计算;若 CR≥0.1,则说明构建矩阵时出现了逻辑错误,需要重新校对。计算 CR 值首先需计算 出最大特征根和一致性指标(CI)值,步骤如下。通过判断矩阵和权重矩阵可以计算最大特征根,公式中 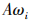 ,为判断矩阵与标准化权重的乘积。
,为判断矩阵与标准化权重的乘积。
计算出最大特征根之后即可求解一致性指标CI值,其公式如下。
由最大特征根和一致性指标值即可计算CR值,判断是否通过一致性检验。其中RI为一次性检验值。
计算出指标的权重并通过一致性检验后,将各指标获得的原始得分结合权重得出样本2的评价结果,即评价体系运行后我国药品 GMP 检查质量的评价结果,并将其与样本1进行对比,探究构建的评价指标体系是否促进了 GMP 检查水平和能力的提高。
五、提升评价体系运行的有效措施
5.1 构建科学体系,明确机构职责
构建科学有效的检查质量体系、形成职责明确的组织体系结构是检查机构进行有效检查工作的基础。科学有效的体系不仅包括合理建立对被检查方的检查程序,也应当是检查机构自身管理的科学有效性,上至管理层人员下至基层检查人员,均应明确机构职能,共同构建科学的质量检查体系。
5.2 提高重视程度,加强评审管理
开展药品GMP 检查质量体系审查工作对于检查机构自身发展和药品生产企业具有重要作用,也是进行检查质量体系管理的重要环节。通过体系内审和管理评审工作能够及时发现我国药品GMP 检查质量体系在实际运行过程中出现的问题,做好及时、有效解决,完善检查体系。在内审方面,应当由管理层开始进行层层审查,确保体系内员工的意识到位、职责明确。在管理评审方面,应当按照每年一定的频次进行审查,确保检查质量体系运行中存在的问题得以及时纠正并解决,促进检查体系运行质量与水平的提高。
5.3 加强日常监督,持续改进提升
我国药品 GMP 检查质量体系是一个动态调整的体系,应当随着相关政策和药品生产企业的实际情况进行调整。因此,一方面检查机构要加强日常监督管理,不断发现问题,有的放矢地实施改进才能不断提高检查质量管理体系的有效性。同时也要在日常管理的基础上持续改进提升,致力于将检查机构从高速增长逐步向高质量发展转变,更好地保障医药行业发展和人民生命健康。
参考文献
[1]PIC/S.Assessment of quality risk management implementation[EB/0L].(2021-01-01)[2022-07-15].https://picscheme.org/docview/3823.
[2]PIC/S.PIC/S Audit Checklist-Interpretation Guide [ EB/OL ].(2021-10-24)[2022-07-15].https://picscheme.org/doc-view/3549.
[3]PIC/S.Guidelines for Accession to the Pharmaceutical InspectionCo-operation Scheme[EB/0L].(2014-01-09)[2022-07-151https ://picscheme.org/en/publications.
[4]臧克承,蒋蓉,张雪瑞,等,我国药品生产检查制度实施成效评价指标体系研究[J1.中国医药工业杂志,2022,53(3):419-422
[5]江虹,吴春敏.国外药品 GMP 检查风险管理模式及对我国的启示[J1.中国医药导刊,2021.23(8):630-634.
[6]曹嘉成,张书卉,焦灵利.基于风险管理的药品 GMP 检查发起机制研究[J].药学与临床研究,2020,28(3):229-232.
[7]周楠.药品生产监管信息系统分析与设计[D].山东:山东大学.2013.
[8]付秋雁,张闯,邹任贤.建立药品 GMP 检查员能力评估体系的探索[J1.上海医药,2019.40(7):10-12.
[9]戴佳芯.基于风险矩阵法的泸州市药品安全风险评估研究[D1.四川:西南财经大学.2020.
[10]陆仕华,李杉,蒋明艳,等.注射剂类药品生产风险防控检查的分析与改进对策[J1.中国医药工业杂志,2022,53(10):1516-1521.
[11]谢伟.药品 GMP 质量管理体系中变更控制、偏差管理、质量风险管理分析[J].化工设计通讯,2020,46(1):217-218.
[12]孙京林,余伯阳.药品生产质量管理规范检查的历史与展望[J1.中国新药杂志,2022.31(3):201-205.
[13]代虎.质量风险管理在生物制品生产中的应用[D].上海:上海交通大学,2019.


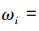
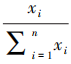 可求各项指标权重,式中
可求各项指标权重,式中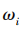 为权重,
为权重,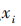 代表各项指标数值。求得各指标数值之和为 24.76,将每一指标数值除以 24.76,即得到各指标权重,见图1。
代表各项指标数值。求得各指标数值之和为 24.76,将每一指标数值除以 24.76,即得到各指标权重,见图1。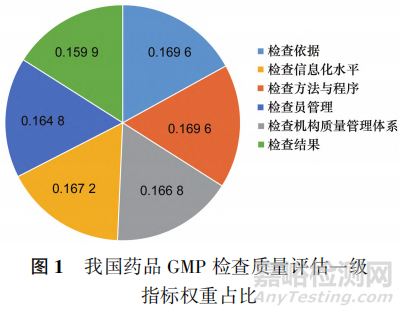
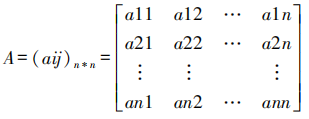

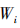 ,公式中n为指标的数量,
,公式中n为指标的数量,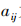 为第i和第j指标的重要性之比。
为第i和第j指标的重要性之比。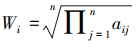
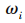 。
。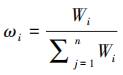
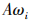 ,为判断矩阵与标准化权重的乘积。
,为判断矩阵与标准化权重的乘积。