您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-02-18 10:28
摘要
药品中微量水平的遗传毒性物质具有引发肿瘤甚至癌症的风险,并且该致癌风险可能与剂量没有相关性。因此,目前各国监管机构要求对药品中遗传毒性杂质进行严格控制。本综述通过查阅国内外相关文献、指导原则,从监管机构对药品中遗传毒性杂质的监管策略、遗传毒性杂质来源、检测方法及清除策略4个方面进行了系统的总结综述。该综述为药品中遗传毒性杂质的控制/清除、检测提供了参考和依据。
通常,药品中的活性成分可以通过全合成或者以天然产物为先导化合物,进行结构修饰以获得。而上述这两种情况,均需要使用多种化学试剂并经过一步或多步化学反应。因此,即使经过纯化步骤,在最终的原料或制剂中,还会存在一定量的和药效无关的杂质。同时,在药品的制剂或储存过程中,也可能生成一定量的杂质。
这些杂质和药效无关,同时可能具有毒性,甚至具有遗传毒性和致癌性[1]。美国食品药品监督管理局(Food and Drug Administration, FDA)、欧洲药品管理局(European Medicines Agency,EMA)等各国药品监管机构自2006年已开始持续关注原料药中遗传毒性杂质的情况,及可能对人体健康造成的负面影响。
遗传毒性杂质是指能够直接或间接损伤细胞DNA,造成DNA突变并伴有致癌性危害人类健康的物质。其对DNA的损害包括染色体断裂、DNA重组及复制过程中共价键的插入和修饰,也包括在细胞水平上产生遗传毒性物质而造成的突变。由于微量水平的遗传毒性物质也会对服药者造成不可逆转的危害,可能会引发肿瘤甚至癌症的风险,并且该致癌风险可能与剂量没有相关性,存在遗传毒性化合物在极低剂量水平下导致人体DNA损伤,且该损伤效应可通过遗传物质的复制而不断放大的风险。因此对遗传毒性杂质的检测和控制极其重要。
遗传毒性杂质的种类较多,有黄曲霉素类、亚硝胺化合物、烷基-氧化偶氮基化合物,磺酸酯类、氯代烷烃类、苯胺类、硝基苯、多环芳烃以及叠氮化物等。由于黄曲霉素类、亚硝基化合物、烷基-氧化偶氮基化合物毒性较强,属于特殊关注队列(表1)。
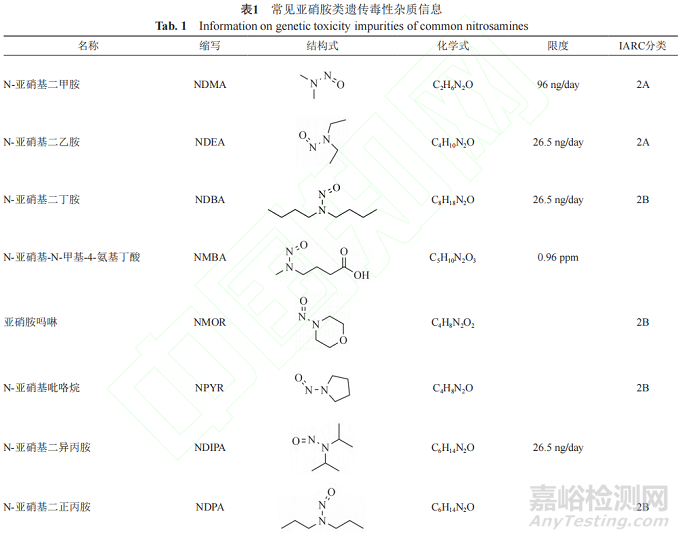
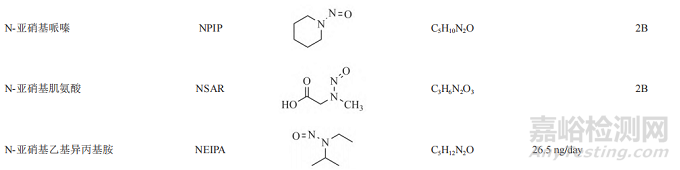
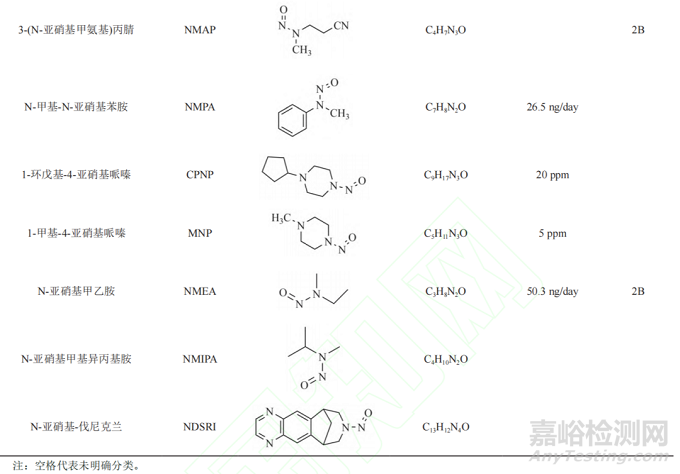
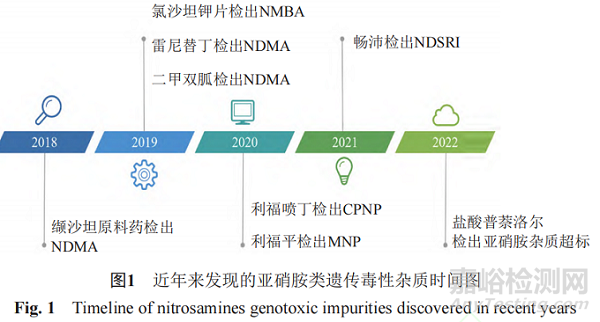
近年来,亚硝胺化合物残留而引发药品召回的事件频发。2018年,浙江省华海药业在缬沙坦原料药中检测出微量的亚硝胺类遗传毒性杂质N-亚硝基二甲胺(N-nitrosodimethylamine,NDMA)后,亚硝胺类杂质事件引起了业内的普遍关注。2019年3月,FDA公布氯沙坦钾片中亚硝胺类遗传毒性杂质N-亚硝基-N-甲基-4-氨基丁酸(N-Nitroso-Nmethyl-4-aminobutyric acid,NMBA)超出暂定控制限度(0.96 ppm)。同年9月,FDA发布安全警告,雷尼替丁中检出亚硝胺类遗传毒性杂质NDMA,之后也导致相关产品被召回。随后FDA又在降糖药二甲双胍中检出微量NDMA。2020年7月,WHO公布在赛诺菲公司的利福平、利福喷丁中检出亚硝胺杂质MNP、1-环戊基-4-亚硝基哌嗪(1-cyclopentyl-4-nitrosopiperazine,CPNP),随后FDA也公布了其暂定限度为5和20 ppm。2021年,因含有亚硝胺化合物N-亚硝基-伐尼克兰,辉瑞公司召回戒烟药Chantix。次年又因亚硝胺类杂质超标,长效降压药盐酸普萘洛尔被召回。上述事件总结见图1。此类亚硝胺杂质事件频发,增加了患者使用药物的风险,也给企业带来了无法估计的损失,同时也给制药行业和监管机构敲响了警钟。
本综述希望通过对药品中亚硝胺类杂质的来源、检测方法、控制策略和清除的方法进行探讨,为相关人员提供参考。
一、 亚硝胺类遗传毒性杂质的监管
20世纪以前,对于药品中遗传毒性杂质的监管的制度和措施几乎空白。随着检测技术和监管理念的发展,近年来,各个国家和地区的药物监管措施的逐渐完善。2002年,EMA的专利药物委员会(Committee forProprietary Medicinal Products,CPMP)后更名为人用药物委员会(Committee for Human Medicinal Products,CHMP)发布关于遗传毒性杂质的意见书[2]。该意见书按照杂质是否存在有证据的阈值而将遗传毒性杂质进行分类:①有足够的研究证据支持其阈值的杂质,建议参照ICH Q3C中二类溶剂的方法进行控制;②无充分阈值研究证据的杂质,采用“最低技术可行”(as low as technically feasible,ALATF)的原则进行控制。
2004年,EMA发布遗传毒性杂质限度指南(草案),对意见书进行了修改。默认完全消除遗传毒性杂质的引入风险是无法实现的,改以“最低合理可行”原则(as low as reasonably practical,ALARP)替代了“最低技术可行”(ALATF)原则,建议用毒理学关注阈值(threshold of toxicological concern,TTC)作为遗传毒性杂质的可接受限度[3]。TTC根据半数致癌剂量(median toxic dose,TD50)的五万分之一为摄入量进行线性外推,从而得到十万分之一(10-5)致癌率的摄入量,并以此数值作为每人每天最高摄入量[4]。上述TD50的数据通常来源于致癌性强度数据库(carcinogenicitypotency database,CPDB)以及啮齿类动物致癌性试验数据库[5]。
由于部分遗传毒性杂质致癌性强,危害较大,即使低于“毒理学关注阈值”也会对人体有较大致癌风险,所以美国药品研究与制造企业协会(Pharmaceutical Research and Manufacturers ofAmerica,PhRMA)又提出了“五分类”系统,将遗传毒性杂质分为5类。2014年,人用药品注册技术协调会(the international council for harmonisation oftechnical requirements for pharmaceuticals for humanuse,ICH)在EMA、PhRMA和FDA的基础上颁布了关于遗传毒性杂质指南ICH M7,对“五分类”[6]做了一些增补,见表2。

2017年,ICH评估和控制药物中DNA反应性(致突变)杂质的ICH M7指导原则将致癌风险高的N-亚硝基类化合物列为“特殊关注队列”,并根据其致癌性相关分析,将其列为“具有已知致癌致突变性”的Ⅰ类杂质[7]。
根据ICH M7和EMA相关指南,作为“特殊队列”中的亚硝胺类杂质应根据药物每日最高使用剂量计算终身使用的药物中亚硝胺类杂质的临时限度。也可根据TD50等其毒理学参数计算每日允许暴露量(permitted daily exposure, PDE)或每日允许摄入量(acceptable daily intake,ADI)。然后在此基础上,根据每日用药量和用药周期对其限度进行确定[4]。若在CPDB及啮齿类动物致癌性试验数据库中未查见亚硝胺杂质的TD50值,可以采用相似结构化合物的TD50值计算杂质限度。
当然,存在着一种药物中含有多种遗传毒性杂质的风险。EMA安全工作小组(safety workingparty,SWP)对于含有两种及以上的亚硝胺类杂质的限度控制,提出了两种监管策略[13]:第一种策略是按照致癌风险最强的一种亚硝胺杂质的限度进行控制;另一种策略将总含量控制在罹患肿瘤的风险不超过10-5的水平。同时,SWP提供一种替代方法,建议为每种亚硝胺杂质设定一个特定的限值,从而确保所有检出的亚硝胺杂质的总和不超过10-5的总风险水平。而对于毒理学数据不足的亚硝胺类杂质的控制限度,比如N-亚硝基甲乙胺(N-nitroso-methylethylamine,NMEA)、N-亚硝基二丙胺(N-nitrosodi-N-propylamine,NDPA)胺类化合物,EMA推荐使用结构上与其最为接近的亚硝胺类化合物的TD50为基础估算其限度[5]。而对于短期服用药物,ICH M7提出了可使用小于寿命(less thanlifetime,LTL)的方法计算其限度。但是,当前多数CHMP专家基于亚硝胺类杂质暴露量与DNA损伤无严格线性关系,同时经过LTL计算后,限度偏高,造成短期风险增大。
我国对于遗传毒性杂质的研究起步较晚,2017年我国加入ICH后,相继颁布了指导原则。2019年1月,国家药典委员会发布关于遗传毒性杂质指导原则审核稿,指导遗传毒性杂质的分类和控制,《中国药典》2020版四部通则中新增了该指导原则[8]。2020年5月,我国国家药品监督管理局药品药审中心网站发布了《化学药物中亚硝胺类杂质研究技术指导原则(试行)》,该原则对准备注册申请上市和已上市化学药品中亚硝胺类杂质的研究和控制提供了指导原则[9]。
二、亚硝胺类传毒性杂质的来源
药品中亚硝胺类遗传毒性杂质的产生的原因复杂且多样。从产生机理角度分析,亚硝胺类遗传毒性杂质的产生机理分为两大类:一是经典的亚硝化反应。如不同胺类化合物与不同亚硝化试剂相互作用发生的亚硝化反应,主要以仲胺和叔胺化合物为主,亚硝化试剂主要包括亚硝酸根离子、亚硝酰卤化物、亚硝酸酯、三氧化二氮和四氧化二氮等。二是非经典类的亚硝化反应。硝基胺高温下的还原反应,硝基胍用锌粉还原可形成亚硝胺;肼类化合物如偏二甲肼发生的氧化反应;还有腙臭氧分解成亚硝胺;有机金属的亚硝化;将格氏试剂加入到一氧化氮中可以得到亚硝基羟胺等。其中常见的反应就是亚硝化反应,任何含N-H的化合物都可能发生亚硝化反应[10],比如胺、(杂)酰胺、氨基甲酸酯、羟胺、羟胺醚、肼、腙、酰肼、脲和胍。上述反应机理如图2所示。
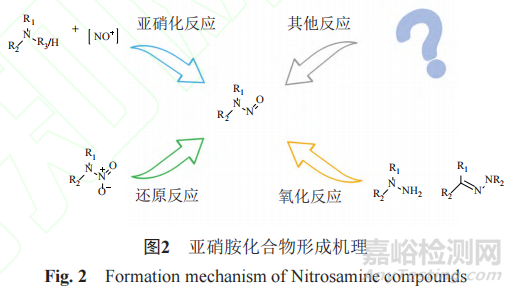
药物在生产、储藏的过程中均有可能产生亚硝胺类杂质[11-12]。华海药业在缬沙坦的合成路线中使用了叠氮化钠,其溶剂为N,N-二甲基甲酰胺(N,Ndimethylformamide,DMF)。该合成路线相对于之前的合成路线,具有收率高的特点。但经研究表明,溶剂DMF在合成过程中,会降解生成二甲胺。二甲胺会与淬灭过量的叠氮化钠使用的亚硝酸钠发生亚硝化反应,进而产生亚硝胺类杂质NDMA[6]。强效组胺H2受体拮抗剂雷尼替丁本身结构中的硝基和二甲胺发生也会亚硝化反应,降解产生NDMA。与雷尼替丁结构相似,二甲双胍结构中也含有一个二甲胺,容易与亚硝酸盐生成亚硝胺杂质。
基于以上机理,亚硝胺类遗传毒性杂质来源主要有3种途径:一是来源于生产工艺。在生产过程中引入了胺类化合物或亚硝化试剂,如起始原料、反应物、中间体以及药物合成中发生的副反应。此外还应考虑某些溶剂、催化剂等也会降解生成仲胺或叔胺化合物。沙坦类中NDMA的来源就是生产工艺使用了胺类和亚硝酸钠反应产生的[13]。并且生产过程使用的溶剂DMF和N-甲基吡咯烷酮的水解或者热降解分别产生仲胺如二甲胺和甲基丁胺,随后发生N-亚硝化反应,最终产生NDMA和NMBA;二是可能来源于储存过程、包装材料以及并线生产等。含有硝化纤维的泡罩包装也会生成亚硝胺杂质[13];三是来源于起始物、中间体或原料的降解产物。比如雷尼替丁中的NDMA杂质是在储存过程中降解产生的[14],尤其高温加热时生成的亚硝胺杂质更多[15-16]。
遗传毒性杂质具有重大的遗传毒性风险,是需要重点控制的杂质,对遗传毒性杂质控制的水平可以反映药品质量标准的水平[17]。因此为了人类的健康和安全,有必要了解其产生机理并建立一种灵敏的方法来检测和定量药品和药品中的遗传毒性杂质。同时对杂质的清除措施也需十分明确。
三、亚硝胺类遗传毒性杂质的清除
2020年6月,EMA就上市许可持有人如何避免在人用药中产生亚硝胺类杂质提出指导意见:调整生产工艺,提前预防亚硝胺化合物的生成;做好合成路线、起始原料、中间体、原料(溶剂、试剂、催化剂等)的风险评估,找出生成亚硝胺化合物的潜在原因[13];如若通过实验证实确有亚硝胺化合物存在,应考虑改变生产工艺、原料和中间体、原材料或初级包装(如含有硝化纤维的泡罩包装等),以避免使用亚硝化剂;如果证明亚硝化剂与溶剂、试剂和催化剂的结合在整个过程中不可避免,则应在原料药和制剂生产中实施适当的控制措施[13]。
FDA在21世纪提出“质量源于设计”(quailtyby design,QbD)理念,其被定义为基于一种科学和质量风险管理之上,预先定义好目标产品质量并强调对产品与工艺的理解及控制的一个系统的研发方法。对潜在遗传毒性杂质进行风险评估的策略就是利用质量源于设计提供更详尽的对工艺的理解,最终确定杂质产生的临界区域。Madasu等[18]采用上述策略,设计了氯沙坦钾盐的5步合成法。从设计源头避免并控制杂质的产生,才是控制杂质产生的根本途径。药品在设计生产时,如避免不了杂质的产生,也应尽量控制杂质在最终反应4步以外产生[6],再设立杂质清除步骤。
四、亚硝胺类遗传毒性杂质分析方法研究进展
由于亚硝胺类遗传毒性杂质在极低的浓度就具有较强的毒性,同时该类杂质具有低分子量、高亲水性的特点,是检测的难点。目前关于药物中亚硝胺类杂质的检测方法,主要包括如高效液相色谱-紫外检测器(HPLC-UV)[19-21]、高效液相色谱-质谱(HPLC-MS)[22-24]、气相色谱-质谱(gas chromatographymass spectrometry,GC-MS)等[25-30]。
4.1 高效液相色谱法
高效液相色谱法是药物分析中最为普遍的方法,其具有灵敏度高,专属性好的优点[8]。70%以上的化合物都可以用高效液相色谱分离。由于亚硝胺类遗传毒性杂质的高亲水性,十八烷基硅烷(octadecylsilyl,ODS)或苯基硅烷键合相色谱柱常用于亚硝胺类杂质的分离[19]。常使用的检测器包括紫外检测器、质谱检测器和荧光检测器等。
4.1.1 紫外检测器
由于其简便性和可及性,带紫外的液相色谱可应用于较高浓度的遗传毒性杂质测定的快速筛查和定量。Sayaka-M等[19]采用Inertsil ODS-3柱(150 mm×4.6 mm,5 μm,GL Science)建立了高效液相色谱-光电二极管阵列检测器(photo-diodearray detector,PDAD)检测缬沙坦中NDMA的定量方法。该方法检测限为0.057~0.17 ppm,定量限为0.19~0.57 ppm。上述方法可用于缬沙坦原料药和市售产品中NDMA杂质的快速筛查和定量。Kunjan等[20]采用C18(250 mm×4.6 mm, 5 μm)色谱柱建立了HPLCUV同时测定缬沙坦中6种亚硝胺杂质的定量方法,其检测限为6~13 ppm,定量限为20~41 ppm。范婷婷[21]等采用SHISEIDO C18型色谱柱(4.6 mm×250 mm ,5 µm)建立了HPLC-PDAD测定缬沙坦中N-二甲基亚硝胺含量。检测限为0.01 ppm,定量限为0.03 ppm。
4.1.2 荧光检测器与化学发光检测器
当然,紫外检测器用于亚硝胺类杂质的检测存在着很多挑战。首先需要对液相色谱条件优化,比如流动相组成、pH等需要花费较长时间。此外,HPLC-UV方法的检测限和定量限也较高。为了降低检测限和定量限以达到遗传毒性杂质测定的需要,可以通过荧光衍生化法(fluorescence derivatizatio,FLD)[31,34]或化学发光检测法(HPLC-PR-CL)[32]进行检测。
由于亚硝胺类遗传毒性杂质结构中无荧光基团[33],因此需采用荧光衍生化法进行荧光标记,以提高检测灵敏度。Zhao等[34]采用柱前荧光标记建立了高效液相色谱-荧光检测法(HPLC-FLD)测定食品中N-亚硝基吡咯烷(N-nitrosopyrrolidine,NPYR)、N-亚硝基二乙胺(N-nitrosodiethylamine,NDEA)、N-亚硝基二丁胺(N-nitrosodibutylamine,NDBA)和N-亚硝基二丙胺(N-nitroso-di-N-propylamine,NDPA)4种亚硝胺杂质方法。该方法检测限在1.3~2.5 ng/L范围内。Takahiro等[32]采用Capcell Pak C18 MGII(5 μm,4.6 mm,250 mm或100 mm)色谱柱建立了高效液相色谱-光化学反应-化学发光法(HPLC-PR-CL)分析再生水中NDMA的含量。检测限为2 ng/mL。该方法与固相萃取-气相色谱串联质谱法相比具有相同的准确度。但其具有比该法样品用量小、分析时间快、操作方法简单等优点。
上述方法论述了对药品、食品和水中亚硝胺类遗传毒性杂质的检测方法和检测限,检测限可达到1~13 ng/mL不等。可根据遗传毒性杂质的性质和含量选择合适的检测方式。但考虑到遗传毒性杂质的含量通常较低,常规液相色谱法只适用于含量较高的遗传毒性杂质的定量,因此HPLC的检测限也往往达不到要求,需要灵敏度更高的检测器来解决。
4.1.3 质谱检测器
由于较高的灵敏度,LC-MS法已被广泛探索用于分析含量较低的遗传毒性杂质当中。表3总结了FDA先后建立了液相色谱串联高分辨质谱法(liquid chromatography tandem high resolution massspectrometry,LC-HRMS)对血管紧张素Ⅱ受体拮抗剂类药物、雷尼替丁、利福平、利福喷丁中遗传毒性药物检测方法。
采用电喷雾离子源(electrospray ionization,ESI)的质谱多为高分辨质谱和串联三重四级杆质谱。
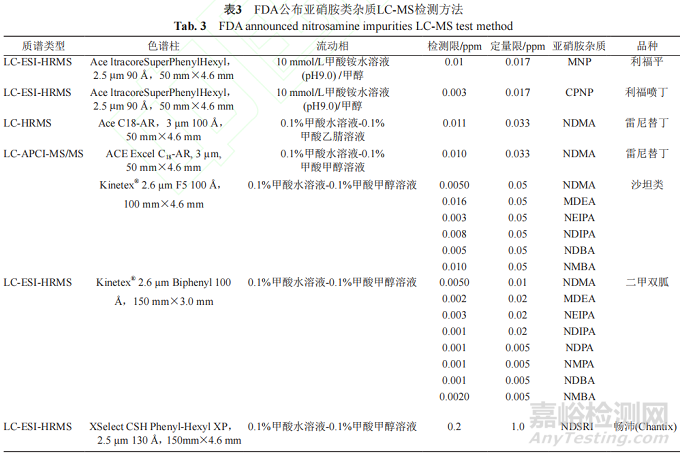
FDA公布的几种亚硝胺类遗传毒性杂质的检测方法为高分辨质谱。因其分辨率高、质量精密度高等优点被广泛应用在药品检测中。Wohlfart等[22]通过FDA的方法对15批利福平胶囊中的遗传毒性杂质MNP检测。该方法采用标准曲线法定量,检测结果为0.7~5.1 ppm。其中一份样品的测定结果略微大于FDA规定的上限(5 ppm)。同时,该研究指出,FDA采用的外标单点法可能由于个别样品中MNP浓度超过了标准曲线法的线性范围,而导致结果不准确。刘博等[23]建立LC-ESI-HRMS法测定54批盐酸二甲双胍缓释片中7种亚硝胺杂质的检测方法。此外,LCMRM-MS也广泛应用于药物中遗传毒性杂质的检测中。Tao等[35]建立了HPLC-ESI-MS/MS方法检测30批利福平制剂中遗传毒性杂质MNP的含量。该方法与六通阀切换相结合,避免了利福平进入质谱仪造成污染。
采用LC-MS技术对遗传毒性杂质进行检测时,药品中的辅料、杂质可能会对待测成分产生基质效应,对检测结果造成影响。有文献表明,与ESI离子源相比,使用大气压化学电离源(atmospheric pressure chemical ionization,APCI)时,基质效应较小[24]。同时,APCI源的灵敏度要高于ESI源[24,32,36],且APCI源更适合一些难离子化的化合物[37]。
APCI离子源在药物杂质检测中应用范围较广,常见的化学药品(雷尼替丁、二甲双胍、沙坦类等)中的亚硝胺化合物都可采用APCI离子源检测[38-41]。此外,APCI离子源还可用于生物制品中遗传毒性杂质的检测,Luo等[24]采用盐析液液萃取(salting-outliquid-liquid extraction,SALLE)前处理技术建立了SALLE-LC-APCI-MS/MS法测定单克隆抗体中的13种亚硝胺杂质的方法。这是首次为生物制药中亚硝胺遗传毒性杂质的定量提供了一种可靠而灵敏的方法。
表4总结了上述文献中亚硝胺类杂质LC-MS检测方法。
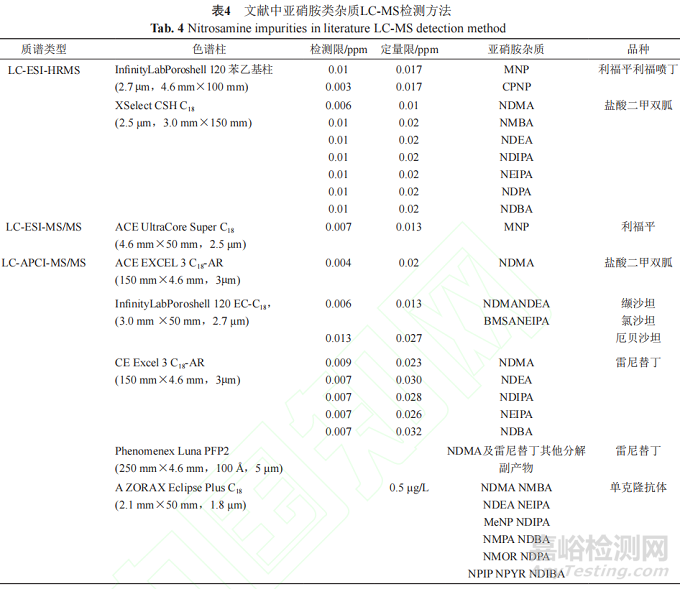
综上所述,液相色谱串联质谱检测技术由于具有灵敏度高等特点,已成为ppm级别的遗传毒性杂质定量检测的常用方法。色谱柱多采用C18或苯基柱。APCI源和ESI源均可应用于药物中亚硝胺类遗传毒性杂质的检测,但采用APCI源的基质效应风险通常低于采用ESI源。
由于遗传毒性杂质含量较低,为了保证较好检测结果,往往需要向质谱中注入较高浓度的样品。但是,对于没有经过前处理的样品,直接进样会使高浓度的主成分进入离子源,对质谱仪造成污染。因此,可以通过固相萃取(solid phase extraction,SPE)、固相微萃取(solid phase microextraction,SPME)和分散液-液微萃取等方法或阀切换技术连接[38,40,42]在线样品处理技术对样品进行前处理。
4.1.4 气相色谱法
虽然质谱串联热能分析仪(gas chromatographytandem thermal energy analyzer, GC-TEA)联用也可应用于遗传毒性杂质的检测中,但 GC-MS更为普遍。
表5总结了FDA先后建立的直接进样(directinjection, DI)气相色谱串联质谱法(DI-GC-MS)和顶空(headspace, HS)气相色谱串联质谱法(HS-GC-MS)对沙坦类药物中亚硝胺类遗传毒性药物的检测方法。
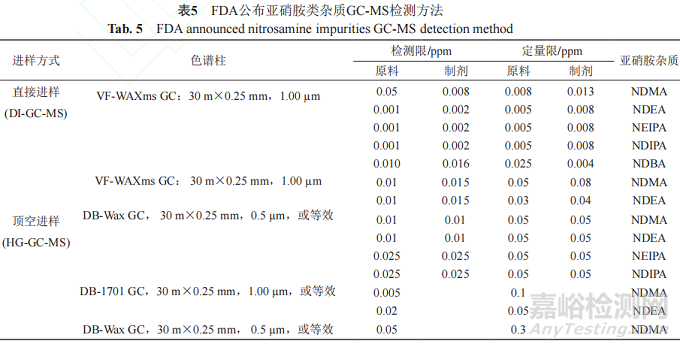
DI-GC-MS精密度较高,重复性好,适合液体进样,但进样时可能会有主成分造成的干扰。目前DIGC-MS已用于很多药品(缬沙坦、西洛他唑、苹果酸舒尼替尼、奥美沙坦酯、阿莫西林等)中遗传毒性杂质的定量检验[43-45]。
顶空进样法适合挥发性较大的杂质。该方法将样品置于顶空瓶中,只抽取样品中挥发性气体进行测定,大大减少了样品基质对被分析物的干扰。同时,该方法具有无须复杂的前处理过程且操作简单的特点。Wichitnitnithad等[25]建立了HS-GC-MS法检测10批缬沙坦原料药中遗传毒性杂质含量的方法。Lee等[26]建立了无溶剂(SF)-HS-GC/MS对原料药和制剂中NDMA进行检测,与传统的HS-GC/MS和LC-MS/MS方法相比,该法对NDMA的快速筛选更加方便,不需要样品前处理。具有较高的灵敏度和选择性。
需要注意的是,无论使用直接进样还是顶空进样,GC-MS最大的挑战在于待测主成分的遗传毒性杂质在高温下有增加的风险。Lim等[27]建立了一种GC-MS/MS同时测定沙坦类、二甲双胍和雷尼替丁等8种药品中遗传毒性杂质的方法。该方法采用沉淀法和固相萃取法进行前处理。该方法在去除药物和辅料的同时,NDMA和NDEA得到了有效的回收。是一种方便可行、灵敏度高、专属性好、准确性和精密度较高的检测方法。该法通过前处理除去了主成分,使得雷尼替丁这种受热易分解的药物也可用GC-MS/MS法检测,为此类药物的检测提供了可替代的方法。Alshehri等[28]建立了HS-SPME-GC-MS法检测雷尼替丁中遗传毒性杂质NDMA。该法采用固相微萃取技术,制备过程简单,采用低温从而避免了雷尼替丁受热分解,可用于其他受热易分解药物的遗传毒性杂质检测。Chang等[29]采用固相萃取前处理法建立了HS-SPME-GC-MS/MS检测44种药物中14种亚硝胺的方法。
GC也可与TEA联用,但该仪器价格昂贵,故适用范围比较小。GC-TEA的原理是热能分析仪能特异性催化亚硝胺类化合物裂解成一氧化氮(NO)基团,与臭氧反应后会产生近红外光,利用光电倍增管检测,从而对亚硝胺类化合物的含量进行测定。咸瑞卿等[30]建立了GC-TEA法检测13批缬沙坦原料药及其制剂中 NDMA含量。GC-TEA 法相对于GC-MS,减少了背景和基质干扰,避免了采用GC-MS法时定性、定量离子保留时间附近有较多干扰峰的问题,保证了低浓度样品的定量准确性。但由于其价格昂贵,通常不作为亚硝胺类杂质的检测方法。
表6总结了上述文献中亚硝胺类杂质GC-MS检测方法。
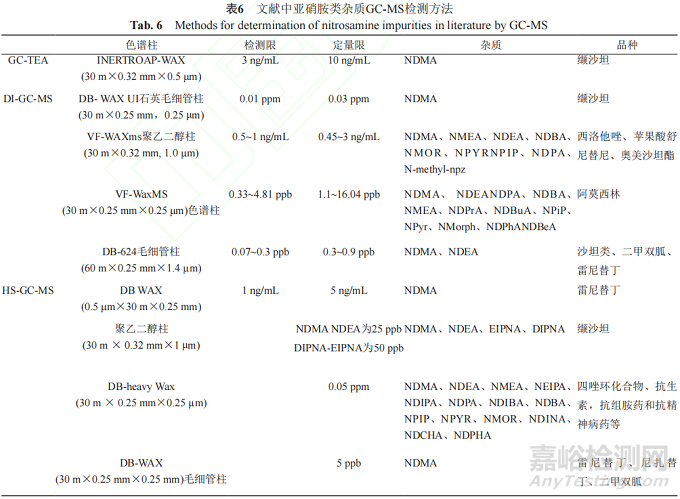
以上内容总结了近年来气相色谱串联热能分析仪和质谱检测亚硝胺类遗传毒性杂质的分析方法。GC-MS相对于LC-MS具有分析速度快、操作简单、成本低等特点,虽然应用范围较LC-MS窄,主要适用于易挥发性成分的分离检测,但也是遗传毒性杂质检测不可或缺的方法。直接进样法相对于顶空进样法的灵敏度高,但可能会有主成分或者辅料等干扰造成的基质效应,该基质效应是待测样品与硅醇基或玻璃衬管表面金属离子间的相互作用所导致。这些基质成分有利于被测样品转移至检测器,从而导致较高的分析信号[46-47]。因此,GC-MS中的基质效应更多表现为基质诱导增强效应,产生假阳性。为了避免这种干扰,要考虑色谱条件和前处理方法的优化。选择合适的内标可以校正测量过程产生的误差,是避免基质效应的有效方法。同位素内标法常用于计算检测结果。除此之外,还可采用固相萃取法、沉淀法等除去主成分和辅料的干扰。顶空进样收集挥发性气体进行检测,操作简单,无须前处理。同时结合固相微萃取技术,可显著降低复杂基质的干扰,增加检测灵敏度,并且适用于受热不稳定样品的检测。SPME是一种附加在注射针上的辅助纤维萃取技术,可用于在样品分析前提取目标分析物[29]。SPME结合HS-GC-MS法已广泛应用在遗传毒性杂质检测中。
由于微量水平的遗传毒性物质也会对服药者造成不可逆转的危害,可能会引发肿瘤甚至癌症的风险,并且其引发的致癌风险可能与使用的剂量没有相关性,存在遗传毒性化合物在极低剂量水平下导致人体DNA损伤,且该损伤效应有通过遗传物质的复制而不断放大的风险。因此各国监管机构要求对药品中遗传毒性杂质进行严格控制。而对于制剂中的遗传毒性杂质检测,由于成分复杂,制剂中的辅料可能会引起基质效应,从而影响遗传毒性杂质检测结果的准确。目前,多是根据不同品种、不同生产企业去建立相应的检测方法,使得监管效率降低。可以尝试通过在线阀切换、固相萃取等方式建立前处理方法,使得检测方法更有通用性。此外,近年来,随着各国对遗传毒性杂质的研究逐渐深入,对于遗传毒性杂质认知也发生了变化。监管机构对遗传毒性杂质的控制也更加科学、合理。生产企业通过采用“避免-控制-清除”的策略,使实际工艺中所有可能涉及的遗传毒性杂质风险得到明确鉴别和控制,是达到监管期望的有效途径。
本文从监管机构对药品中遗传毒性杂质的监管策略、遗传毒性杂质来源、检测方法及清除策略4个方面进行了综述,为药品中遗传毒性杂质的控制/清除、检测提供了参考和依据。
参考文献
[1] Szekely G, Amores de Sousa Miriam C, Gil M, et al.Genotoxic impurities in pharmaceutical manufacturing:sources, regulations, and mitigation[J]. Chem Rev, 2015,115(16): 8182-8229.
[2] Safety Working Party. Position paper on the limits ofgenotoxicimpurities(CPMP/SWP/5199/02/draft 2)[S]. London:Committee for Proprietary Medicinal Products, 2002.
[3] 汪生, 杭太俊. 药物中基因毒性杂质检测策略的研究[J].中国新药杂志, 2019, 28(23): 2840-2846.
[4] 叶倩, 耿兴超, 张河战, 等. 亚硝胺类遗传毒性杂质的监管策略及思考[J]. 中国药事, 2021, 35(2): 127-137.
[5] 张立颖, 刘旭亮, 郭统山. 药物研究中的遗传毒性杂质控制浅析[J]. 山东化工, 2020, 49(1): 92-96.
[6] 张霁, 张英俊, 聂飚. 药物研发中基因毒性杂质的控制策略与方法探索进展[J]. 中国医药工业杂志, 2018, 49(9):1203-1220.
[7] 于颖洁. 药物中N-亚硝胺类杂质的检测方法研究[D]. 北京: 中国食品药品检定研究院, 2021.
[8] 孔璇. 药物中N-亚硝胺类基因毒性杂质检测方法的研究进展[J]. 天津药学, 2022, 34(1): 62-67.
[9] 杨竹, 杭太俊, 郭晓迪, 等. N-亚硝胺类基因毒性杂质的研究进展[J]. 药学与临床研究, 2020, 28(4): 270-274.
[10] López-Rodríguez R, McManus J A, Murphy N S, et al.Pathways for N-nitroso compound formation: Secondaryamines and beyond[J]. Org Process Res Dev, 2020, 24(9):1558-1585.
[11] Zhou K, Li J, Luo J H, Zheng D S. Crystal modificationof rifapentine using different solvents[J]. Front Chem EngChina, 2010, 4(1): 65-69.
[12] Parr M K, Joseph J F. NDMA impurity in valsartan andother pharmaceutical products: Analytical methods for thedetermination of N-nitrosamines[J]. J Phar Biomed Anal,2019, 164: 536-549.
[13] The European Medicines Agency. Nitrosamine Impuritiesin Humen Medicinal Products[EB/OL]. https://www.ema.europa.eu/en/documents/referral/nitrosamines-emea-h-a53-1490-assessment-report-en.pdf.(2020-07-09) [2020-08-12].
[14] King F J, Searle A D, Urquhart M W. Ranitidine—investigations into the root cause for the presence ofN-nitroso-N, N-dimethylamine in ranitidine hydrochloride drug substances and associated drug products[J]. Org Process Res Dev, 2020, 24(12): 2915-2926.
[15] FDA Requests Removal of All Ranitidine Products (Zantac) from the Market[EB/OL]. https://www.fda.gov/news-events/press-announcements/fda-requests-removal-all ranitidine products-Zantac-market (accessed April. 10, 2020).
[16] Nowakowska J, Pikul P. Thermodynamic study of thermaldecomposition of ranitidine by HPTLC[J]. Liq Chromatogr Related Technol, 2012, 35: 1676-1685.
[17] 张慧敏, 林建群, 冯康彪, 等. 药品中遗传毒性杂质的评估和控制[J]. 中国现代应用药学, 2014, 31(9): 7.
[18] Madasu S B, Vekariya N A, Koteswaramma C, et al. An efficient, commercially viable, and safe process for preparation of losartan potassium, an angiotensin II receptor antagonist[J].Org Process Res Dev, 2012, 16(12): 2025-2030.
[19] Masada S, Tsuji G, Arai R, et al. Rapid and efficient high-performance liquid chromatography analysis of N-nitrosodimethylamine impurity in valsartan drugsubstance and its products[J]. Sci Rep, 2019, 9(1): 1-6.
[20] Bodiwala K B, Panchal B G, Savale S S, et al. Simultaneous estimation of six nitrosamine impurities in valsartan using liquid chromatographic method[J]. J AOAC Int, 2022,105(1): 1-10.
[21] 范婷婷, 张晓栋. 缬沙坦中N-二甲基亚硝胺的高效液相色谱法检查方法[J]. 医学食疗与健康, 2019(15): 16-19.
[22] Wohlfart J, Scherf-Clavel O, Kinzig M, et al. Thenitrosamine contamination of drugs, part 3: Quantificationof 4-Methyl-1-nitrosopiperazine in rifampicin capsules byLC-MS/HRMS[J]. J Phar Biomed Anal, 2021, 203: 114205.
[23] 刘博, 张佟, 黄露, 等. 液相-高分辨质谱技术测定盐酸二甲双胍缓释片中7种亚硝胺杂质的方法学研究[J]. 中国药物警戒, 2021, 18(5): 454-458.
[24] Luo F F, Liu Y Y, Xie Y G, et al. Simultaneousdetermination of 13 nitrosamine impurities in biologicalmedicines using salting-out liquid-liquid extraction coupledwith liquid chromatography tandem mass spectrometry[J]. JPhar Biomed Anal, 2022, 218: 114867.
[25] Wichitnithad W, Sudtanon O, Srisunak P, et al. Development of a sensitive headspace gas chromatography-massspectrometry method for the simultaneous determinationof nitrosamines in losartan active pharmaceutical ingredients[J]. ACS Omega, 2021, 6(16): 11048-11058.
[26] Lee D H, Hwang S H, Park S, et al. A solvent-free headspace GC/MS method for sensitive screening of N-nitrosodimethylamine in drug products[J]. Anal Methods,2021, 13(30): 3402-3409.
[27] Lim H H, Oh Y S, Shin H S. Determination of N-nitrosodimethylamine and N-nitrosomethylethylamine in drug substances and products of sartans, metformin and ranitidine by precipitation and solid phase extraction and gas chromatography–tandem mass spectrometry[J]. J Phar Biomed Anal, 2020, 189: 113460.
[28] Alshehri Y M, Alghamdi T S, Aldawsari F S. HS-SPME-GC MS as an alternative method for NDMA analysis in ranitidine products[J]. J Phar Biomed Anal, 2020, 191: 113582.
[29] Chang S H, Ho H Y, Chang C C, et al. Evaluation and optimization of a HS-SPME-assisted GC-MS/MS method for monitoring nitrosamine impurities in diversepharmaceuticals[J]. J Phar Biomed Anal, 2022, 221: 115003.
[30] 咸瑞卿, 巩丽萍, 邢晟, 等. 气相色谱-热能分析仪法测定缬沙坦及其制剂中的N-二甲基亚硝胺[J]. 药物分析杂志,2019, 39(8): 1501-1505.
[31] Wang Y, Feng J, Wu S, et al. Determination of methy lmethanesulfonate and ethyl methylsulfonate in new drug forthe treatment of fatty liver using derivatization followed by high-performance liquid chromatography with ultraviolet detection[J]. Molecules, 2022, 27(6): 1950.
[32] Fujioka T, Takeuchi H, Tanaka H, et al. A rapid and reliable technique for N-nitrosodimethylamine analysis in reclaimed water by HPLC-photochemical reaction chemiluminescence[J]. Chemosphere, 2016, 161: 104-111.
[33] Lu S, Wu D, Li G, et al. Facile and sensitive determination of N-nitrosamines in food samples by high-performance liquid chromatography via combining fluorescent labeling with dispersive liquid-liquid microextraction[J]. FoodChem, 2017, 234: 408-415.
[34] Zhao M, Li G, Kong W, et al. Convenient and sensitive HPLC method for determination of nitrosamines in foodstuffs based on pre-column fluorescence labeling[J].Chromatographia, 2016, 79: 431-439.
[35] Tao X S, Tian Y, Liu W H, et al. Trace level quantificationof 4-methyl-1-nitrosopiperazin in rifampicin capsules byLC-MS/MS[J]. Front Chem, 2022,10: 30.
[36] Sörgel F, Kinzig M, Abdel-Tawab M, et al. Thecontamination of valsartan and other sartans, part 1: Newfindings[J]. J Phar Biomed Anal, 2019, 172: 395-405.
[37] 朱文泉, 马健, 李敏. 基因毒性杂质的挑战与控制策略——从ICH指导纲领到实际操作层面[J]. 中国食品药品监管, 2020, (12): 29-44.
[38] 郭常川, 刘琦, 张雷, 等. 高效液相色谱-串联质谱法测定盐酸二甲双胍及其制剂中痕量N-亚硝基二甲胺[J]. 色谱,2020, 38(11): 1288-1293.
[39] Khorolskiy M, Ramenskaya G, Vlasov A, et al.Development and validation of four nitrosamine impuritiesdetermination method in medicines of valsartan, losartan,and irbesartan with HPLC-MS/MS (APCI)[J]. Iran J PharmRes, 2021, 20(3): 541.
[40] 陈鸿玉, 李昭, 刘波, 等. LC-MS法测定盐酸雷尼替丁胶囊中的5种遗传毒性杂质[J]. 华西药学杂志, 2022, 37(5):536-540.
[41] Roux J L, Gallard H, Croué J P, et al. NDMA formation by chloramination of ranitidine: Kinetics and mechanism[J].Environ Sci Technol, 2012, 46(20): 11095-11103.
[42] Liu J, Zhao Z, Yang X, et al. Determination of N-nitrosodimethylamine in ranitidine dosage forms by ESI LC-MS/MS; Applications for routine laboratory testing[J].Iran J Pharm Res, 2021, 20(4): 255.
[43] 吴兆伟, 杜凯, 王琳, 等. GC-MS法测定缬沙坦中的N-亚硝基二甲胺[J]. 中国新药杂志, 2019, 28(20): 2478-2481.
[44] Witkowska A B, Giebułtowicz J, Dąbrowska M, etal. Development of a sensitive screening method for simultaneous determination of nine genotoxic nitrosamines in active pharmaceutical ingredients by GC-MS[J]. Int J Mol Sci, 2022, 23(20): 12125.
[45] 周刚, 李鹏飞, 高家敏. GC-MS/MS法测定阿莫西林原料药中12种N-亚硝胺类基因毒性杂质[J]. 中国抗生素杂志,2021, 46(4): 291-296.
[46] 徐炎炎, 李森, 张芹, 等. 气质联用和液质联用中基质效应的分析和总结[J]. 农药, 2017, 56(3): 162-167.
[47] 陈鹏. 气质联用和液质联用中基质效应研究进展[J]. 天津药学, 2020, 32(4): 67-72.

来源:Internet


