靶蛋白降解(Targeted protein degraders, TPDs)是一种比较新的小分子药物形式,利用体内泛素蛋白酶系统(ubiquitin proteasome system, UPS)对目标蛋白进行降解。目前进展较快的TPDs处于临床Ⅲ,是一款名为ARV-471的雌激素受体降解剂。
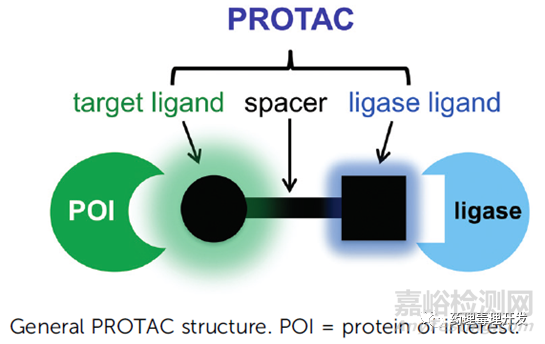
TPDs分子的形式如下图所示,由三部分组成:识别靶蛋白的配体、连接子和识别E3连接酶的配体。PROTAC是TPDs常见形式。PROTAC分子通过结合靶蛋白(POI)和E3连接酶,形成三元复合物,给靶蛋白打上泛素化的标签,泛素化的蛋白被细胞内的蛋白酶体26S识别并降解。
TPDs是典型的不符合Lipinski's Rule of 5即类药五原则的分子(比如分子量<500,不超过5对氢键供体,不超过10对氢键受体,logP不超过5),再加上结构也较传统化药复杂,有点类似双靶点小分子,在非临床安评部分有诸多需要特别关注的点。目前还没有针对TPDs非临床研究的专有指南,这类领域也尚无产品上市,可参考的权威资料有限。
找到一篇来自Pfizer、BMS、Abbvie、Astrazeneca和GSK的团队,就TPDs非临床安全性评价,做的一个调查问卷。文章名:《Industry perspective on the nonclinical safety assessment of heterobifunctional degraders》,感兴趣的也可以自行检索。文中,对TPDs非临床安评的一些特殊之处或需要重点关注之处给出了提示,结合笔者的一些理解,从体外和体内安全性角度略作分享。
体外安全性
TPDs类产品体外安全性与常规小分子化药要求类似。但TPDs也有一定特殊性,或者说需要特别关注的点。
比如TPDs普遍溶解度不好,需要关注毒性评估是否会受限于溶解度差。
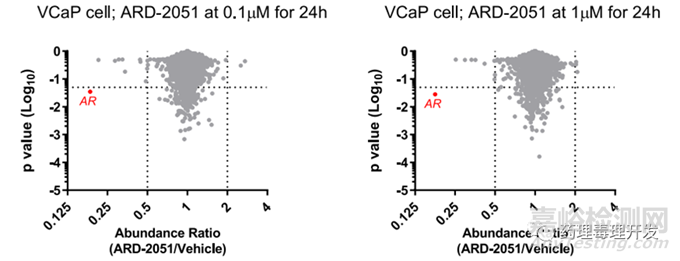
另外,需额外关注非特异性结合及可能引起的脱靶毒性。关于脱靶毒性,传统小分子通常会开展受体谱、激酶谱的研究,以确定药物可能影响的信号通路,或可能导致的次要药理学作用。TPDs类产品则不同,由于这类产品靶蛋白端结合什么,就可能降解什么,因此需要对各种蛋白的浓度进行监测,以确定是否出现可能脱靶降解。关于蛋白脱靶,也不能像小分子似的,选择一组常见的受体或者酶进行筛选。TPDs需要对大量的已知和未知的蛋白质进行广泛评估,该文章推荐的关键技术是蛋白质组学研究。蛋白质组学技术其实在科研院所用的比较多,是从整体的角度,分析细胞(或组织等)内动态变化的蛋白质组成成份、表达水平与修饰状态,能更全面的评估可能的在靶或脱靶蛋白变化。如下图所示,一个靶向AR受体的PROTAC候选分子ARD-2051,采用蛋白质组学技术在VCaP细胞系中,对>5700蛋白质进行了分析,以评估ARD-2051的选择性,选择DMSO处理的细胞作为对照,结果显示ARD-2051在0.1、1μM浓度可以将AR蛋白水平降低82%以上,且AR是唯一浓度降低超过2倍的蛋白,说明ARD-2051的选择性还不错,没有明显的脱靶。
TPDs的作用持续时间也是一个关注点。TPDs只需要比较低的浓度即可发挥作用,而且E3连接酶-TPD-靶蛋白三元复合物降解完一个目标蛋白后,还可继续降解下一蛋白,循环利用,作用时间持久。这是和小分子化药比较大的一个区别。
此外,TPDs类产品通常渗透性一般,但又需要穿过细胞膜进入胞内才能发挥作用,故约47%的TPDs开发企业会对产品的渗透性进行重点评估。
体内安全性
TPDs类产品体内安全性所遵循的指南和要求与常规小分子化药要求类似。需要特别关注点的包括种属选择、给药频率、恢复期、脱靶毒性及胚胎-胎仔发育毒性的早期评价。
TPDs类产品的理化性质一般,故供试品方面遇到比较大的挑战还是溶解度问题。溶解度又通常与暴露量有相关性。但目前还没有太好的策略从制剂层面解决这一问题。常用的制剂处方还是pH调节剂、环糊精、表面活性剂和脂质成分等。
给药途径方面,大部分企业选择PO和IV给药。而SC给药出现给药部位耐受性问题的概率比其他途径更高。
几乎90%的受访企业反馈,TPDs类产品体内毒理研究中的毒性表现会出现非on-target情况。而且并不认为是E3泛素酶降解所致,所以也不能定性为脱靶,具体机制不明。不同公司不同TPD产品的毒性累及器官也不一样,未发现共性特点。唯一能做的就是默认非on-target毒性具备临床相关性,做好风险管理计划。也有受访企业通过调整给药途径解决该问题,但具体技术细节并未披露。
给药频率通常可通过PK/PD研究确定。单纯PK参数不能作为给药频率制定的唯一依据。相反,TPDs产品的PK/PD数据通常还会出现背离。究其原因,PK通常仅检测外周血血药浓度,当外周血浓度低于LLOQ时,组织中即使较低浓度的TPDs依然还在持续发挥作用(PROTACs may enable a disconnect between pharmacokinetics and pharmacodynamics to provide extended duration of in vivo efficacy long after the PROTAC has been cleared from systemic circulation)。所以,可以结合PK和组织中靶蛋白降解情况确定给药频率。
恢复期设置也要考虑到TPDs产品药理作用的延迟和延长。
种属选择对任何形式的药物安评都至关重要,TPDs类产品自然也不例外。TPDs的种属选择基本原则是在目标种属中具备药理学活性。比较特别之处在于TPDs是双靶,既要结合目标降解蛋白,还要考虑E3泛素酶配体与E3泛素酶如CRBN之间的种属差异。另外,鉴于脱靶是TPDs绕不开的风险,种属选择还要将种属间脱靶相似性作为依据之一。这里不得不再次提到蛋白质组学,通过不同种属细胞的蛋白质组学研究,找到与TPDs在人体细胞中降解蛋白类似的种属,既考察目标靶蛋白,也兼顾潜在的脱靶蛋白(Building confidence in species selection is a key activity for the safety evaluation of TPDs. Degradation of on-and off-target proteins also needs to be adequately assessed using proteomic techniques)。另外,如果选择CRBN E3泛素酶,非人灵长类并不是非啮齿类动物的默认选择(Importantly, there was a unanimous response that companies do not default to nonhuman primates as the nonrodent species for toxicity studies when the E3 ligase is CRBN)。当然,这点主要是与CRBN目前是大多数TPDs开发企业的主要选择,公开发表的CRBN种属差异文献较多有关。其它E3泛素酶虽然披露的数据少,但可能也会存在同样的问题。不过,如果单从序列一致性看,人和食蟹猴的CRBN氨基酸相似度高达99.8%,442个氨基酸中,仅在第128为氨基酸有区别,该位点还不一定是配体的结合位点。但无论如何,这也是Pfizer、BMS、Abbvie、Astrazeneca和GSK等大厂调查问卷拿到的国外蛋白降解药物开发企业给出的经验之谈。TPDs类产品的种属选择总体来看比较复杂,个人觉得核心原因与决定这类产品双功能特性的是连接子两端的两段小分子,而小分子我们知道比较大的一个缺点就是特异性不好,所以无论结合靶蛋白端的小分子,还是结合E3泛素酶的配体小分子,多个变量将种属选择复杂化了。所以,TPDs的很多毒性表现机制尚不明确。文中推荐的蛋白质组学或许是一种简单直接的做法,无论中间在靶或脱靶结合哪些蛋白,最终还是要看结果,大范围的蛋白质变化监测其实很大程度上提高了成功的概率。当然,难点也留给了蛋白质组学,主要体现在方法的可靠性、稳定性及结果的客观性、全面性等。当然,类似小分子,体外代谢角度的研究如MetID对种属选择也是有必要的。
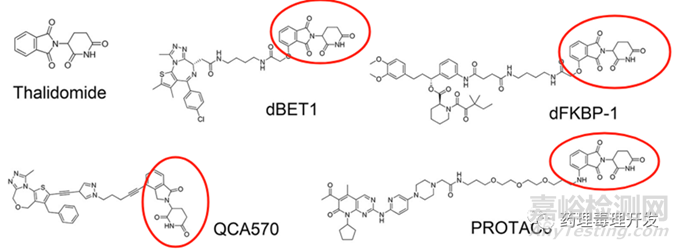
生殖毒性方面,大多数受访企业均将胚胎-胎仔发育毒性试验的开展节点前置了。这点与著名的致畸药物沙利度胺不无关系。因为,CRBN的一个主要配体就是沙利度胺。很多选用CRBN的TPDs里面均含有沙利度胺的结构,如下图所示。所以,无论拟开发适应症是肿瘤还是非肿瘤,这一重大风险均需要引起足够重视,尽早且全面评估。
安全药理方面,TPDs的半衰期比化药要久,比如ARVIVAS的ARV-471,动物中的消除半衰期达28h左右。但TPDs产品的另外一个特点是,延迟的、延长的持续降解,哪怕外周血已经检测不到药物存在,药理作用依然在组织中默默持续。所以,通常的做法是延长给药后的观测时间。
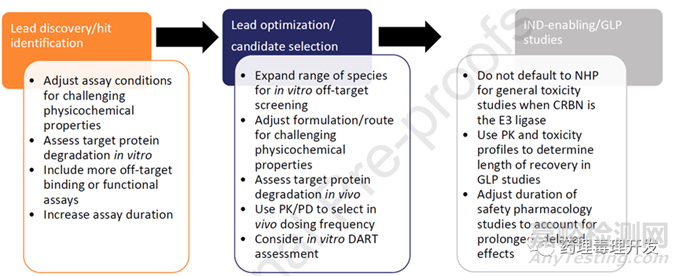
不同开发阶段TPDs的安评关注点如下图所示。前文已有提及,不再赘述。
总结
TPDs类药物安评基本原则跟化药类似,但又有其特殊考量点。首先,TPDs理化性质不符合类药五原则,溶解度和渗透性通常比较一般,涉及到药物暴露和给药途径调整问题。其次,TPDs作用时间通常较化药更久,且出现PK/PD的背离,需要延长体外、体内研究的观测时间。比如恢复期的延长、安全药理观察时间的延长、细胞活性实验监测时间的延长等。然后,脱靶毒性是TPDs产品常见问题之一,最好在PCC确定前即开展脱靶风险评估,蛋白质组学技术可以作为重点考虑。第四,TPDs作为双功能小分子,种属选择既要参考化药的代谢相关思路,更要兼顾在靶和脱靶的种属间差异。关于这点,蛋白质组学的价值再被提及。另外,非人灵长类并不一定是默认的最佳选择。最后,生殖发育毒性不一定到临床阶段评估,考虑到TPDs类产品的致畸高风险,通常将发育毒性开展节点前置。
TPDs产品属于比较新颖的小分子药物形式,尚无产品上市,国际和国内的经验都不是太多,非临床安评可以参考化药相关指南,同时又要兼顾其结构、理化性质、药理作用等的特殊性,特别关注一些属于这类产品的特点,合理调整研究内容和试验方案。