今日头条
阿斯利康拟12亿美元收购亘喜生物。阿斯利康宣布已与亘喜生物签署最终协议,以约12亿美元的总价格收购后者。亘喜生物将作为阿斯利康全资子公司继续在中国及美国运营。12月22日,亘喜生物靶向BCMA/CD19双靶点自体FasTCAR-T产品GC012F已获得CDE临床许可,拟开发用于治疗难治性系统性红斑狼疮(SLE)。在美国,FDA已批准GC012F针对复发/难治性多发性骨髓瘤(R/R MM)和SLE开展Ⅰ/Ⅱ期临床。
国内药讯
1.明济Claudin18.2抗体启动III期临床。明济生物Claudin18.2抗体药物M108在Clinicaltrials.gov官网注册一项III期临床,拟评估M108联合化疗与安慰剂+化疗对比,一线治疗Claudin(CLDN)18.2阳性、HER2阴性、PD-L1 CPS<5、局部晚期或转移性胃/GEJ腺癌的有效性和安全性,M108能充分利用抗体的免疫学抗肿瘤机制,通过增强型的ADCC效应充分调动患者机体的免疫细胞来杀伤肿瘤细胞。该项试验预计在2027年完成。
2.信达玛仕度肽启动头对头III期临床。信达生物GLP-1R/GCGR激动剂IBI362(玛仕度肽)登记启动一项头对头III期临床,拟评估IBI362与司美格鲁肽相比,用于经单纯饮食运动干预伴/不伴二甲双胍单药治疗血糖、体重控制不佳的中国早期2型糖尿病合并肥胖受试者的疗效和安全性。该项试验主要研究者由北京大学人民医院医学博士纪立农担任。本月月初,玛仕度肽(9mg)已启动了一项减重III期临床。
3.深圳未知君FMT药物获批II期临床。未知君肠菌移植(FMT)药物XBI-302获FDA批准开展II期临床,评估用于治疗急性移植物抗宿主病(aGvHD)的有效性与安全性。XBI-302将患者体内遭破坏的肠道菌群置换成健康菌群,在不影响移植物抗宿主病治疗的前提下,帮助机体重建免疫系统,最终实现减少疾病复发、改善愈合。
4.信达OX40L单抗启动I期临床。信达生物靶向OX40L的新型免疫调节剂IBI356登记启动一项I期临床,拟评估IBI356首次在中国健康成人受试者中单次给药和中重度特应性皮炎成人受试者中多次给药的安全性、耐受性及药代动力学特征。该项试验主要研究者由上海市皮肤病医院医学博士史玉玲和朱全刚共同担任。今年11月,CDE也批准了该新药针对特应性皮炎的IND申请。
5.阿斯利康CD123靶向ADC中国报IND。阿斯利康1类生物药AZD9829的临床试验申请获CDE受理。AZD9829是一款靶向CD123的拓扑异构酶1抑制剂(TOP1i)-抗体偶联药物(ADC),能够将TOP1i载荷递送到表达CD123的癌细胞中,导致DNA损伤和细胞凋亡。目前,该新药正在Ⅰ/Ⅱ期临床中评估用于单药或联合治疗CD123阳性血液恶性肿瘤患者的安全性和初步抗肿瘤活性。
6.远大医药收购天津田边75.35%股权。远大医药宣布与日本田边三菱制药株式会社签订股权收购协议,将以约港币4.0亿元(等同约人民币3.677亿元)收购天津田边制药75.35%的股权。天津田边主要从事心脑血管、内分泌代谢、胃肠道等慢性疾病领域高质量原研药品的生产与销售。本次收购是远大医药在心脑血管急救板块的一次重大的产业布局。
国际药讯
1.新冠/流感二联mRNA疫苗启动Ⅲ期临床。辉瑞与BioNTech联合开发的针对新冠病毒病和流感的联合修饰RNA候选疫苗在Clinicaltrials.gov网站上注册一项Ⅲ期临床,计划入组7500例受试者,评估联合修饰RNA候选疫苗与已上市流感疫苗对比的的安全性、耐受性和免疫原性,预计2024年8月完成。辉瑞与BioNTech目前重点探索包括新冠/流感、新冠/RSV、流感/RSV、新冠/流感/RSV等联合疫苗。
2.礼来Tirzepatide启动降糖减重II期临床。礼来GLP-1R/GIPR双靶点激动剂Tirzepatide(替尔泊肽)在ClinicalTrials.gov官网注册一项II期临床,拟评估与单独使用胰岛素相比,替尔泊肽与胰岛素联合治疗1型糖尿病合并肥胖患者的有效性与安全性。主要终点是受试者体重变化。此前,替尔泊肽已获FDA批准用于治疗2型糖尿病,以及肥胖适应症。
3.额颞叶痴呆基因疗法早期临床积极。Passage Bio公司基于AAV1载体的基因疗法PBFT02在治疗GRN基因突变、额颞叶痴呆(FTD)患者的国际Ⅰ/Ⅱ期临床获积极结果。前3例患者接受单剂PBFT02治疗后30天,患者脑脊液中的PGRN水平较基线增加3.6-6.6倍(10.7-17.3ng/mL),高于健康成人对照组生理水平(3.3-8.2ng/mL);其中1例患者疗效维持长达6个月。此外,药物耐受性良好。
4.核苷酸DNA聚合酶抑制剂早期临床积极。Medivir公司核苷酸DNA聚合酶抑制剂口服前药Fostrox(Fostroxacitabine bralpamide)联合激酶抑制剂Lenvima(lenvatinib)治疗晚期肝细胞癌(HCC)经治患者的Ⅰb/Ⅱa期临床结果积极。12周的随访期间,联合治疗的疾病控制率(DCR)达到80%;超过75%患者的靶病灶缩小;联合用药总体耐受性良好,没有出现新的安全性事件。
5.赛诺菲终止CEACAM5靶向ADC开发。赛诺菲靶向癌胚抗原相关细胞粘附分子5(CEACAM5)的抗体偶联药物(ADC)tusamitamab ravtansine(SAR408701,IBI-126)用于二线治疗CEACAM5阳性转移性非鳞状非小细胞肺癌(nsqNSCLC)的III期CARMEN-LC03研究未达到主要终点。与多西他赛相比,tusamitamab ravtansine单药治疗的患者总生存期 (OS) 显示改善趋势,但未达到无进展生存期(PFS)的双重主要终点。目前,赛诺菲已终止tusamitamab ravtansine的全球临床开发计划。
6.AI蛋白质药物公司Cradle完成A轮融资。基于人工智能设计和制造蛋白质的生物技术公司Cradle宣布完成2400万美元A轮融资。本轮融资由Index Ventures领投,Kindred Capital参投。Cradle的专有生成式人工智能模型是在数十亿蛋白质序列以及他们自己的实验室生成的数据基础上训练而成的。目前,该公司正在开展12个以上的研发项目,重点关注各种蛋白质疗法的工程设计,包括酶、疫苗、肽和抗体。
医药热点
1.罗凤鸣任四川大学华西医院院长。12月26日,四川大学华西临床医学院(华西医院)召开全院干部大会,宣布四川大学领导任命决定:罗凤鸣同志任四川大学华西临床医学院(华西医院)院长;因年龄原因,李为民同志不再担任四川大学华西临床医学院(华西医院)院长职务。公开资料显示,罗凤鸣,1970年8月出生,研究生,医学博士,中共党员,教授,博士生导师。曾任四川大学华西临床医学院(华西医院)内科党总支书记、党委副书记、党委常务副书记。
2.《第三批鼓励仿制药品目录》发布。近日,国家卫健委等部门发布《第三批鼓励仿制药品目录》。第三批目录收录39个品种,涉及75个品规、13种剂型,覆盖抗肿瘤药及免疫调节剂、抗感染用药、神经系统用药、放射性诊断剂、心血管系统用药等12个方面治疗用药。其中包括治疗成人遗传性转甲状腺素介导的淀粉样变性的多发性神经病的小干扰RNA药品帕替司兰,联合免疫抑制剂治疗成人活动性狼疮肾炎的口服药品伏环孢素等。
3.人用疫苗、部分抗癌药、罕见病药实施零关税。12月21日,国务院关税税则委员会发布公告,2024年将调整部分商品的进出口关税。2024年1月1日起,人用疫苗、部分抗癌药、罕见病药的药品和原料等实施零关税。此外,2024年还将对吸入用异丙托溴铵溶液实施零关税,该药品在临床上被广泛用于儿童哮喘类疾病的治疗。
评审动态
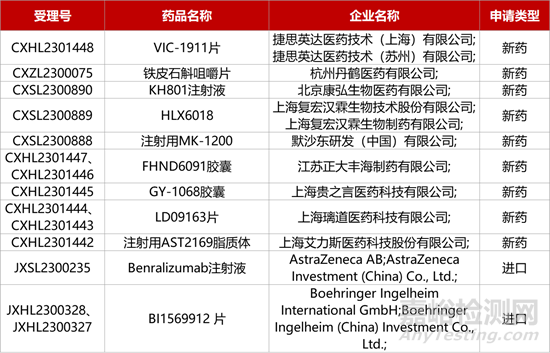
1. CDE新药受理情况(12月26日)
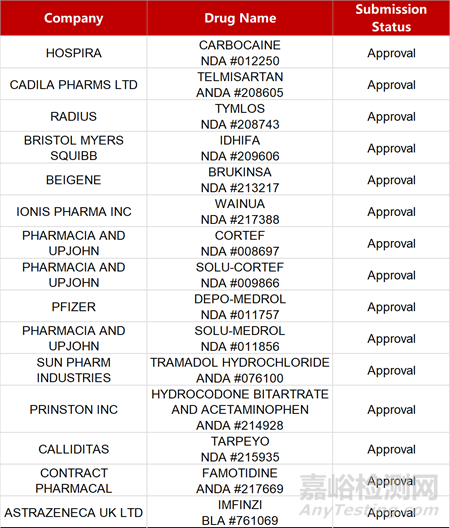
2. FDA新药获批情况(北美12月21日)