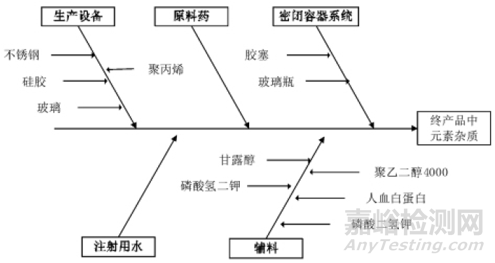
▲图1-药品中元素杂质或重金属杂质来源示意图
元素杂质,该名称最早出自欧美和ICH,其包括可能存于原料药、辅料或制剂中的催化剂和环境污染物,主要指药品生产或贮藏过程中生产、加入或无意引入的物质。由于某些元素杂质具有毒性,还可能对药品的稳定性、保质期产生不利影响,或可能引发有害的不良反应,故各国药监机构对药品元素杂质的控制越来越严格。目前ICH Q3D元素指导原则为全世界主流认可度比较高的法规,过去十几年间,各国药典以不同的发展路径,先后出台了一系列举措,来贯彻Q3D在本区域内的实施。
重金属,早年在各国药典中均有收载,是指相对原子量较大,比重大于5.0g/cm3的金属,约有45种,如铜、铅、锌、铁、镍、锰、镉、汞等。砷虽不属于重金属,但因其来源以及危害都与重金属相似,故通常将其列入重金属类别。
个人理解:重金属和元素杂质是不同时期的两种叫法,元素杂质涵盖的元素种类是多于重金属范畴的,二者有重合的部分又有不同的部分,个人理解元素杂质是重金属的升级版,重金属检查法会逐渐退出各国药典。
1.1 重金属及元素杂质研究增修订背景
早期各国药典,如USP、EP和《中国药典》,对元素杂质的控制主要是针对重金属和部分无机杂质,检测方法主要包括重金属试验、炽灼残渣、硫化物和砷盐检查以及其他的化学检查法。其中,重金属检查法早在《中国药典》1953年版就已收载,后几经修改完善,使这一方法广泛应用于药品中以铅为代表的重金属元素杂质的控制。该方法主要是控制能形成硫化物沉淀的金属元素,如铅、铜和其他金属,这些元素杂质是管道、制药设备、工艺和其他常见来源的潜在污染物。
随着药品生产过程中催化剂和试剂的应用日益广泛,近年来,元素污染的风险因素发生了巨大变化,但其控制标准在几十年内几乎没有变化。现有药典中的检测方法不是针对低水平金属催化剂和试剂的残留设计的,专属性、灵敏度低,不能对单个元素杂质进行定量分析,已不能满足药品安全性控制的需要。同时,药典中提供的可接受限度是基于历史数据,并不一定基于合适的安全性数据。通常,利用药典重金属检查法检测出的金属种类是有限的,并不包括有安全风险的其他金属杂质。
因此,为了保障公众健康安全,建立较重金属检查法更科学的元素杂质限度和测定指导原则,对已明确毒理学问题的元素杂质进行更精确的控制尤为重要。基于以上考虑,ICH提出Q3D元素杂质指导原则,并于2014年11月发布。Q3D适用于原料药和制剂,采用基于风险的方法对元素杂质进行评估,对在改变合成工艺步骤、引入在线或上游控制、原料药和辅料以及容器密闭系统等药品全生命周期内存在的元素杂质进行控制。
在此基础上,欧美药典陆续出台一系列通则或指导原则对元素杂质进行控制,历经多次修订完善;目前,元素杂质的种类和限度基本上和ICH保持一致。
1.2 ICH Q3D指导原则的增修订历程
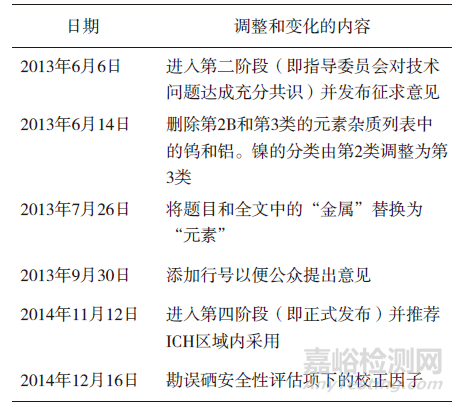
2009年10月,ICH批准制定Q3D金属杂质指导原则,旨为药品中的金属杂质定性和定量控制提供全球性政策。ICH指导原则须经过四个阶段方可公布,在最后第五阶段被ICH区域内的各国药品监管部门采纳。2013年7月,ICH将Q3D指导原则的题目由“金属杂质指导原则”修改为“元素杂质指导原则”。2014年12月,ICH发布了Q3D第四阶段正式文件,其历史进程中的主要节点见表1。Q3D指导原则分为三个部分:评估潜在元素杂质的毒性数据,确定每一种有毒元素的每日允许暴露量(PDE),以及运用ICH Q9质量风险管理指导原则来评估和控制药品中的元素杂质。ICH Q3D指导原则的出台,有利于帮助制药企业通过风险评估来判断对哪些元素进行额外控制,为药品制订合理的元素限度。Q3D中未规定元素杂质的检测方法,药品注册申请人可参考ICH Q2分析方法验证指导原则采用任何经验证的检测方法。
▲表1-ICH Q3D历史进程的主要节点
1.3 USP元素杂质相关控制要求的增修订历程
2008年,USP开始启动元素杂质新标准和方法的制订。2012年12月,USP35第二增补本中增订了通则<232>元素杂质限度、<233>元素杂质测定方法;明确要求测定各元素杂质含量而不是总量,即由半定量转为定量控,将取代通则USP<231>重金属检查法,于2014年5月1日正式执。
2015年12月,USP38第二增补本删除了<231>重金属检查法,且<231>重金属检查法自2018年1月1日不再执行。
由于USP和ICH的工作进程不同,二者在不同时期内容不尽一致,相关规定有所差异;在2017年12月后(USP40版之后),USP修订了通则<232>中的元素杂质种类和限度,与ICH规定保持一致,并规定在2018年1月1日之后,针对USP品种,提交改良型新药申请(NDA)、仿制药的申请(ANDA)应符合USP通则<232>、<233>。针对非USP品种,申请人提交新的NDA、ANDA时,应该遵循ICH Q3D。
▲表2-USP元素杂质相关控制要求的增修订历程
1.4 EP元素杂质相关控制要求的增修订历程
2014年6月,欧洲药品质量管理局(EDQM)制订了对EP重金属通则的修订策略,并在7月的会议上宣布了实施计划:
(1)首先修订EP通则5.20<金属催化剂和金属试剂残留>,一旦Q3D在欧盟进入第五阶段(即正式实施阶段),则采用Q3D取代5.20的相关内容;
(2)2016年7月,新注册申请执行Q3D;
(3)2017年12月,欧盟已上市制剂执行Q3D。
2015年3月,EDQM批准了更加详细的策略:(1)2017年1月1日,EP 9.0从各论中删除对通则2.4.8<重金属检查法>的引用;(2)随后逐个评估并删除各论中已有特定元素的检测项,建立Q3D中其他元素如铁、铝等的检测方法;(3)2018年8月1日,EP 9.3中通则5.20引用了Q3D,这标志着Q3D正式在EP中实施。
尽管通则5.20引用Q3D,但按照EP的执行方式,通则5.20只有被各论引用才能成为强制性通则,所以只在通则5.20中引用Q3D,对EP收载的各论约束力不够。因此,EP又在强制性总论2034原料药和2619药物制剂中引用了通则5.20,使Q3D成为强制性法规,成为所有该总论适用的药品必须满足的条件。2619提到在Q3D 适用范围外的产品,企业也应对元素杂质限度进行风险评估。由于通则2.4.8<重金属检查法>已从原料药各论引用中删除,此后企业将选择适当的元素分析策略,使其符合Q3D 的要求。
对于各论中特定元素的实施方法,EP和USP一致,删除了除天然来源外的各论中属于Q3D 分类的特定元素的检测项,保留Q3D中其他元素的检测项。
▲表3-EP元素杂质相关控制要求的增修订历程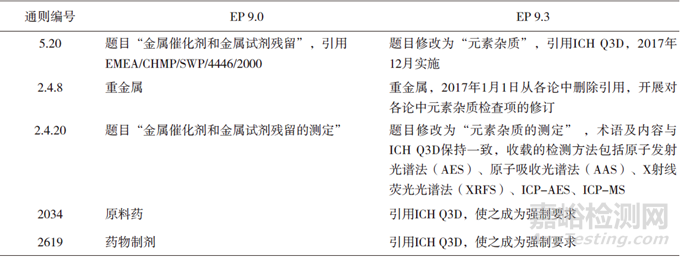
1.5 中国药典元素杂质相关控制要求的现状
目前在元素杂质相关控制要求方面,《中国药典》与USP和EP相比还存在明显的差距,2020年版《中国药典》未针对元素杂质控制收载明确的技术指南或通则,只是在四部通则9102<药品杂质分析指导原则>中提到“无机杂质参照ICH元素杂质指导原则(Q3D)进行研究,并确定检查项目”。与早年欧美药典一样,2020年版《中国药典》也收载了0821<重金属检查法>、一些特定元素测定及中药重金属测定通则,如四部中的0804<硒检查法>、0807<铁盐检查法>、0822<砷盐检查法>,为湿化学法;中药测定法中的2321<铅、镉、砷、汞、铜测定法>,2322<汞、砷元素形态及价态测定法>,为AAS、ICP-MS仪器分析方法。
其中上述是化学法显色测定总量的方法已显得较为落后,2017年我国已成为ICH正式成员国和管委会成员,为加快推进ICH相关要求在我国的实施进程,在参考ICH Q3D指导原则及USP、EP实施策略的基础上,结合我国国情制定《中国药典》元素杂质限度和测定指导原则,提高我国药品中元素杂质控制水平和保障患者用药安全势在必行。
个人理解:从上面汇总的ICH及欧美药典对元素杂质相关控制要求的演变历程看,不难看出传统的化学检查法在逐渐退出历史舞台,取而代之的是专属性更强、灵敏度更高的仪器检查法,定量方式由总量、半定量向单一定量的转变。
虽然制药工业界内有以下声音:一是目前Q3D和M7的适用范围多在美国、欧盟和日本,但全球大量的原料药和辅料的供应商均在上述地区之外;二是元素杂质和致突变杂质研究通常需要专属性/灵敏度更好的昂贵仪器,而制药行业中高端精密仪器龙头企业均为欧美所有;三是通过食物中途径摄入的元素杂质或致突变杂质很有可能超过其在药物中的含量,采用高昂的成本进行研究控制,其风险与获益比是否合理,认为元素杂质和致突变杂质是欧美国家制造的烟雾弹。但不可否认的事实是,各国药监机构都在按Q3D和M7指导原则在进行审评审批,包括中国药监机构CDE。
二、各国药典重金属检查法的对比
2.1 各国药典重金属检测法概述
▲表4-各国药典当前重金属检查法通则汇总
|
药典
|
|
|
|
|
|
|
|
|
USP38 〈231〉 Heavy Metals,已经删除 |
USP2023 〈232〉 Elemental Impurities—Limit
USP2023 〈233〉 Elemental Impurities—Procedures
|
|
|
EP11.3 2.4.8. Heavy metals |
EP11.3 2.4.20. Determination of elemental impurities
EP11.3 5.20. Elemental impurities
|
|
|
BP2013 AppendixVⅡ Limit Test for Heavy Metals |
Limit Test for Heavy Metal已作废,现执行
BP2022 AppendixVⅢ. Determination of Elemental impurities
|
|
|
JP18 〈1.07〉Heavy Metals Limit Test |
|
重金属检查法在各国药典中均有收录或收录过,原理为重金属离子在一定条件下与硫代乙酰胺或硫化钠作用显色,比较对照溶液和供试品溶液的深浅来判断某一品种样品重金属是否超过限量,但无法测定某一重金属的含量。
如中国药典通则0821,是采用硫代乙酰胺试液或硫化钠试液作显色剂,以铅(Pb)的限量表示。在规定实验条件下,与硫代乙酰胺试液在弱酸性条件下产生的硫化氢发生显色的金属离子有银、铅、汞、铜、镉、铋、锑、锡、砷、锌、钴与镍等。由于药品生产过程中遇到铅的机会较多,且铅易积蓄中毒,故以铅作为重金属的代表,用硝酸铅配制标准铅溶液。
由于重金属在不同药物中存在的形式不同,故需要采用不同的方法检测。以中国药典为例,由于实验条件不同,分为三种检测方法:
第一法:适用于溶于水、稀酸或有机溶剂如乙醇的药品,供试品不经有机破坏,在酸性溶液中进行显色,检查重金属。
第二法:适用于难溶或不溶于水、稀酸或乙醇的药品,或受某些因素(如自身有颜色的药品、药品中重金属不呈游离状态或重金属离子与药品形成配位化合物等)干扰不适宜采用第一法检查的药品,供试品需经有机破坏,残渣经处理后在酸性溶液中进行显色,检查重金属。
第三法:用来检查能溶于碱而不溶于稀酸(或在稀酸中即生产沉淀)的药品中的重金属。
2.2 各国药典重金属检测法对比
由于重金属在不同药物中存在的形式不同,故相应分为不同的方法检测;中国药典和美国药典重金属检测收载3种方法,日本药典中收载4种方法,欧洲药典中收载的方法多达8种。各国药典主要检查方法均为目视比色法,其中欧美药典重金属检查法已明确废除并被元素杂质研究取代,此处不再列举对比,中国药典和日本药典重金属检测方法对比见表5。
▲表5-各国药典重金属检测方法对比
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
甲管(标准铅):加标准铅溶液一定量与醋酸盐缓冲液(pH3.5)2ml后,加水或各品种项下规定的溶剂稀释成25ml;
乙管(供试品):加入按各品种项下规定的方法制成的供试品溶液25ml;
丙管(标准铅+供试品):加入与乙管相同重量的供试品,加配制供试溶液的溶剂适量使溶解,再加与甲管相同量的标准铅溶液与醋酸盐缓冲液 (pH3.5)2ml后,用溶剂稀释成25ml;
注:若供试品溶液带颜色,可在甲管中滴加少量稀焦糖溶液或其他无干扰有色溶液,使之与乙、丙颜色一致
|
对照溶液:取各品种专论中规定体积的标准铅溶液,置于纳式比色管种,加入2ml稀醋酸,加水至50ml。
供试溶液:取各品种专论项下的规定样品量,置于纳氏比色管中,加水至40ml,加2ml稀醋酸,加水至50ml。
|
|
|
测上述三个试管中分别加入硫代乙酰胺试液2ml,摇匀,放置2min,在白色背景自上向下观察。 |
向两溶液中加入硫化钠溶液1滴,充分混匀,静置5min,同置白色背景自上向下观察。 |
|
|
当丙管的颜色不浅于甲管时,乙管的颜色与甲管比较,不得更深。 |
|
|
|
1)若丙管(供试品+标准铅)浅于甲管(标准铅)时,应用第二法。
2)甲管滴加稀焦糖等有色溶液仍不能使三管颜色一致,应用第二法。
|
|
|
|
|
1)按照炽灼残渣检查法0841进行炽灼处理,然后取遗留得残渣;
2)直接取该品种炽灼残渣检查项下在500~600℃遗留得残渣;
3)如供试品为溶液,则取各品种项下规定量得溶液,蒸发至干,再按炽灼残渣检查法进行炽灼处理,然后取遗留残渣;
按照上述3种方式之一制备遗留残渣,然后加硝酸0.5ml,蒸干至氧化氮蒸汽除尽后,放冷,加盐酸2ml,置水浴锅上蒸干后加水15ml,滴加氨试液至对酚酞指示液显微粉红色,再加醋酸盐缓冲液(pH 3.5)2ml,微热溶解后,转移至乙管中,加水稀释成25ml。
4)如不取炽灼残渣项下遗留残渣,则可取供试品一定量,缓缓炽灼至完全炭化,放冷,加硫酸0.5~1.0ml,使恰湿润,用低温加热至硫酸除尽后,加硝酸0.5ml,蒸干,至氧化氮蒸汽除尽后,放冷,在500~600℃炽灼使完全炭化,放冷,加盐酸2ml,置水浴锅上蒸干后加水15ml,滴加氨试液至对酚酞指示液显微粉红色,再加醋酸盐缓冲液(pH 3.5)2ml,微热溶解后,转移至纳式比色管中,加水稀释成25ml。
另取配制供试品溶液的试剂,置瓷皿中蒸干后,加醋酸盐缓冲液(pH3.5)2ml与水15ml,微热溶解后,移置纳氏比色管中,加标准铅溶液一定量,加水稀释成25ml;
|
供试溶液:取各品种项下规定量的样品,置石英或磁坩埚或内,缓慢加热至碳化。冷却后,加硝酸2ml,硫酸5滴,使恰湿润,用低温加热至硫酸除尽后,继续加热至不再产生白烟,在500〜600℃炽灼使完全灰化。冷却,加2ml稀盐酸,水浴蒸干,加盐酸3滴润湿,加10ml热水,加热2min。然后加入酚酞指示液1滴,逐滴加入氨试液直至溶液颜色呈浅红色,加2ml稀醋酸(必要时过滤),并用10ml水进行冲洗。将滤液和冲洗液均转移至纳氏比色管中,加水稀释至50ml。
对照溶液:水浴蒸干硝酸2ml、硫酸5滴、盐酸2ml,在沙浴中进一步蒸发至干燥,用3滴盐酸湿润残渣。后续按照供试溶液的操作方法进行,然后加入专项中要求体积的标准铅溶液,加水稀释至50ml。
|
|
|
甲、乙试管中分别加入硫代乙酰胺试液2ml,摇匀,放置2min,同置白纸上,自上项下透视。 |
向两溶液中加入1滴硫化钠溶液,充分混匀后,静置5min,同置白色背景上,自上向下观察。 |
|
|
|
|
|
|
|
乙管:除另有规定外,取供试品适量,加氢氧化钠试液5ml与水20ml溶解后,置纳氏比色管中;
甲管:取一定量的标准铅溶液,加氢氧化钠试液5ml,并加水使成25ml。
|
供试品溶液:取各品种项下规定量的供试品置置石英或磁坩埚或内,开始缓慢加热,然后在500〜600℃炽灼使完全灰化。冷却后,加1ml王水(盐酸-硝酸,3:1),水浴上蒸干,加盐酸3滴润湿,加10ml热水,加热2min。然后加入酚酞指示液1滴,逐滴加入氨试液直至溶液颜色呈浅红色,加2ml稀醋酸(必要时过滤),并用10ml水进行冲洗。将滤液和冲洗液均转移至纳氏比色管中,加水稀释至50ml。
对照溶液:坩埚中加入1ml王水,水浴加热至蒸干,后续按照供试溶液的操作方法进行,然后加入专项中要求体积的标准铅溶液,加水稀释至50ml。
|
|
|
甲、乙试管中分别加入硫化钠试液5滴,摇匀。同置白纸上,自上项下透视。 |
向两溶液中加入硫化钠溶液1滴,充分混匀,静置5min,同置白色背景上,自上向下观察。 |
|
|
|
|
|
|
|
|
供试品溶液:取各品种项下规定量的供试品置石英或磁坩埚或内,加入10ml硝酸镁溶液(1g六水合硝酸镁溶于10ml的95%乙醇中),使乙醇灼烧,使样品碳化。冷却,加入1ml硫酸,缓慢加热,然后在500〜600℃炽灼使完全灰化,加少量硫酸润湿后,继续灼烧至完全碳化。冷却,加入3ml盐酸使残渣溶解,至水浴上蒸干。接下来操作同方法2(蓝色标记部分)
对照溶液:按供试溶液处理方法,将洗液转移至比色管中,加入规定量的标准铅溶液,加水稀释至50ml。
|
|
|
|
向两溶液中加入1滴硫化钠溶液,充分混匀后,静置5min,同置白色背景自上向下观察。 |
|
|
|
|
2.3 国内药品重金属检测注意事项
1)硫代乙酰胺试液与重金属反应受溶液的pH值、硫代乙酰胺试液加入量、显色时间等因素的影响,经试验,重金属硫化物生成的最佳pH值是3.0~3.5,本重金属检查选用的醋酸盐缓冲液(pH3.5)2ml调节pH值,显色剂硫代乙酰胺试液用量2ml,显色时间一般为2分钟,是最有利显色反应进行、使呈色最深的条件。故配制醋酸盐缓冲液(pH3.5)时,要用pH计调节溶液的pH值,应注意控制硫代乙酰胺试液的加入量、显色剂的显色时间,且以每27ml中含10~20μg的铅与显色剂所产生的颜色为最佳目视比色范围。
2)三种方法显示的结果均为微量重金属的硫化物微粒均匀混悬在溶液中所呈现的颜色,如果重金属离子浓度大,加入显色剂后放置时间长,就会有硫化物聚集下沉。为了便于目视比较,第一、二和第三法中的标准铅溶液用量以2.0ml(相当于20μg的Pb)为宜,小于1.0ml或大于3.0ml,呈色太浅或太深,均不利于目视比较。故在检查时,如供试品取样量与标准铅溶液的取用量均未指明时,常以标准铅溶液为2.0ml来计算供试品的取样量,并进行试验。
3)如需取炽灼残渣项下遗留的残渣作重金属检查时,则炽灼温度必须控制在500~600℃。实验证明,炽灼温度在700℃以上时,多数重金属盐都有不同程度的损失;以铅为例,在700℃经6小时炽灼,损失达68%。某些供试品(如安乃近、诺氟沙星等)在炽灼时能腐蚀瓷坩埚而带入较多的重金属,应改用石英坩埚或铂坩埚操作。
4)炽灼残渣加硝酸处理,必须蒸干,至氧化氮蒸汽除尽,否则会使硫代乙酰胺水解生成硫化氢,因氧化析出乳硫,影响检查。蒸干后残渣加盐酸处理,使重金属转化为氯化物,在水浴上蒸干以去除多余的盐酸,加水溶解,加入酚酞指试液1滴,再逐滴加入氨试液,边加边搅拌,直到溶液刚显微粉红色为止,再加醋酸盐缓冲液(pH3.5),使供试液的pH值调节至3.5。
5)供试品中如含有高铁盐,在弱酸性溶液中会使硫代乙酰胺水解生产的硫化氢进一步氧化析出乳硫,影响检查,加入维生素C(0.5~1.0g)可将高铁离子还原为亚铁离子而消除干扰。
6)如供试品自身为重金属的盐,在检查这类药品中的其他金属时,必须先将供试品本身的重金属离子出去,再进行检查。如在枸橼酸铁铵中检查铅盐时,利用Fe3+在一定浓度的盐酸中形式HFeCl62-,用乙醚提取除去,再调节供试液至碱性,用氰化钾试液掩蔽微量的铁后进行检查;右旋糖酐铁注射液中重金属检查,也是在一定浓度的盐酸中,用乙酸异丁酯提取去除铁盐后进行检查。
7)药品本身生成的不溶性硫化物,影响重金属检查,可加入掩蔽剂以避免干扰。如硫酸锌和葡萄糖酸锑钠中铅盐检查,是在碱性溶液中加入氰化钾试液,或在中性溶液加入酒石酸,使锌离子或锑离子生成稳定的络合物,再依法检查。
8)为了消除盐酸或其他试剂可能夹杂的重金属,故在配制供试品溶液时,如使用盐酸超过1ml(或与盐酸1ml相当的稀盐酸)或使用氨试液超过2ml,以及用硫酸或硝酸进行有机破坏,或加入其他试剂进行处理的,除另有规定外,对照溶液应取同样量试液蒸干后,依法检查。
参考文献
1.《中国药典》2020版通则0821、0841、9102。
2.《美国药典》通则<231> Heavy Metals。
3.《欧洲药典》通则2.4.8、2.4.20、2.4.27、5.20。
4.《英国药典》2013版附录VII Limit Test for Heavy Metals、2021版附录VIII W. Determination of Metal Catalyst or Metal Reagent Residues、2023版附录VIII T. Determination of Elemental Impurities。
5.《日本药典》JP18 1.07Heavy Metals Limit Test
6.《中国药品检验标准操作规范 2019版》
7.徐昕怡,刘贞。欧美药典及ICH元素杂质指导原则增修订历程及对中国药典的启示[J]。中国药事,2019年第6期624-629。
8.徐昕怡,洪小栩。从ICH Q3D元素杂质指导原则欧美药典实施历程探索《中国药典》转化路径[J]。中国食品药品监管,2020年第10期22-31。
9.王旸,李眉。药监机构对金属杂质控制的演变[J]。中国新药杂质,2016年第18期2094-2098。
10.滋,刘帅、唐素芳。各国药典中重金属检查方法的比较分析[J]。天津药学,2017年第3期48-51。
11.CH. Guideline for Elemental Impurities Q3D。