摘 要 / Abstract
临床研究在药物研发和医学领域中的作用越来越重要,其中数据质量与科学性是重要环节之一。为了提高数据准确性,我国监管机构积极推进临床研究监管改革,并强调源数据的可追溯性和准确性。电子源数据记录(ESR)技术在提高数据质量和降低成本方面具有重要作用。研究团队围绕源数据质量进行探索,提出建立基于临床研究项目的电子源数据存储库(ESDR)的研究流程以及对应的审核查验要点等解决方案。基于ESDR源数据管理系统的工作流程覆盖了从研究项目源数据采集、治理到研究数据库输出等各个环节,同时对临床研究的数据管理过程操作留痕,具有完备的稽查轨迹,有利于高效地进行审核查验工作。
Clinical research plays an increasingly important role in drug development and the medical field, with data quality and scientific rigor being crucial aspects. In order to enhance data accuracy, regulatory agencies in China are actively promoting reforms of clinical research supervision, emphasizing the traceability and accuracy of source data. Electronic source record(ESR) technology plays a vital role in improving data quality and reducing costs. This research team explores the quality of source data and proposes possible solutions, such as a research workflow for establishing an electronic source data repository(ESDR) based on clinical research projects, along with corresponding audit and inspection points.The ESDR workflow, which relies on the electronic information system, covers the entire process from source data collection and governance to data output, leaving a comprehensive audit trail. This feature makes it convenient for efficient audit and inspection work in the data management process of clinical research.
关 键 词 / Key words
电子源数据存储库;源数据管理;审核查验;临床研究
electronic source data repository; source data management; audit and inspection; clinical research
1、我国监管机构在临床研究监管方面的改革进展
2015年7月22日原国家食品药品监督管理总局发布了关于开展药物临床试验数据自查核查工作的公告[1],此后80%新药申请的临床研究项目被撤回,成为我国医药研发领域著名的“7·22事件”,对我国药品监管改革与医药创新发展具有里程碑意义。2018年我国学者针对英国医学杂志(British Medical Journal,BMJ)在2016年的1篇质疑我国临床试验数据质量的新闻报道[2]发表了观点性文章,阐述了该公告的发布是为了进一步保障我国临床研究数据的准确性,并提出了建立医院临床研究源数据管理平台及源数据管理流程架构来提高我国临床研究数据可靠性的解决方案,即在医院建立一个独立的临床研究项目源数据管理系统,用于电子化同步和存储所有与研究相关的电子源数据[3]。
临床研究在药物研发和医学领域中的作用越来越重要,其中数据质量与科学性是重要环节之一。为了进一步提高临床研究数据的质量和准确性,我国监管机构积极推进临床研究监管改革,不断完善监管政策与规范。2017年,原国家食品药品监督管理总局正式加入国际人用药品注册技术协调会(International Council on Harmonisation of Technical Requirements for Pharmaceuticals for Human Use,ICH),意味着我国药品监管部门、制药行业和研发机构将逐步转化和执行国际制药研发生产的最高技术标准和指南。2019年一项关于临床真实世界数据和证据用于药品医疗器械审评审批的相关探索研究中[4],为保障临床研究收集数据的完整性、准确性、一致性及可溯源性,提出了制定真实世界数据标准,探索新的高效、可靠的数据采集模式。2021年国家药品监督管理局食品药品审核查验中心发布了《药品注册核查工作程序(试行)》等5个文件的通告[5],同年国家药品监督管理局药品审评中心也发布了《药品注册核查检验启动工作程序(试行)》的通告[6]。这两份文件对药品注册核查、申报上市等提出了大量要求,预示着今后国内新药的注册审批会更加规范。2021年9月,国家卫生健康委发布了《医疗卫生机构开展研究者发起的临床研究管理办法(试行)》[7],第三十九条指出:医疗卫生机构应当建立临床研究源数据的管理体系,实现集中统一存储,保障临床研究数据在收集、记录、修改、处理和保存过程中的真实性、准确性、完整性、规范性、保密性,确保数据可查询、可溯源。
2、电子源数据管理在临床研究中的重要性
真实世界数据(real world data,RWD)是指来源于日常所收集的各种与患者健康状况或诊疗及保健有关的数据[8]。尽管已有许多关于如何进一步提高数据准确性的建议,但在保障源数据可溯源性等方面仍面临诸多挑战[9]。源数据是指临床研究中的原始记录或其核证副本上记载的所有信息,包括临床发现、观测结果以及用于重建和评价该试验所必需的其他相关活动记录[10-11]。临床研究的源数据类型包括医疗病历文本、医学影像、音频(比如医生与患者之间的对话、心跳声音、呼吸音)和视频(比如手术过程、康复训练)等多种形式的数据。源数据应当具有可归因性、易读性、同时性、原始性、准确性、完整性、一致性和持久性[12]。与之对应的另一个术语——元数据(metadata),是指“数据的数据”,即用于描述、解释和简化数据检索、使用和管理的数据[13]。元数据包含了关键信息,如数据收集时间、收集者身份、仪器标识等,对于正确理解和验证数据至关重要。临床研究中,如果没有正确的元数据说明,数据就可能变得毫无意义。元数据可以手动录入或通过自动捕获生成,且能与源数据通过唯一标识符相互关联,确保数据的可追溯性。
电子源数据记录(electronic source record,ESR)技术通常指直接从源数据来源捕获、收集并存储与研究项目直接相关的电子源数据和元数据,以简化临床研究的操作流程,进一步提升效率与质量[14]。电子源数据存储库(electronic source data repository,ESDR)是利用ESR技术建立的一个同步和采集、存储临床研究项目所有电子源数据的数据库。ESDR可提供数据的安全存储和管理,在临床研究中扮演关键角色。另外,由于ESDR中的源数据记录与元数据紧密相关,能记录数据生成和处理的所有步骤,因此可通过数据留痕和防止篡改保证数据可追溯。
3、保障临床源数据质量的研究进展
在上述研究背景下,本研究团队立足于国内临床研究现状,将解决“源数据”方面的挑战作为解决临床研究质量的瓶颈,并在海南博鳌乐城国际医疗旅游先行区(以下简称乐城先行区)开展了许多重要的探索研究。前期研究提出了适用于提高我国临床研究数据可靠性的解决方案,即建立医院临床研究源数据平台,构建临床研究源数据通用管理流程[9]。在此基础上,研究团队在乐城先行区开展RWD研究项目的实践,进一步提出了数字化的RWD采集模式[15]。此外,研究团队针对临床研究数据库数据现状提出适用于RWD的数据治理模式[16]以及保障数据安全方面的实施策略[17-18]。2021年,研究团队提出了RWD采集、治理与管理一体化解决工具的建设方案[19]以及RWD相关的数据标准转化的解决方案[20-21]。研究团队与其他机构合作开发了ESR工具[22],并在多个真实世界研究项目中进行了试用[23-24]。
基于前期的经验,本研究将提出围绕ESDR的新型临床研究模式,并结合我国监管机构对审核查验的政策文件要求,提出对应的审核查验路径与要点,以期为促进监管机构对临床研究监管提供参考建议。
4、基于ESDR的临床研究流程
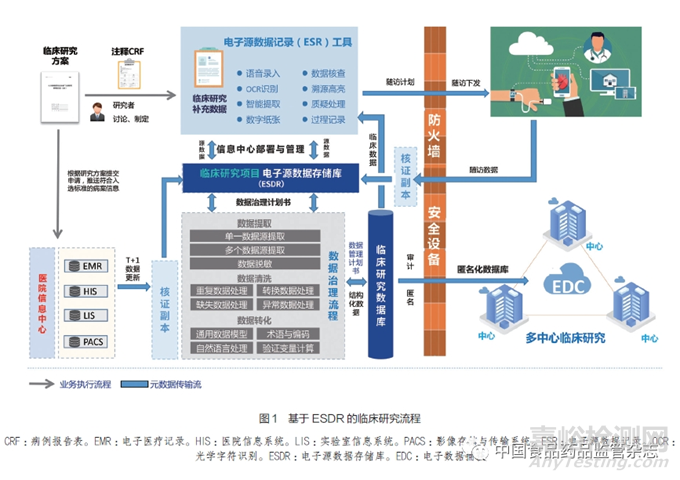
在临床研究中,质量源于设计(quality by design,Qb D)理念也是确保研究质量的关键要素[25],旨在通过在研究设计和执行阶段的质量策略和风险管理[26],确保研究数据的准确性、可靠性和一致性。研究团队基于Qb D理念提出了基于ESDR的临床研究流程(图1),将有助于更好地理解和控制潜在的质量风险,提高研究数据的质量,并确保研究结果的可信度和可重复性。通过基于ESDR的临床研究流程,研究者可以高效、准确地采集和管理临床研究数据,同时确保数据的安全性、完整性和可溯源性等特性。该流程有望优化临床研究的传统数据采集流程,促进临床研究的质量,并为监管机构审核查验提供辅助技术。
4.1 制定临床研究方案和电子病例报告表(electronic case report form,eCRF)
研究开始时,研究团队需要确定临床研究方案,并设计相应的e CRF,用于采集研究数据。根据研究方案进行适用性评价,包括确定数据的来源、采集方式和质量,评估研究的设计和方法是否合理,能否回答特定的研究问题等。
4.2 院内数据采集与备份
基于临床医疗场景与临床研究方案,制定出适用于临床医生诊疗常规的源数据采集模式。ESR工具嵌入了多种功能,如语音录入、光学字符识别(optical character recognition,OCR)和智能提取,帮助研究者高效采集院内研究数据。研究开始前,对参与研究的人员进行相关工具使用和操作技能的培训以及资质的审核等。采集后的数据不需要转化,即保留最初的特征以形成核证副本数据库用于验证数据的原始性。这些数据通过数据脱敏与权限管理可实现远程审核查验的需求。
4.3 院外随访数据采集与备份
医生可以在平台上定制研究的随访计划,通过院内防火墙将其传输到患者端(如手机等),并且与患者密切沟通以减少方案偏离的风险和提高患者安全。在院外采集的随访数据通过院内防火墙加入已有的核证副本,减少研究者院内外管理的负担。采集院内和院外的数据并备份至核证副本数据库中可有效提高研究数据的完整性。
4.4 数据治理
在确定数据治理计划书后,技术人员执行数据治理流程。这包括数据提取、数据清洗和数据转化等步骤。数据提取涉及单一数据源提取、多个数据源提取和数据脱敏等操作;数据清洗包括处理重复数据、缺失数据、转换数据和异常数据等;数据转化包括通用数据模型、自然语言处理、术语与编码以及验证变量计算等操作。
4.5 数据核查与处理
ESR工具配备了数据核查模块,该模块可以在原始记录的核证副本中高亮显示研究数据对应的源数据,便于进行一致性比对和溯源。存疑数据会进行质疑处理,错误数据将由被授权的研究者进行修订。
4.6 数据库形成与传输
基于数据管理计划书产生结构化、标准化的临床研究数据库,然后通过对e CRF涉及个人隐私的字段进行脱敏和加密技术处理,最终生成一个匿名化的临床研究数据库,并与多中心临床研究数据管理系统对接,实现真正的电子数据捕获(electronic data capture,EDC)。
4.7 全流程元数据记录的保存
整个过程的所有操作都会被记录以确保数据稽查轨迹的完整性和可追溯性。此外,需要做好各种文档的记录,比如在采集工具使用前需要提供软件测试和系统验证文档等。
5、医院回顾性数据质量挑战与前瞻性数据收集策略
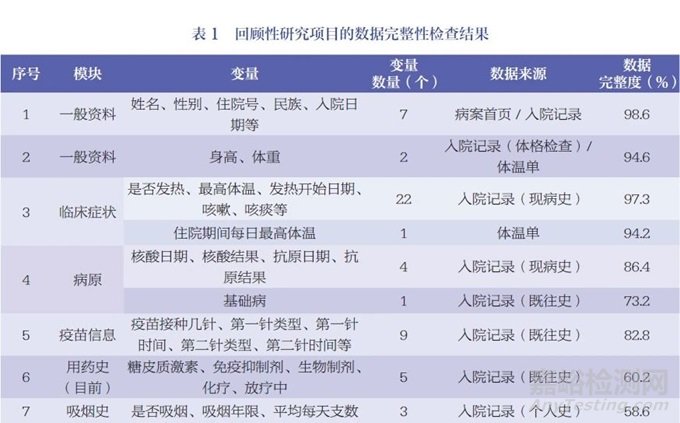
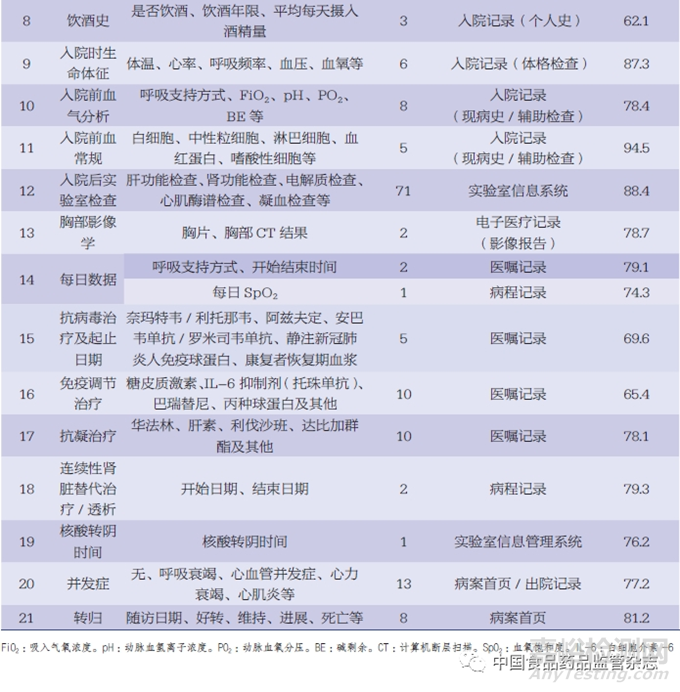
以新型冠状病毒感染(COVID-19)相关研究项目进行举例,基于前文所述ESDR的工作流程,研究团队在某医院的回顾性研究项目中部署了ESR工具,以检查该项目的数据完整性(表1)。其中,模块的内容通常不是固定的,不同的研究项目可能会有不同的模块和变量,其主要根据研究需要而进行设计。每个研究项目可能会定义不同的模块内容,以确保收集和记录与研究问题相关的数据。
由于回顾性研究的局限性,数据采集过程中可能遇到诸多数据质量问题,如数据缺失、重复、唯一标识缺失等。回顾性研究项目中大部分数据的采集来自于院内诊疗系统,而在数据采集及治理的过程中可能遇到的较大问题和挑战主要体现在5个方面:(1)数据的完整性不高。一方面由于医院信息系统(hospital information system,HIS)相对独立,信息化水平不一致,区域卫生信息中心平台覆盖不全;另一方面由于部分医疗机构追求诊断效率,导致HIS使用不完全或业务未开展,仍主要采用回顾性填写临床病历的方式,从而造成数据不完整。(2)数据的标准化程度不够高。在实际临床工作中,医务人员在使用HIS时,出于对诊疗效率和诊疗精确度的考虑,对标准化术语、名称等的使用不够规范。(3)数据的准确度不够高。由于大部分HIS的自动化程度低,医务人员在诊疗过程中需要手动录入数据,可能出现原始数据错漏、不完整等问题。(4)数据的整合性欠缺。缺乏统一的元数据标准,数据整合存在困难;缺乏对主数据的统一管理,对患者或医生医疗过程中的核心数据实体难以进行唯一标识,因而无法实时更新;大量数据以文本、图像、影像等非结构化的形式存储等。多种因素使得数据后续整合与分析的难度增加。(5)数据的一致性较差。一方面由于现有的医疗数据标准尚未完全统一,健康医疗信息领域市场巨大,医疗信息化厂商多,导致异构数据源产出的健康医疗数据标准不一致;其次,同一医疗机构内部不同治疗阶段的数据存在前后不一致的问题,这可能是由于数据记录方式、采集时间点和指标统计方法的不一致所致。
院内业务诊疗数据作为医疗行业重要的信息资源,是临床研究的重要数据支撑。对于回顾性研究而言,数据质量将直接影响研究的最终结果输出。由于难以通过有效的方式进行数据补充,只能利用研究病例的数量范围进行筛选,整体过程有一定的局限性及倾向性。同时,针对这些回顾性数据,如何对其进行高效的治理、如何充分发挥其价值作用,已成为目前医疗信息研究过程中考虑的关键步骤。
考虑到回顾性研究数据来源范围的缺陷,一项真实世界数据研究方案设计中根据Qb D理念,在前瞻性研究中通过使用研究型病历补充采集及患者随访上报等方式对回顾性研究中缺失的数据进行了完善。前瞻性研究可根据研究方案的要求,对项目所需的数据内容实现灵活配置,从而最大可能地采集临床研究数据。源数据采集的方式也会根据数据的来源不同,实现不同的技术匹配。对健康医疗大数据而言,因大部分数据存储在诊疗业务系统中,需要通过协调相应的厂商或信息科开放相应的接口,通过接口对接的方式进行数据采集;对于无法采集或者完整度较低的数据,可通过设计临床研究补充病历进行采集,生成临床研究电子采集病历的电子纸张,研究者通过手动填写、语音录入、OCR识别、外挂链接获取等多种方式,实现此部分的数据采集;而对于院外研究数据,需要分析其数据承载的载体类型,若为手机应用程序、小程序等信息化载体,也可通过接口对接的方式获取,而如果该数据的存储载体为某项硬件或者其他,则需要具体问题具体分析。
6、基于ESDR的真实世界数据研究项目实践
在乐城先行区开展的某医疗器械RWD研究项目中的ESDR涵盖了院内数据、院内补充数据和院外随访数据,适用于监管机构到医疗机构进行现场审核查验,以验证RWD的临床相关性、数据准确性、系统合规性和质量控制措施等,增强真实世界研究的科学性、数据可追溯性和患者数据隐私保护。
6.1 系统部署
为确保系统的安全性并满足平台要求,研究人员采用了医院内部的纯内网解决方案,即将服务器部署在医院内网中,并引入一台前置机用于执行接口程序。研究人员还提供了原始数据源,并附上了数据来源、采集方法确认文件以及项目性能确认(performance qualification,PQ)文档,以验证数据采集方式的适用性。这些措施确保了系统数据来源的完整性和可靠性,有助于提高研究的准确性和可信度。
由于研究涉及真实世界的医疗数据,系统在部署前已存在一些回顾性的医疗数据。在成功与医院内部业务系统(包括电子病历、实验室信息系统和心电系统等)对接后,系统自动采集了患者在医院内部系统中的诊疗数据,研究人员可以通过比较自动提取的数据与人工录入数据的准确性来进行验证。对于影像类型的数据,如核磁共振图像和手术过程视频,系统支持将这些影像上传,以供后续的量表评分和分析。
此外,对于医院外部的数据,特别是以纸质形式记录的量表数据,研究人员可通过扫描的方式将其集成到系统中,并自动填入e CRF。对于院外的随访数据,包括录音和视频等音视频数据,也可上传到系统中,以支持数据的追溯和维护。
6.2 数据采集过程的质量控制
数据采集过程的质量控制包括6个方面:(1)检查研究者文件夹,确认伦理批件包含与系统使用相关的信息。系统搭建工程师提供药物临床试验质量管理规范(good clinical practice,GCP)培训证书和《健康保险流通与责任法案》(Health Insurance Portability and Accountability Act,HIPAA)合规性培训证书,项目组成员提供系统使用的培训记录。系统操作手册和系统3Q验证[安装验证(installation qualification,IQ)、操作验证(operation qualification,OQ)以及性能验证(performance qualification,PQ)服务]文档完整。(2)通过询问项目组成员,了解到其通过独立账户和密码访问系统,各账户角色由权限中心管理员统一分配,登录信息和角色更新可在系统后台查看,确保各角色的模块、权限和项目与任务授权表一致。(3)核查系统数据库,仅保留患者住院ID和姓氏的部分信息,例如“ID304503,王”。(4)验证源数据的来源和采集方法,核查源数据的采集时间满足研究要求。(5)验证系统提取的数据与患者的检验报告源文件的一致性,系统抓取的数据完整度在97.1%~100.0%范围内,精确度在91.4%~100.0%范围内。(6)对上传到系统的手术跟台视频和核磁共振图像的源文件进行验证,核查软骨修复组织的磁共振观察评分(magnetic resonance observation of cartilage repair tissue,MOCART)的溯源记录完整。
7、基于ESDR工作目标场景需求进行审核查验的关注要点
根据数据监管的工作目标,数据的审核查验包括从源数据产生到形成最终研究数据库的整个过程。从数据层面来看,该过程主要目的是核实申报提交数据采集方式的适用性、数据的真实性、与源数据的一致性以及数据获取过程的合规性和质量控制情况。
ESDR的工作目标场景主要是用于适应多源数据,特别是电子源数据的采集、整合和输出,下面对该目标工作场景下需关注的审核要点及路径进行阐述。
7.1 数据采集方式的适用性
在数据采集之前确认目标数据采集的方法符合实际应用场景,数据从采集到形成研究数据库全流程性能完好。需提供源数据来源、采集方法确认文件和PQ文档。
7.2 数据采集过程的合规性
数据采集过程的合规性主要包括数据安全、数据隐私保护和伦理合规性等。其中,数据安全涵盖数据采集、传输、存储的各个环节,如数据有无访问权限设置、加密保护、防火墙设置、数据存储和容灾备份措施等;数据的隐私保护,关注数据的脱敏措施和实施结果,如研究数据库中有无出现可识别身份的个人信息等;在研究实施前的伦理审批过程中,应涵盖对数据安全和隐私保护的相关内容,伦理获批后才能正式开展研究。
7.3 人员的资质和培训要求
ESDR工作流程涉及多个环节和多个操作者,需关注操作者是否具有相应技术工作的资质和能力,包括系统构建者是否具有相应资质证书,例如HIPAA合规性培训证书、GCP培训证书;系统使用者是否接受过相应的培训,需提供培训记录,确保其能理解并严格遵守操作规范等。
7.4 数据采集过程的质量保证体系
对质量保证体系构建进行整体评估,有无指导质量控制过程的标准操作流程、人员管理制度、系统操作手册,采用数据系统是否经过测试和验证,系统3Q验证文档是否完整等。
7.5 数据治理各阶段的审核要点
7.5.1 源数据提取过程
源数据提取过程主要需关注数据提取的完整性和准确性,可通过该阶段的系统质控报告结合实际提取结果进行验证。
源数据提取包含入组人群筛选和指标数据筛选两个方面,源数据提取过程需要与方案以及数据治理计划进行比对,确保一致性。
入组人群筛选主要审核是否依据纳入排除标准进行筛选,包括人口学信息范围,如年龄段、性别;适应症的诊断;排除的合并疾病等。要特别注意是否在事先定义的筛选指标范围内。
指标数据筛选是否从事先定义的源数据来源(如出院诊断、医嘱记录等)中按照既定要求(如访视窗范围等)进行筛选和提取。
7.5.2 数据清洗和转换过程
结合数据治理计划,审核数据清洗、去重和质量控制的过程中有无相应测试和验证的系统质控报告。
测试和验证系统质控报告检查工作中需重点关注:(1)数据清洗转换流程。审核查验数据清洗转换过程中所采用的算法、规则和方法是否合理,是否能够保证数据的完整性和一致性。若存在异常值或缺失数据和重复记录,提醒研究者进行检查或更正。(2)数据整合的可靠性。审查数据加载过程,确保多源数据的提取、转换和加载过程的正确性和可靠性。在涉及外源数据输入整合时,需关注数据传输协议内容及数据链接的一致性比对是否按规定和标准执行。
7.5.3 数据输出过程
数据输出过程主要关注:(1)审核数据准确性、完整性和一致性。核对关键指标是否按数据提取计划完整、准确地进行了提取,包括变量和变量值两个方面;数据缺失情况是否满足预设要求,缺失比例和缺失机制是否与报告一致。根据需求抽查部分数据,结合稽查轨迹进行数据溯源,比对与核证副本数据以及源数据的一致性。(2)审核数据传输时间。是否符合工作节点要求,比如是否发生了解锁,如果是,是否有合理的解锁原因。(3)数据传输过程有无加密,各账户角色的权限设置。
8、展 望
随着科技的不断进步和临床研究的不断发展,ESR技术有望成为临床研究的重要趋势和实践标准。采用ESR技术将大幅提高临床研究的效率和数据质量,促进药物研发和医疗器械创新的进展。ESR技术将完善个人信息保护技术应用,为基于研究项目的源数据提取方案提供支持,并进一步完善未来去中心化临床研究所需的远程监查技术的实施模式。在收集RWD方面,最优选的采集模式是在回顾性研究结果的基础上进一步设计前瞻性研究项目进行采集,该方法能够显著提升数据的完整性与准确性。通过在临床试验项目中应用电子源数据管理,可以遵循最新的ICH E6(R3)指南,确保临床试验的设计能够充分保障参与者的权益、安全和健康。同时,这也有助于确保试验结果的可靠性,实施Qb D理念,保障临床试验过程中的实施流程和风险管理策略与所收集数据的重要性相匹配,使试验参与者的安全性和数据可靠性的风险得到妥善应对。研究团队将通过进一步探索和创新来推动基于ESDR研究模式在临床RWD研究中的应用,为临床研究的质量和效率提升贡献更多的典型案例和解决方案。同时,研究团队与监管机构的紧密合作将推动电子源数据管理的发展和创新,辅助监管机构更好地对临床研究进行审核和查验。
引用本文
姚晨,王斌,朱赛楠,郑姣,赖俊恺,朱欢,丁月琴.基于真实世界研究项目电子源数据存储库的审核查验路径和要点研究[J].中国食品药品监管,2023(10):68-80.