今日头条
艾威眼科新药结膜炎Ⅱ期临床积极。艾威药业采用独特i-Gel原位凝胶技术开发的缓释聚维酮碘滴眼液IVIEW-1201(1.0%聚维酮碘眼用凝胶无菌溶液)在中国开展的急性细菌性结膜炎Ⅱ期临床达到主要终点指标。与氧氟沙星滴眼液阳性对照组相比,IVIEW-1201治疗组的临床治愈率高9.4%;两组对于目标革兰氏阳性致病菌的清除率相同,对革兰氏阴性致病菌的清除率亦相同。此外,药物耐受性良好。
国内药讯
1.恒瑞口服降糖三合一复方报产。恒瑞旗下山东盛迪开发的固定剂量三方制剂HR20031片(恒格列净+磷酸瑞格列汀+二甲双胍)的上市申请获CDE受理,用于治疗经二甲双胍治疗后血糖仍控制不佳的2型糖尿病患者。HR20031旨在通过三种不同作用机制达到降血糖作用,拟每日1次口服改善此类患者的血糖控制。该产品为缓释制剂,预期能够提高患者的治疗依从性。
2.康哲儿童用熊去氧胆酸拟纳入优先审评。康哲生物申报的「熊去氧胆酸口服混悬液」获CDE以“符合儿童生理特征的儿童用药品新品种、剂型和规格”为由拟纳入优先审评,用于治疗胆囊胆固醇结石、胆汁淤积性肝病(如原发性胆汁性肝硬化)、胆汁反流性胃炎。熊去氧胆酸由Dr. Falk Pharma生产,包含片剂、胶囊、口服混悬剂等剂型,康哲药业此前已在国内独家代理熊去氧胆酸胶囊(商品名为优思弗)。
3.康诺亚IL-4Rα单抗拟纳入优先审评。康诺亚旗下康诺行生物的IL-4Rα抗体司普奇拜单抗注射液(stapokibart,CM310)获CDE拟纳入优先审评,用于治疗外用药控制不佳或不适合外用药治疗的成人中重度特应性皮炎。CM310通过靶向IL-4Rα来双重阻断白介素4(IL-4)及白介素13(IL-13)的信号传导。康诺亚还同步开展CM310用于治疗慢性鼻窦炎伴鼻息肉、过敏性鼻炎、哮喘等适应症的临床研究。
4.艾迪艾滋病三合一复方拟纳入优先审评。艾迪药业抗HIV感染新药艾诺米替片(艾诺韦林/拉米夫定/富马酸替诺福韦二吡呋酯)获CDE拟纳入优先审评,用于作为完整治疗方案用于以下两类对该品任一成分无已知耐药相关突变的1型人类免疫缺陷病毒HIV-1感染成人患者:(1)无抗逆转录病毒治疗史的患者;(2)作为替代治疗方案,用于接受稳定抗逆转录病毒治疗达到病毒学抑制(HIV-1 RNA<50拷贝/mL)且无治疗失败史的患者。
5.博锐CD3/HER2/HER2三抗报IND。博锐生物与恩沐生物联合开发的三特异抗体BR115(CMG6A19)的临床试验申请获CDE受理。BR115是恩沐生物基于其TRIAD多功能抗体平台开发的、针对实体肿瘤的T细胞介导三特异抗体,可同时靶向CD3和HER2不同表位,具有更好的肿瘤特异性,同时可以更好地针对TAA突变引起的肿瘤逃逸。博锐拥有CMG6A19在大中华地区开发、生产以及商业化权益。
国际药讯
1.司美格鲁肽预防心血管事件III期研究见刊NEJM。诺和诺德每周一次、GLP-1激动剂司美格鲁肽2.4mg(Wegovy)用于预防超重或肥胖合并心血管疾病且不伴糖尿病的患者主要不良心血管事件(MACE)风险的III期SELECT研究详细结果发表在《新英格兰医学杂志》上。与安慰剂相比,司美格鲁肽5年期间将患者MACE风险显著降低20%(HR:0.80;95%Cl:0.72;0.90,p<0.001),无论年龄、性别、种族和起始BMI如何,MACE风险都能降低。Wegovy标签更新的补充申请目前正接受FDA优先审评。
2.Madrigal公司THR-β激动剂Ⅲ期临床积极。Madrigal公司口服选择性甲状腺激素受体(THR)-β激动剂resmetirom治疗非酒精性脂肪性肝炎(NASH)的Ⅲ期MAESTRO-NASH试验最新结果积极。此前,该试验已达到原发性肝活检终点和降低低密度脂蛋白胆固醇的关键次要终点。最新数据显示,resmetirom(100mg)治疗组有超过70%的患者达成≥30%的磁共振成像-质子密度脂肪分数(MRI-PDFF)缓解,MRI-PDFF总体中位降低率为52%。目前,resmetirom正接受FDA的监管审查,PDUFA日期为明年3月。
3.阿斯利康PD-L1单抗肝癌III期临床积极。阿斯利康PD-L1抑制剂Imfinzi(度伐利尤单抗)与动脉化疗栓塞(TACE)和贝伐珠单抗联合治疗肝细胞癌(HCC)患者的III期EMERALD-1研究达到主要终点。与TACE单独治疗相比,Imfinzi联合治疗显著提高患者无进展生存期(PFS)。Imfinzi有潜力为早期肝癌患者带来免疫治疗选择。详细数据将在即将召开的医学会议公布。
4.癌症免疫三联疗法Ⅱ期临床积极。PDS Biotechnology公司人乳头瘤病毒(HPV)靶向免疫疗法PDS0101与IL-12靶向ADC药物PDS0301、以及免疫检查点抑制剂(ICI)构成的三联疗法,在治疗HPV-16阳性晚期癌症的Ⅱ期临床获积极结果。在ICI初治组中,三联疗法三年期生存率达到75%,中位总生存期(OS)尚未达到;在ICI经治组中,三联疗法一年总生存率为72%,中位OS约为20个月,而历史数据中,这类患者的中位OS仅为3.4个月。
5.DPP8/9靶向免疫激活剂Ⅱ期临床积极。BioXcel公司靶向DPP8/9的口服先天性免疫激活剂BXCL701联合PD-1抑制剂Keytruda(pembrolizumab)治疗转移性去势抵抗性前列腺癌(mCRPC)的Ⅱ期试验结果积极。在可评估腺癌患者中,BXCL701联合治疗的中位OS为15.5个月(95%CI:9.6–不可评估),1年期生存率为59%;中位PFS为4.2个月。联合治疗显示出可接受的耐受性。该公司计划尽快与FDA讨论BXCL701的Ⅱ期临床开发。
6.礼来GLP-1R/GCGR激动剂启动减重Ⅱ期临床。礼来GLP-1R/GCGR双激动剂LY3305677(玛仕度肽)在Clinicaltrials.gov网站上注册一项Ⅱ期临床,拟评估LY3305677与安慰剂相比,在肥胖或超重的成年受试者中进行体重管理的有效性和安全性。这项研究将持续约62周。在中国,信达生物已将玛仕度肽(IBI362)的糖尿病、减重适应症的开发推进至Ⅲ期临床阶段,预期明年初将递交IBI362(6mg)减重适应症上市申请。
医药热点
1.中南大学湘雅医学院新增两所附属医院。11月10日,中南大学与湖南省卫健委签署合作协议,商定共建中南大学湘雅医学院附属肿瘤医院、儿童医院。湖南省卫健委、湖南省肿瘤医院、湖南省儿童医院、中南大学湘雅医学院等相关负责人参加签约仪式。未来,中南大学将围绕“双一流”大学附属医院建设要求,推动中南大学湘雅医学院与湖南省儿童医院,以及与湖南省肿瘤医院在医疗服务、科研创新、人才培养、学科建设等方面展开深入合作。
2.河南首家帕金森病神经内外科联合门诊开诊。郑州大学第一附属医院帕金森病神经内外科联合门诊在东院区国际医学部正式开诊,这是河南省首家帕金森病神经内外科联合门诊,旨在为帕金森病患者提供专业化、精细化、个体化的一站式诊疗服务。该门诊特色诊疗项目包括:早期准确诊断帕金森病;帕金森病的规范化药物治疗;脑起搏器手术治疗帕金森病的术前评估;脑起搏器置入术后药物调整和神经调控等。
3.我国首次成功构建胚胎干细胞嵌合体猴。中国科学院脑科学与智能技术卓越创新中心和广州生物医药与健康研究院等科研团队合作,通过优化改进嵌合胚胎的培养条件,显著提升了胚胎干细胞注入胚胎后的存活效率,最终得到了出生存活的高比例胚胎干细胞来源的嵌合体猴,证明了注入的猴胚胎干细胞可以高效的贡献到包括胎盘和生殖细胞在内的各种不同组织和细胞。该研究对于理解灵长类胚胎干细胞全能性和发育潜能具有重要意义,研究成果11月9日晚在国际学术期刊《细胞》以封面文章发表。
评审动态
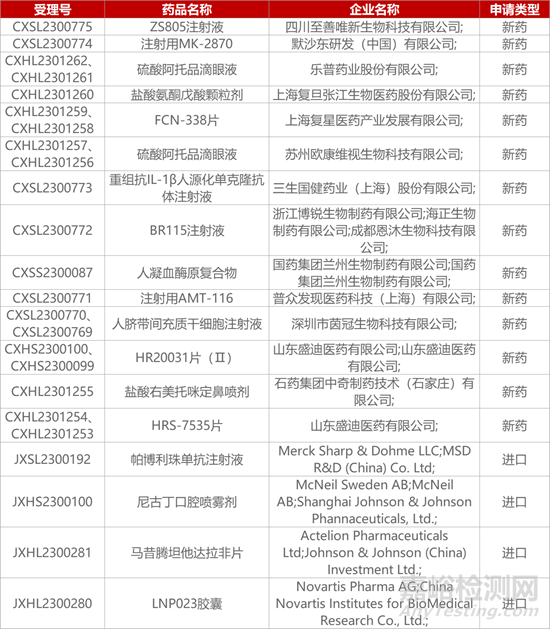
1. CDE新药受理情况(11月12日)
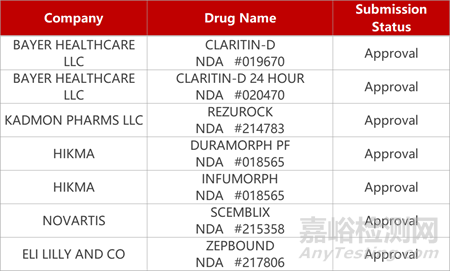
2. FDA新药获批情况(北美11月11日)