摘要
目的:了解我国儿童专用药品(化学药品与生物制品)中药品说明书的标注情况及存在问题,为促进儿童用药信息的完善提供参考。
方法:对儿童专用药品进行汇总,并依据药品说明书进行信息表的填写与统计,分析儿童专用药品说明书存在的问题。
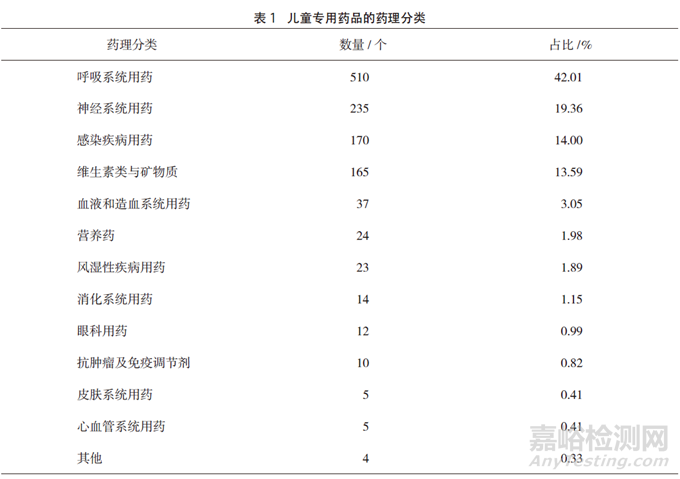
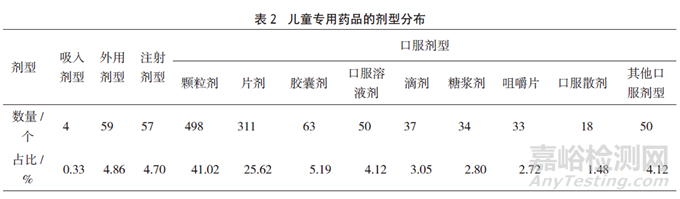
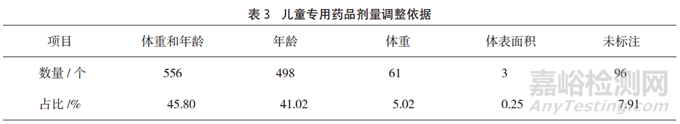
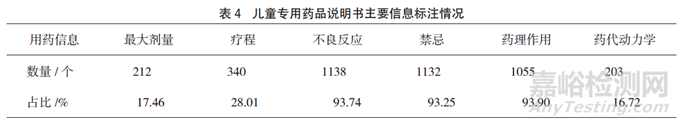
结果:共收集到儿童专用药品说明书1214份,其中国产药品1180个(占97.20%),进口药品34个(占2.80%);儿童专用药品数量最多的为呼吸系统用药(占42.01%);儿童专用药品口服剂型1094个(占90.11%),注射剂型57个(占4.70%),外用剂型59个(占4.86%),吸入剂型4个(占0.33%);说明书中标注的剂量调整依据主要为年龄和体重(占45.80%),只依据年龄进行剂量调整的占41.02%,而7.91%的药品未标注剂量调整依据;说明书中标有儿童用药最大剂量的占17.46%,标有儿童用药疗程的占28.01%,而标有儿童药代动力学的仅有16.72%。
结论:我国儿童专用药品说明书存在标签撰写不规范、内容不完善、同一品规药品说明书差异大等问题,建议相关部门加强药品说明书的规范和管理,加大上市后的监管和数据监查,督促药品生产企业对儿童专用药品说明书中的内容进行完善与改进,提高儿童合理用药水平。
儿童健康是衡量一个国家卫生保健水平的重要指标之一,保障儿童基本用药需求,促进儿童用药安全合理使用,对于防治儿童疾病、提升儿童健康水平具有重要意义。儿童在生理特点和病理特点上与成人有很大的不同,是高用药风险和重点监控人群之一。由于我国相对缺少适宜儿童的药物,儿童专用剂型少、规格少、品种匮乏[1],人们常通过减量使用成人药物的办法治疗儿童疾病,导致儿童用药的风险明显增加;而由于临床试验难度大、儿童用药量少、获利低、剂型使用困难等诸多原因造成了企业研发动力不足,使得儿童用药经常面临无药可用或者超说明书用药的情况[2-4]。本研究以我国儿童专用化学药品与生物制品作为研究对象,通过梳理现有已批准上市的儿童专用药品目录,收集整理说明书并对其中的儿童用药信息进行调查分析,了解儿童专用药品中药品说明书的标注情况,分析我国儿童专用药品及说明书存在的问题并提出建议,为进一步规范儿童专用药品说明书的内容和促进儿童用药信息的完善提供参考,促进儿童合理用药,保障儿童用药安全。
一、资料与方法
1.1 资料来源
中国儿童用药数据库是由中国医药工业信息中心推出,我国首个针对儿童用药的数据库,覆盖政策、研发、上市、临床用药,可查询国内所有儿童用药的上市信息,为解决儿童药临床需求、提高用药可及性助力。通过中国儿童用药数据库对分类为儿童专用药的品种进行筛选,导出儿童专用药品(化学药品与生物制品),与国家药品监督管理局相关药品进行信息核对,参考美康合理用药支持系统、丁香园用药助手及药智数据等最新说明书信息,生成儿童专用药品目录。
1.2 收集方法
1.2.1
参考《中国国家处方集(第2版)》《英国国家处方集(儿童版)》(2016-2017版)对儿童专用药品进行分类,并依据最新药品说明书进行信息表的填写与统计,分析儿童专用药品说明书存在的问题。
1.2.2
依据所收集药品说明书中对于剂型的表述,将所有药品分为口服剂型、注射剂型、吸入剂型和外用剂型4大类,分别进行统计。其中口服剂型表述包括片剂、丸剂、胶囊剂、口服散剂、咀嚼片、颗粒剂、混悬滴剂、口服混悬剂、分散片、口服乳剂、滴剂、干混悬剂、口服凝胶剂、口服溶液剂、泡腾颗粒剂、糖浆剂、口服锭剂、口腔崩解片、口腔膜剂;注射剂型表述包含注射剂、注射液、冻干粉针剂、粉针剂、注射用混悬液、注射用无菌粉末、注射用乳剂;吸入剂型表述包含吸入用混悬液、喷鼻剂;外用剂型表述包含栓剂、灌肠剂、滴眼剂、滴鼻剂、外用散剂。
1.3 相关术语介绍
1.3.1
儿童:系指18岁以下的任何人,除非对其适用之法律规定成年年龄低于18岁。
1.3.2
儿童专用药:药品说明书里仅有儿童使用说明,无成人用药说明,有明确的儿童适应证和儿童用法用量,以及儿童用药相关的安全性信息。
二、结果
共收集到儿童专用药品说明书1214份,其中国产药品1180个,占97.20%,进口药品34个,占2.80%。对药品属性及说明书内容进行汇总分析。
2.1 儿童专用药品药理属性分布
依据药理作用分为13类常见疾病用药,其中数量最多的为呼吸系统用药,占42.01%,主要包括咳嗽及感冒类药品;其次为神经系统用药、感染疾病用药、维生素类与矿物质,具体分类见表1。
2.2 儿童专用药品剂型分布
对儿童专用药品剂型进行分类汇总,吸入剂型4个(占0.33%),外用剂型59个(占4.86%),包括栓剂、滴眼剂、灌肠剂等;注射剂型57个(占4.70%);口服剂型1094个(占90.11%),主要为颗粒剂、片剂、胶囊剂、口服溶液剂等,具体分类见表2。
2.3 儿童专用药品剂量调整依据
儿童专用药品说明书剂量调整依据主要为年龄及体重,其中以年龄和体重作为剂量调整依据的占45.80%,只依据年龄进行剂量调整的占41.02%,而7.91%的药品未标注剂量调整依据(见表3)。
2.4 儿童专用药品说明书信息标注情况
对儿童专用药品说明书中是否标明有儿童用药最大剂量、儿童用药疗程、不良反应、禁忌、药理作用、药代动力学等6项说明书用药相关信息进行统计分析,标有儿童用药最大剂量的占17.46%,标有儿童用药疗程的占28.01%,标有儿童药代动力学信息的说明书仅占16.72%(见表4)。
三、讨论
通过调查发现,我国儿童专用药品以呼吸系统用药为主,颗粒剂、片剂等口服制剂为药品主要的剂型。依据体表面积调整儿童用药剂量是世界卫生组织提倡的较为科学的方法,但由于其计算方法复杂,可操作性差,目前在药品说明书中标注率较低,部分药品未标注儿童用药剂量调整依据,剂量调整缺乏指导标准,给临床用药带来不便。部分儿童专用药品说明书存在问题需要修订完善,药品说明书和标签撰写不规范、不合理可能给医护人员和患者使用带来困扰,甚至为临床使用引入风险[5-7]。通过汇总分析儿童专用药品说明书及标签中药学信息方面存在的问题,为相关政策的制定提供支持,从而指导企业规范撰写说明书及标签中药学相关信息,为患儿科学用药提供依据。
3.1 说明书用语不规范
药品说明书中儿科人群指代用词不规范。部分说明书存在标注“小儿”等年龄段含糊不清的字句,但国内外均没有对“小儿”的年龄进行定义,另外,部分非处方药(Over-The-Counter Drug,OTC)使用“婴儿”“幼儿”“小儿”等字样进行标注,家长无法明确区分具体的适用年龄,增加了儿童用药风险,如维B1乳酸钙片,“适应证”表述为“适用于小儿佝偻病、软骨病及发育不良”。因此,规范药品说明书用语,需要对儿童适用年龄进行准确描述,避免歧义,有助于提高医生及患者对药品的认知。
3.2 说明书项目不完整
药品说明书中关于儿童用药的不良反应、注意事项等内容说明较少,且多是“请将药品放于儿童不能接触的地方”“尚不明确”“详情请咨询医师或药师”等语言表述,如复方胃蛋白酶散,“注意事项”表述为“尚不明确”,缺乏临床意义,实用性较差。
部分非处方药说明书缺乏对辅料项的说明。如某厂家“甘草锌胶囊”为甲类OTC药品,无辅料标注,依据《药品说明书和标签管理规定》,非处方药应当列出所用的全部辅料名称。同时,药品处方中含有可能引起严重不良反应的成分或者辅料的,应当予以说明。
部分说明书缺乏核准日期或修改日期。如某厂家“对乙酰氨基酚颗粒”,无说明书核准日期与修改日期标注,依据《关于印发化学药品和生物制品说明书规范细则的通知》,核准日期为国家药品监督管理局批准该药品注册的时间。修改日期为此后历次修改的时间。核准和修改日期应当印制在说明书首页左上角。修改日期位于核准日期下方,按时间顺序逐行书写。
3.3 说明书标注不统一
说明书内容前后叙述不统一,例如适应证表述的适用人群或适用年龄与用法用量项不一致,如盐酸托莫西汀胶囊“适应证”适用人群表述为儿童和青少年,而“用法用量”适用人群为儿童、青少年和成人;或存在药品名称包含“小儿”“儿童”等儿童专用药品字眼,但药品说明书内容为成人儿童共用药,如小儿硫酸庆大霉素颗粒,“用法用量”为儿童与成人共用。
复方制剂规格表述形式不统一。如小儿硫酸亚铁糖浆,“规格”表述有“复方”“1mL:40mg”“每支装10mL”“10mL/支”“每mL含硫酸亚铁40mg,枸橼酸2.1mg”等多种形式,不便于临床应用,建议对该项内容进行规范统一。
3.4 同一品规药品的差异性
同一品规不同厂家说明书药品性状、适应证、用法用量、不良反应、禁忌、相互作用、贮藏甚至OTC分类都存在差异,如美敏伪麻口服溶液,部分厂家的药品说明书标为儿童专用,而另有部分厂家药品说明书标为成人儿童共用;15mL规格的布洛芬混悬滴剂,有些产品说明书标注为甲类OTC,而有些为非OTC用药。
同一成分规格的药品说明书,药品通用名不同;或相同通用名的药品,说明书成分不同。如成分规格同为“磺胺嘧啶0.4g,甲氧苄啶50mg”的药品名称有“小儿双嘧啶片”与“复方磺胺嘧啶片”2个,而“小儿复方磺胺嘧啶散”组成成分有“磺胺甲恶唑0.1g,甲氧苄啶20mg”与“磺胺嘧啶0.15g,磺胺脒0.1g,碳酸氢钠0.1g”2种。根据《中国药品通用名称命名原则》,药品命名必须遵循一药一名原则。药品名称应科学、明确、简短,词干已确定的译名应尽量采用,使同类药品能体现系统性。
3.5 说明书内容不精准
我国儿童药品说明书中主要是参照儿童年龄、体重来确定用药剂量,随着生活水平的提高,儿童的发育超过预期的情况越来越普遍,导致用药剂量不够准确。按体表面积计算虽然计算方法较为复杂,但科学性强,而我国儿童用药依据体表面积计算种类较少,建议优化儿童用药剂量的计算方法。
药品的用药指导不详细准确,不利于提高儿童用药依从性。说明书中针对1岁以下儿童只说明“口服”过于笼统,应进行更详细的用药指导,如送服液体可使用乳汁、牛奶或开水等,用药时间建议注明“饭前15~30分钟”“饭后半小时”等较为详细的信息。
四、结论
儿童是特殊用药人群,具有明显区别于成人的生理病理特点,对药物的敏感性较强[8],药品说明书中的不合理标注在一定程度上增加了儿童临床合理用药的风险[9-12]。针对说明书中存在的问题,建议相关部门加强药品说明书的规范制定和管理,发布国内说明书可读性指导原则,以期达到内容全面、表达清晰、用语准确、通俗易懂;加强药物临床研究和监测,加大上市后的监管和数据监查,督促药品生产企业对儿童专用药品说明书中的内容进行完善与改进,保证说明书项目的完整性、内容的准确性与规范性,以促进儿童药物的合理使用[13-16]。同时通过不断完善中国儿童专用药品数据库,统一动态管理系统平台,进一步优化药品说明书的管理;以中国儿童专用药品数据库为基础,发挥政府及医疗机构各自优势,引导企业修订,补充完善儿童专用药品信息,全面掌握儿童专用药品情况[17]。为保障儿童基本用药需求,促进儿童用药安全、科学、合理使用,近年来国家出台了多项政策,对提升儿童健康水平具有重要意义。《国家药品安全“十二五”规划》《关于保障儿童用药的若干意见》《国家卫生计生委办公厅关于进一步加强医疗机构儿童用药配备使用工作的通知》《首批鼓励研发申报儿童药品清单》《国家基本药物目录管理办法(修订草案)》等相关政策文件的出台,提出了鼓励儿童适宜剂型研发、补充完善药品说明书儿童用药数据、加快申报审批适宜儿童使用的品种、依据儿童专用适用药分类制定儿童基本药品目录等,为企业在儿童药品的生产研发、医疗机构在儿童药品的配备使用及政府部门在儿童药品的审批监管等方面提供了方向,促进儿童用药信息的完善[18-20]。
参考文献
[1] 陈敬,魏国旭,柏林,等. 我国儿童用药立法的必要性和可行性研究[J]. 中国药事,2020,34(7):737-743.
[2] 吴娟,张顺国,黄诗颖,等. 儿童药物临床试验的发展及现状[J]. 医药导报,2018,37(1):74-77.
[3] 吴文文,王珊珊,李曼,等. 儿科超说明书用药现状与对策分析[J]. 药物流行病学杂志,2019,28(6):418-422.
[4] 王雪韵,苏巍巍,丁宏,等. 我国儿童药品在临床使用中存在的问题及对策分析[J]. 中国药房,2019,30(2):149-153.
[5] 阚淑月,于庆坤,王慧丽,等. 药品说明书中儿童用药信息标注情况与儿童用药风险[J]. 中国医院药学杂志,2016,36(20):1801-1804.
[6] 马骏威,任连杰. 药品说明书中儿童用法用量药学信息的撰写与思考[J]. 中国医药工业杂志,2022,53(11):1583-1587.
[7] 郭志烨,李玲玲,褚智君,等. 某院门诊儿童常用药品说明书中儿童用药信息标注情况调查分析[J]. 儿科药学杂志,2022,28(6):33-37.
[8] 李宵,丁琮洋,赵越,等. 基于评价数据库探索易致重度不良反应药品的儿童用药安全性[J]. 中国现代应用药学,2022,39(12):1604-1613.
[9] 闫聪聪,王晓玲,张胜男,等. 国内8家儿童医院常用药品说明书中儿童用药信息的调查分析[J]. 中国药事,2021,35(1):10-15.
[10] 刘婷,余静洁. 某院儿科门诊超说明书用药调查与分析[J]. 儿科药学杂志,2022,28(5):25-28.
[11] 方思晓,王一博. 药品说明书在儿科临床用药中的应用分析[J]. 中国药物滥用防治杂志,2021,27(6):944-947.
[12] 许淑红,张绮,张林琦,等. 探讨我国儿科用药的发展现状及政策层面的思考[J]. 中国临床药理学杂志,2020,36(12):1760-1767.
[13] 赵婷婷,赵建中,王海学. 关于规范国内已上市药品说明书的几点思考[J]. 中国临床药理学杂志,2020,36(14):2153-2155.
[14] 王雅君,韩容,岳志华,等. 美国儿童药品上市审批情况分析及其对我国儿童用药保障工作的启示[J]. 中国药房,2021,32(2):133-138.
[15] 刘涓,任连杰.《儿童用药(化学药品)药学开发指导原则(试行)》解读[J]. 中国新药杂志,2021,30(23):2147-2152.
[16] 李丰杉,余勤. 儿童用药研发及儿科临床试验的国际发展和国内现状[J]. 中国新药杂志,2020,29(17):1933-1938.
[17] 耿莹,张豪,王丽卿,等.《化学药品和治疗用生物制品说明书中儿童用药相关信息撰写的技术指导原则(试行)》起草背景及要点内容[J]. 中国新药杂志,2022,31(4):323-328.
[18] 赵岩松,洪兰,叶桦. 加快我国儿童用药研发的政策与法规分析[J]. 中国药事,2017,31(1):1-6.
[19] 陈慧,苏广全,刘晓,等. 中国医疗机构药品目录管理评价指南[J]. 中国药房,2022,33(6):641-652.
[20] 袁利佳,王丽卿,汪小燕,等. 药品加快上市程序在儿童用药注册体系中的作用与思考[J]. 中国医药工业杂志,2022,53(11):1529-1538