今日头条
劲方CDK9抑制剂Ⅱ期临床积极。劲方医药与SELLAS生命科学集团开发的CDK9抑制剂SLS009(GFH009)联合维奈托克和阿扎胞苷治疗复发/难治性急性髓系白血病的Ⅱa期临床结果积极。共有5例患者接受SLS009(45mg)联合维奈托克和阿扎胞苷治疗,其中首例患者正在接受第5个月的治疗,并获得完全缓解(CR);药物耐受性良好。Ⅱ期推荐剂量SLS009(60mg)组的顶线数据将于年底公布。
国内药讯
1.AZ补体C5抑制剂中国获批治疗NMOSD。阿斯利康补体C5抑制剂依库珠单抗的新适应症获国家药监局批准,用于治疗视神经脊髓炎谱系障碍(NMOSD)。依库珠单抗(Soliris)是全球首款获批的补体抑制剂,通过抑制终端补体来抑制免疫系统的失控性激活。此前,该新药已在国内获批用于治疗阵发性血红蛋白尿(PNH)和非典型溶血性尿毒症综合征(aHUS),以及全身型重症肌无力(gMG) 。
2.轩竹CDK4/6抑制剂新适应症报产。轩竹生物CDK4/6抑制剂1类化药吡罗西尼(birociclib)的上市申请获NMPA受理,单药用于治疗HR+/HER2-的局部晚期或转移性成年乳腺癌经治患者。在临床研究中,吡罗西尼治疗后独立评审委员会(IRC)评估的客观缓解率(ORR)达到30.0%。此前,吡罗西尼单药和联合氟维司群治疗晚期乳腺癌的上市申请均已被受理。
3.海思科外周阿片受体激动剂报产。海思科强效外周Kappa阿片受体激动剂HSK21542注射液的新药申请(NDA)获CDE受理,适应症为“术后镇痛”。HSK21542能够协同调控钾离子流和钙离子流,通过阻断疼痛和瘙痒信号传导并抑制背根神经节和末梢感觉神经的兴奋性,减少炎性因子以及神经递质的释放等,起到抗伤害感受和抑制瘙痒的作用。目前,该产品还被开发用于治疗慢性肾脏疾病相关性瘙痒。
4.君实PD-1单抗两项临床数据积极。君实生物PD-1抑制剂特瑞普利单抗将在ESMO2023大会上公布用于治疗晚期肾癌(RCC)患者的关键Ⅲ期临床(RENOTORCH),以及治疗结外NK/T细胞淋巴瘤(ENKTL)的Ⅱ期临床积极结果。在RENOTORCH试验中,与舒尼替尼相比,特瑞普利单抗联合阿昔替尼显著延长患者无进展生存期(中位PFS:18.0vs9.8个月),疾病进展或死亡风险降低35%(1年PFS率为62.7%vs45.4%);特瑞普利单抗联合治疗耐受性良好。
5.翰森引进激活素A抑制剂获批临床。Keros公司与翰森制药联合开发的配体捕获体新药HS-20106注射液(KER-050)获国家药监局临床许可,拟开发用于治疗各种原因导致的血细胞减少。KER-050是由经修饰的TGF-βR(即激活素受体IIA型)配体结合区域与人源抗体Fc区域融合而成,通过结合并抑制激活素A,来改善骨髓和恢复正常造血功能。翰森制药拥有该产品在中国内地、香港和澳门独家权益。
国际药讯
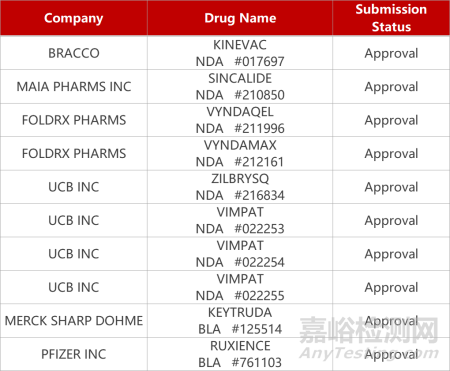
1.优时比重症肌无力新药获批上市。优时比制药新型大环肽类C5补体抑制剂Zilbrysq(zilucoplan)获FDA批准上市,用于治疗抗乙酰胆碱受体(AChR)抗体阳性的全身型重症肌无力(gMG)成年患者。Zilucoplan具有抑制末端补体途径激活和MAC下游组装的双重作用机制。在Ⅲ期RAISE研究,zilucoplan治疗组患者的安慰剂矫正的重症肌无力-日常生活活动能力量表(MG-ADL)总分平均改善2.09分(p<0.001)。
2.口服NHE3抑制剂获批治疗高磷血症。Ardelyx公司口服钠离子转运蛋白NHE3抑制剂Xphozah(tenapanor)获FDA批准新适应症,用于附加治疗接受透析、磷酸盐结合剂治疗效果不佳或不耐受的慢性肾病(CKD)患者的高磷血症。Xphozah旨在通过减少钠离子量的摄取,提高胃肠道细胞中质子的浓度,以达到降低磷酸盐的吸收,从而降低血液中磷酸盐的浓度。今年7月,该新药上述适应症已在中国报产,复星医药拥有该产品的中国权益。
3.诺和诺德启动司美格鲁肽降糖III期临床。诺和诺德口服GLP-1激动剂司美格鲁肽在clinicaltrials.gov网站登记一项III期研究,拟评估与恩格列净或二甲双胍片相比,一线治疗2型糖尿病患者的疗效和安全性。该项研究将持续2年零7周(111周),主要终点为第52周糖化血红蛋白(HbA1c)水平的变化值,次要终点还将评估患者的体重变化情况。
4.罗氏超20亿美元合作开发分子胶。罗氏与Monte Rosa公司将利用后者专有分子胶降解剂平台QuEEN,针对选定的癌症和神经疾病靶点,合作开发创新分子胶降解剂(MGD)。根据协议,Monte Rosa公司将获得5000万美元的前期付款,可能超过20亿美元的临床前、临床期、商业和销售里程碑后期付款。罗氏享有进一步推进化合物的临床前和临床开发工作的选择权。Monte Rosa保留其管线项目的全部权益。
5.赛默飞31亿美元收购蛋白组学公司。Thermo Fisher宣布将启动要约收购程序,收购蛋白组学公司Olink所有普通股和美国存托股票,交易估值约为31亿美元,其中包括约1.43亿美元的净现金。Olink的专利技术Proximity Extension Assay (PEA) 能使用极少量的血清、血浆或几乎任何其他类型的生物样本,在不降低特异性和灵敏度的情况下对蛋白质进行高通量、多重免疫检测。该交易预计将于2024年年中完成。
6.吉利德引进Assembly Bio三款抗病毒药物。吉利德与Assembly Biosciences达成合作协议,引进后者开发的3款抗病毒药物,分别是乙肝药物ABI-4334,抗疱疹病毒药物ABI-5336和丁肝药物ABI-5366。根据协议,Assembly公司将获得8480万美元预付款、1520万美元股权投资、每个项目4500万美元的选择权执行费和每个项目3.3亿美元的监管和商业里程碑款项,以及每个项目7500万美元额外付款,交易总金额14.5亿美元。
7.MASP-2抗体IgA肾病Ⅲ期临床失败。Omeros Corporation公司MASP-2抗体Marsoplimab治疗IgA肾病的Ⅲ期临床ARTEMIS-IGAN未达到主要研究终点。与安慰剂相比,narsoplimab治疗组患者24小时尿蛋白排泄(UPE)评估蛋白尿减少的统计不具显著性;narsoplimab耐受性普遍良好,没有出现任何令人担忧的安全性信号。Omeros表示将终止ARTEMIS-IGAN临床研究,并放弃在美国寻求该产品用于IgA肾病的上市申请。
医药热点
1.广州白云北部新增一家三级综合医院。10月10日,《白云区公共卫生医院地块(AB0109规划管理单元)控制性详细规划》经第四届广州市规划委员会地区规划专业委员会第十三次会议审议通过。根据规划,白云区将按“平急两用”原则,在北部江高镇规划建设一间三级综合医院,即白云区公共卫生医院。医院规划床位1800床,近期建设600床, 平时用作综合医院,遇重大公共突发事件时可立即转换为应急场所。
2.河南省儿童医院增设儿科晚间门诊。10月15日起,河南省儿童医院郑东院区临时增设11个儿科专家晚间门诊,主要服务于以呼吸道疾病为主的内科患儿。11个儿科专家晚间门诊主要设置在普通内科,坐诊时间为17:30-20:30,在晚间门诊开放的同时,医学影像科、检验科、超声科、心电图、药剂科等医技科室也同步运行。
3.勃林格殷格翰大中华区换帅。10月17日,“勃林格殷格翰中国”官微宣布:Mohammed Tawil将于2024年1月1日接替董博文 (Dr.Pavol Dobrocky) ,担任勃林格殷格翰大中华区(中国大陆、香港及台湾地区)总裁兼首席执行官。Mohammed Tawil于1995年加入勃林格殷格翰,成为约旦分公司的医药代表。2020年起至今,担任勃林格殷格翰IMETA大区(印度、中东、土耳其及非洲)总裁、首席执行官及人用药品事业部负责人。
评审动态
1. CDE新药受理情况(10月187日)
2. FDA新药获批情况(北美10月17日)