今日头条
百奥泰IL-6R单抗类似药获FDA批准上市。百奥泰开发的生物类似药IL-6R抗体托珠单抗注射液(BAT1806)获FDA批准上市,商品名为Tofidence,用于治疗类风湿性关节炎、多关节幼年特发性关节炎 (PJIA)和全身型幼年特发性关节炎(SJIA)。Tofidence也是美国获批的首个国产抗体类似药,Biogen拥有BAT1806在除中国(包括香港、澳门和台湾)以外全球所有国家的注册、生产和商业化相关的独占权利。
国内药讯
1.北海康成IBAT抑制剂获批香港上市。北海康成从Mirum公司引进的回肠胆汁酸转运体(IBAT)抑制剂氯马昔巴特口服溶液(迈芮倍,LIVMARLI®)获香港监管部门批准上市,用于治疗3个月及以上阿拉杰里综合征(ALGS)患者胆汁淤积性瘙痒。在IIb期ICONIC研究中,maralixibat治疗使这类患者瘙痒显著下降并且维持4年。今年6月,该新药已在国内获批上市,用于治疗1岁及以上ALGS患者。
2.和黄VEGFR抑制剂日本报NDA。和黄医药与武田联合开发的VEGFR抑制剂呋喹替尼已向日本厚生劳动省提交新药上市申请,用于经治转移性结直肠癌成人患者。在国际III期FRESCO2研究中,与安慰剂相比,呋喹替尼治疗组的mOS延长2.6个月,mPFS延长1.9个月。在中国,该新药已获批用于既往接受过氟嘧啶、奥沙利铂和伊立替康治疗的转移性结直肠癌患者。
3.恒瑞SGLT-2抑制剂新适应症报产。恒瑞医药SGLT-2抑制剂1类新药脯氨酸恒格列净的新适应症上市申请获CDE受理,与盐酸二甲双胍和磷酸瑞格列汀联合使用,配合饮食和运动改善成人2型糖尿病(T2DM)患者的血糖控制。在关键Ⅲ期临床(SHR3824-SP2086-MET-301)中,与盐酸二甲双胍和磷酸瑞格列汀相比,三药联合组糖化血红蛋白(HbA1c)相对基线下降幅度显著更优。
4.创胜CLDN18.2单抗获批胃癌国际Ⅲ期临床。创胜集团CLDN18.2单抗osemitamab(TST001)获FDA批准开展国际Ⅲ期关键试验TranStar 301,联合PD-1抗体纳武利尤单抗及化疗一线治疗HER2阴性、CLDN18.2表达局部晚期或转移性胃癌或胃食管结合部腺癌患者。在I/II期临床(NCT04495296)扩展研究中,中位随访为195天时,Osemitamab(6mg/kg)达到66.7%的部分缓解;预计中位PFS为9.5个月。此前,osemitamab已获得FDA授予治疗胃癌和胰腺癌的孤儿药资格。
5.歌礼PD-L1单抗慢性乙肝IIb期临床积极。歌礼皮下注射PD-L1抗体ASC22(恩沃利单抗)用于慢性乙肝(CHB)功能性治愈的IIb期扩展队列期中结果积极。ASC22是一款旨在通过阻断PD-1/PD-L1通路以达到慢性乙型肝炎功能性治愈的“First-in-class”免疫疗法。24周数据显示,ASC22治疗组和安慰剂组达到HBsAg清除的患者比例分别为21.1%和0%;ASC22总体耐受性良好,药物相关不良反应大多为1级或2级。
6.拓新天成B7-H3靶向CAR-T获批美国临床。拓新天成开发的靶向B7-H3的CAR-T产品TX103获FDA批准开展恶性脑胶质瘤治疗的临床试验。今年6月,FDA已授予该产品用于治疗恶性脑胶质瘤的孤儿药资格。在临床前研究中,TX103能有效杀伤肿瘤细胞,并能清除小鼠模型中的实体肿瘤,且未观察到明显的副反应。去年8月,国家药监局已批准该产品开展用于治疗晚期实体瘤经治患者的IND申请。
国际药讯
1.庞贝病双成分疗法获FDA批准上市。Amicus公司人源重组酸性α-葡萄糖苷酶Pombiliti(cipaglucosidase alfa)与口服酶稳定剂 Opfolda(miglustat)65mg胶囊组合方案获FDA批准上市,用于治疗晚发型庞贝病患者。在关键Ⅲ期临床PROPEL中,与标准治疗alglucosidase alfa相比,联合治疗显著改善患者的疗效指标。此前,该组合方案已获得FDA突破性疗法认定。
2.抑郁症新药「吉哌隆」获FDA批准上市。Fabre-Kramer公司新型口服选择性5-羟色胺(5-HT)1A受体激动剂EXXUA(吉哌隆)获FDA批准上市,用于治疗成人重度抑郁症(MDD)。在临床试验中,EXXUA独特的机制可有效缓解抑郁症状,而且药物产生的性副作用与安慰剂相当,不被纳入EXXUA标签不良反应部分的发生率标准。目前,该产品还被开发用于焦虑症、低反应性性欲障碍等适应症。
3.精神分裂症新药KarXT报NDA。Karuna公司口服M1/M4型毒蕈碱型乙酰胆碱受体激动剂KarXT(xanomeline-trospium)已向FDA提交新药上市申请(NDA),用于治疗精神分裂症成人患者。在EMERGENT系列研究中,KarXT均达到主要终点,KarXT治疗患者的阳性和阴性综合征量表 (PANSS) 总分的降低较安慰剂均具有统计学显著性。再鼎医药拥有该新药在大中华区的独家权益。
4.埃万妥单抗肺癌头对头III期研究积极。强生旗下杨森EGFR/c-MET双抗Rybrevant(amivantamab,埃万妥单抗)联合第三代EGFR抑制剂Lazertinib治疗EGFR突变局部晚期或转移性非小细胞肺癌(NSCLC)的III期MARIPOSA研究达到主要终点。与奥希替尼相比,Rybrevant+Lazertinib方案显著改善患者的无进展生存期(PFS);患者中期总生存期(OS)数据也具有获益趋势;而且联合用药安全性特征与既往研究一致。
5.抗精神障碍创新疗法Ⅱb期临床成功。Bionomics公司开发的α7烟碱型乙酰胆碱受体的负向别构调节剂BNC210,在治疗创伤后应激障碍的Ⅱb期ATTUNE试验达到主要与次要终点。第12周时,患者的DSM-5创伤后应激障碍量表(CAPS-5)的评分,以及Montgomery-Åsberg抑郁评分量表(MADRS)和失眠严重性指数(ISI)的评分均具有统计学意义的改善。此前,该新药已获得FDA授予治疗急性社交焦虑障碍(SAD)和其他焦虑相关疾病的快速通道资格。
6.硕迪小分子GLP-1R激动剂早期临床积极。Structure公司口服小分子GLP-1R激动剂GSBR-1290治疗超重或肥胖健康成人的Ⅰb期临床结果积极。最高剂量GSBR-1290(90mg)治疗组28天后平均体重较基线减轻高达4.9kg,安慰剂调整后体重降低高达4.9%。药物每日一次给药后耐受性良好。该新药目前正在Ⅱa期临床中评估治疗肥胖/超重健康成人患者或肥胖/超重并患有2型糖尿病 (T2DM) 患者的潜力。
7.Madrigal公司募资5亿美元推进NASH疗法上市。Madrigal公司宣布将通过IPO募集约5亿美元资金,以用于加速其口服选择性甲状腺激素受体(THR)-β激动剂resmetirom的临床开发及上市后商业化活动。今年9月中旬,FDA已授予该新药优先审评资格,PDUFA日期为明年3月14日。在Ⅲ期临床MAESTRO-NASH中,resmetirom(100mg)治疗52周后,患者肝脏脂肪水平平均降低51%;肝纤维化、肝脏体积和脾脏体积也显著降低。
医药热点
1.2023年诺贝尔生理学或医学奖揭晓。近日,诺奖委员会宣布将2023年诺贝尔生理学或医学奖授予Katalin Kariko博士和Drew Weissman博士,以奖励他们在mRNA疫苗上做出突破性贡献。他们通过核苷碱基修饰,使开发出有效的抗COVID-19 mRNA疫苗成为可能。在新冠疫情中,基于mRNA技术的新冠疫苗为无数人带来了保护,并改变了全球对抗新冠疫情的格局。
2.西部门诊管理联盟成立。9月28日,西部门诊管理联盟、西部多学科(罕见病)管理联盟在陆军军医大学新桥医院正式成立,军地54家医院签订深化医联体合作专科联盟协议并授牌。联盟重点聚焦门诊规范管理、人才培养、疑难危急重症多学科会诊等领域,旨在建立完善西部门诊管理专业的服务网络构架,实现区域患者首诊、常见病、慢性病、康复期在基层,疑难危急重症在上级医院的分级诊疗模式,提升门诊服务质量。
3.温州医科大学老年医院揭牌。9月27日,温州医科大学老年医院、老年医学学院、老年研究院在温州医科大学附属第一医院正式挂牌,意味着医疗、教学、科研三位一体的综合性老年医学中心正式建立。老年医学中心将以建设国家级老年医学中心为目标,依托温州医科大学、瓯江实验室高层次人才和温医大附一院学科优势,围绕健康老龄化问题推进产学研医协同创新,落实“医养一体”理念,持续提升老年健康服务水平。
4.黑龙江中医药大学附一院启动“中医日间病房”。黑龙江中医药大学附属第一医院于10月份正式启动“中医日间病房”服务。这是一种创新的中医医疗服务模式,可为患者提供了一种方便、快捷的治疗方式,让患者在享受中医优质服务的同时,也能节省时间和费用。参保人员在定点医疗机构发生的日间病房费用实行“一站式”直接结算,参保人员只需承担个人负担的部分医疗费用。
评审动态
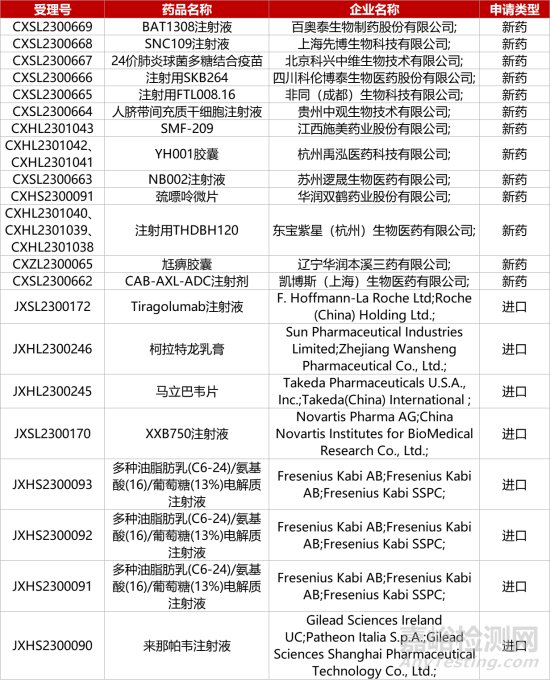
1. CDE新药受理情况(10月08日)
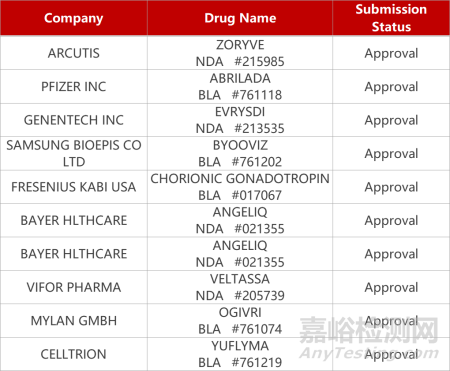
2. FDA新药获批情况(北美10月05日)