药学(Chemistry, Manufacturing and Controls,化学、生产和控制,简称CMC)研究,包括药物生产工艺研究、杂质研究、质量研究、稳定性研究、工艺验证等方面内容,对非临床和临床研究试验提供技术和物质支持,贯穿于药物研发及生产的全生命周期,是药品申报资料中非常重要的部分。例如在进入临床研究前,化学部门主要研究化合物的理化性质、合成路线选择、起始原料确定,工艺优化、杂质鉴定和控制策略等,同时要考虑到未来的生产,是否能放大生产?是否能工业化生产?将来生产成本是否有可能降低?这是化学与生产的联系。而化学与控制的联系源于2004年FDA最早提出QbD(质量源于设计)概念,并被纳入ICH质量体系成为指导原则和指南。
有数据表明,50%新分子实体第一次向FDA提交NDA申请遭到拒绝,这当中有11.3%的原因与CMC相关;CMC研发平均约占生物制药公司约50%的非临床预算,由此可见CMC策略的重要性。
CMC的终极目标是完成申报注册和合规性要求,这两条腿缺一不可。
确保产品质量符合法规要求。
确保产品的可靠和持续生产以避免短缺。
在平衡生产质量和稳定性的同时,为产品收率制定目标。
降低生产过程风险,确保生产场所需要最低限度的维护和最低限度监管要求。
保持灵活性,确保战略能够应对多个地区监管法规要求的差异。
2、生物技术药物CMC研发的挑战在哪?
中国仿制药的CMC已经比较成熟,而创新药的CMC起步较晚,研发具有较大的不确定性,特别是对于新疗法、罕见适应症、同类首创等引领性的创新药,少有可参考的对象,部分指导原则还在制订中。尤其在原料、制剂、辅料包材、质量控制等各个环节极具挑战。
原料
杂质未定义明确,包括工艺杂质、制剂杂质、容器中浸出杂质或残留溶剂等;对原料药的了解不够充分;遗传毒性研究不充分;缺乏药物与安全相关的临床与临床前关联评价;方法及放行标准不适用等。
制剂
处方组成中辅料的了解程度不够;方法及放行标准不适用;没有足够的稳定性数据支持临床周期;设备适用性问题;包材相容性问题等。
辅料包材
对辅料包材缺乏说明;与药物的相容性问题;标准问题(USP/NF;FDA非活性成分数据库),用CP标准可能会存在问题;供应商信息(Ⅲ期以后,供应商改变后标准有没有变);创新辅料的问题;动物性辅料来源问题(如疯牛病风险)。
质量研究和稳定性
杂质合理的限度;代谢产物等质量控制结果是否与临床结果结合;稳定性研究是否考虑到上市国家和地区的气候;储藏条件和包装是否考虑到主要目标市场的气候条件等。
3、 做好CMC的秘诀是什么?
策略一
充分了解生物技术药物 (活性物质、原液到制剂) 的特点
充分了解生物技术药物的特点是制定CMC策略的重要一步。每个产品不管是生化制品、生物制品还是单抗双抗、ADC或者是细胞基因制品,都是独特的,在同一类型里也不相似之处。但是每一个理想状态,都有一个质量标准,而我们的企业最好是做美国或欧洲的标准去实现全球国际化,那么应对国内的标准就游刃有余了。
策略二
必备条件-搭建一体化的CMC技术平台 (或与CDMO合作)
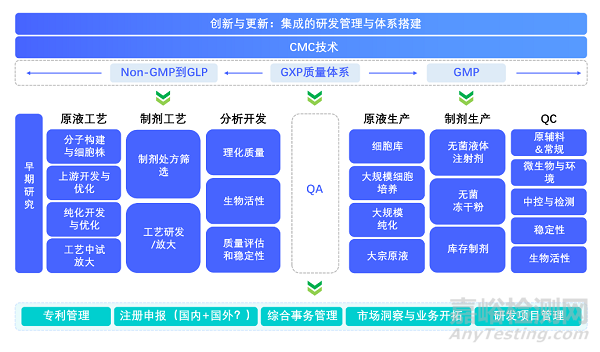
1. 分析技术在产品开发生命周期中的应用:分析的能力在CMC板块被称为工艺的眼睛和耳朵,洞察黑匣子的未知,起到保驾护航的作用。
2. 工艺开发到产品质量的协同性:工艺决定产品,产品质量反馈工艺
3. 建立Non-GMP到GMP下的CMC (工艺与质控) 集成库,提高药物研发和生产的效率和质量一致性
4. 综合过程到产品的分析和表征工具,利用技术作为其适当的设计。
图1:集成的研发管理与体系搭建
策略三
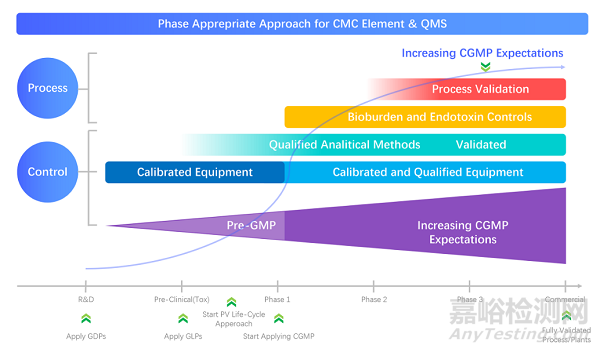
做好产品实现路线与搭建完整高效GXP体系的平衡
从药物研发的每个阶段对管理系统按逻辑结构进行“分层切块”,定义过程顺序和结构。为什么要GDP?为什么临床前到启动临床需要GLP?为什么需要GEP?为什么要GCP?为什么临床早期与后期要求略有不同?
为什么要GMP?为什么要GSP?确保每个工艺过程的数据的真实性,可靠性,可溯源,可控性,降低风险增加的成功率。
图2:CMC元件与质量管理体系相适应方法
策略四
工艺控制策略,QbD中保证药品质量的直接武器
建立产品控制策略,是保证产品质量符合目标产品质量属性要求的必要途径(其不限于QbD中),控制策略是针对所有产品的要求,如果设计空间被建立并批准应用,控制策略就为其提供了一种机制,可以确保生产工艺保持在设计空间所界定的范围内。如果没有适当的控制策略,没有适当的监测和趋势分析,就有可能无法在常规基础上提供高质量的产品,并且可能无法满足监管要求,以及缺乏对技术问题作出快速反应的能力。
策略五
Cross-Contamination Control Strategy 交叉污染控制策略
Contamination Control Strategy (CCS, 污染控制策略)这一概念首次出现于2017年的无菌附录征求意见稿中,是源于对当前产品和工艺的理解、用于确保工艺性能和产品质量的一系列有计划的措施,这些措施是针对微生物、内毒素/热原和微粒的控制,一直是行业内关注的热点之一。近些年生物技术药物基本都是无菌制品,除了工艺实现路线外,这也是合规性的要求,污染的来源不仅来自产品和工艺,也来自非产品。所以我们要最大限度地降低药品生产过程中污染、交叉污染以及混淆、差错等风险,确保持续稳定地生产出符合预定用途和注册要求的药品。
策略六
平台技术不断追求、速度、质量、成本的融合
毋庸讳言,成功来自于速度,灵活性,成本和质量,通过工艺优化、自动化和机器人技术、过程分析和控制、数据管理和分析以及质量管理体系的应用,可以提高生物技术药物CMC的效率,加快药物的研发和生产过程,为患者提供更好的治疗选择。而我们应了解CMC的所有指导方针和在CMC生命周期开发中的应用,使CMC技术平台的能力准备就绪以提高效率。