近年来,中国医疗器械行业在政策的推动下呈现出强劲的发展势头。许多国产厂家已经开始在技术创新、产品质量等多方面展现出与国际头部医疗器械企业长期匹敌,甚至超越的竞争优势。国产厂家的崛起,使中国医疗器械走向全球市场水到渠成。
近日,健世科技宣布,其自主研发的经导管三尖瓣置换系统,获选加入美国食品药品监督管理局(FDA)的产品全生命周期咨询计划(TAP),将有效加速其在美国的临床试验和商业化拓展进度。
公告发出后,健世科技开盘一度上涨超14%,直观地反映出市场对于健世科技的经导管三尖瓣置换系统LuX-Valve系列产品的认可以及公司未来发展的信心。
1、创新性、临床价值获认可,出海进程再提速
对于健世科技而言,经导管三尖瓣置换系统进入TAP是其获得FDA授予突破性器械认定后的又一大里程碑事件,将进一步加速其在美国的临床和商业化进展。
简单来说,TAP旨在通过促进FDA与医疗器械厂商之间早期、频繁和战略性的沟通,以确保美国患者能够于未来几年内在全球范围率先获得高质量、安全、有效和创新的医疗器械。截止至2023年9月8日,FDA在TAP试点中仅纳入了9款器械。
不难判断,健世科技的经导管三尖瓣置换系统能够获纳入TAP,一方面意味着产品的创新性,以及在治疗方面的安全性和适用性已经获得权威标准的认可,拥有值得期待的竞争优势。另一方面,FDA也将从战略和执行两个层面提供持续的支持,推动该产品后续在美国的临床和商业化进程。
资料来源:公司资料
更深层次地来看,作为一款为治疗重度三尖瓣反流及高手术风险患者设计的产品,LuX-Valve系列产品成功获得FDA授予的突破性医疗器械认定和获选纳入TAP,且临床资料已被欧洲心脏病学会(ESC)和欧洲心胸外科协会(EACTS)瓣膜性心脏病管理指南所引用,标志着中国国产医疗器械在国际标准引领方面取得了重大进展。健世科技的经导管三尖瓣置换系统的成功经验亦是为其他中国医疗器械企业提供了借鉴,将有力推动中国医疗器械产业的发展和国际竞争力的提升。
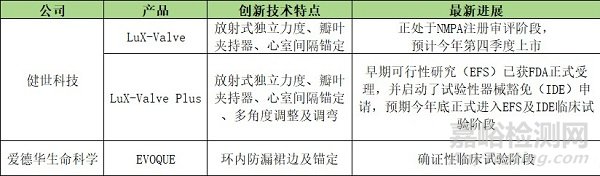
此外,一代产品LuX-Valve及二代产品LuX-Valve Plus均已进入NMPA创新医疗器械特别审查程序,多项国内外认可的资质更是直接彰显出健世科技在介入医疗器械方面强劲的技术实力。
目前,LuX-Valve已进入NMPA注册审评阶段且注册发补资料已递交国家药监局,有望成为全球首批上市的三尖瓣置换介入治疗产品。若LuX-Valve顺利于今年第四季度在中国如期上市销售,后续其也将为该产品在美国及其他海外地区的商业化提供更多数据支撑,加速在美国的临床试验和商业化进程。
2、走出去到全球化,清晰的全球化战略
透过健世科技这一动态回到行业视角上,不由得引发出一个问题,国产医疗器械为什么要出海?
投资领域有一句话,"不做中国市场做不大,不做全球市场做不强。"归结为一句话,那就是国产医疗器械厂家出海是发展壮大的必经之路,并将为国内医疗器械公司在多变的环境下提高抗风险能力。我们不妨从以下三个方面来看:
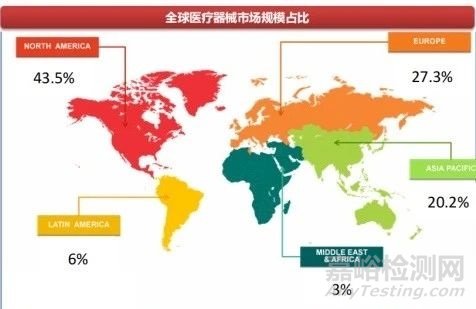
其一,海外医疗器械市场空间广阔。西南证券指出,目前全球器械市场主要由美国和欧洲贡献,预计后续以中国为主的亚太市场、以及拉美、中东、非洲等发展中国家市场增速将快于发达市场,国内器械出海进可攻发达市场,退可守发展中国家市场。
以全球结构性心脏病介入医疗器械市场为例,弗若斯特沙利文预计,全球结构性心脏病介入医疗器械市场规模将由2021年的93亿美元增至2025年的198亿美元,年复合增长率为20.8%,并于2030年增至481亿美元。
资料来源:西南证券
其二,海外市场具有多元化的购买方结构,以商业保险为主,这与国内单一的支付方模式形成鲜明对比。这种支付结构使整个产品价格体系更为稳定,并且随着产品的不断创新和迭代,部分产品的价格逐渐趋于稳定甚至略有提升。以TAVR为例,爱德华的Sapien系列自2011年在美国上市以来,单价基本维持稳定。
其三,海外市场受经济发展水平、医疗保健政策、健康意识以及医疗器械技术等多方面因素作用影响,如北美、欧洲等发达地区有着较强的商业保险支付能力以及患者支付意愿。
顺应这一必然趋势,健世科技作为一家深耕结构性心脏病介入治疗领域的医疗器械企业,已形成了一套清晰的全球化战略。目前,公司同时推进自研产品在欧洲、北美、亚太等地区的国际化布局,旗下产品已在全球超过10个国家或地区拥有164项已授权专利及196项专利申请。
以三尖瓣置换产品为例,除前文提及的LuX-Valve以外,公司的二代三尖瓣置换产品LuX-Valve Plus也同样在海外市场取得了积极进展。
在北美市场,已在美国及加拿大地区完成数十例临床植入,持续推进经导管三尖瓣置换系统产品在北美地区的临床及商业化进程。预计在今年内正式进入EFS和IDE临床试验阶段。
在欧洲方面,持续在欧洲进行以获取CE认证为目标的临床应用。已经在法国、德国、西班牙、意大利、丹麦等欧洲主要国家及地区开展数十例临床植入,取得多国专家的一致好评。
在亚太区域,已成功开展多例收费同情救治使用,进一步提升公司在亚太地区的学术地位和商业化影响力。
可以预想,未来公司的收入将呈现多产品、多国家、多区域均衡分布的局面,以适应细分市场和多样化的消费者需求,获取更多收益。同时积极拓展国际市场和不同地区业务,也将提高公司的市场占有率和竞争力,从而实现持续、稳定的发展。
从竞争格局来看,目前全球还未有一款三尖瓣介入置换治疗产品获批上市,相较于全球已经进入确证性临床试验阶段的三尖瓣介入置换产品,健世科技的LuX-Valve系列无论是在技术理念、临床进度和临床效果上,均有着领先优势。
值得一提的是,LuX-Valve系列产品作为一款中国自主创新研发的第三类医疗器械,其研发过程相当漫长,从立项、临床试验到预期拿证,历经10年。而健世科技凭借着前瞻性的布局,力克三尖瓣介入置换的高技术门槛,推动LuX-Valve迈入商业化的最后阶段,即将获批上市抢跑市场。
资料来源:公开资料
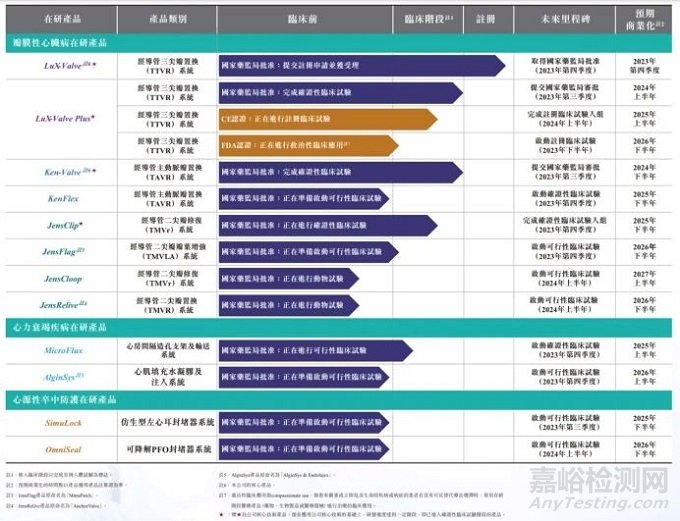
此外,健世科技的其他管线临床也在稳步推进中。例如,经导管主动脉瓣置换系统Ken-Valve已于今年上半年完成确证性临床试验的一年随访工作,即将向NMPA提交注册,预计2024年下半年获批上市,有望成为中国第二款、全球第三款能够治疗主动脉瓣重度关闭不全(或合并狭窄)的主动脉瓣介入治疗产品。经导管二尖瓣修复系统JensClip确证性临床试验入组已将近过半。经导管二尖瓣瓣叶增强系统JensFlag已成功完成数例人体应用,验证了二尖瓣瓣叶增强技术的可行性。其全资子公司迪创医疗孵化的房间隔造孔支架系统MicroFlux和左心耳封堵器系统SimuLock亦均进入到正式FIM临床试验入组阶段,当前入组均顺利成功。
资料来源:公司资料
3、小结
"出海"作为企业能否在行业中走得更远的关键,已成为国产医疗器械厂家的追求目标。但海外市场存在空白的临床需要,自身产品力的强大,公司过硬的综合能力(持续的创新研发能力、稳定的质量体系、前瞻性的全球布局眼光)仍是摆在许多国产医疗器械寻求出海目标所必须面对和解决的。
健世科技持续不断的创新研发升级出三尖瓣置换系统LuX-Valve、LuX-Valve Plus,以及主动脉瓣置换系统Ken-Valve等多个极具竞争力的医疗器械,展现出公司在行业中的先发优势和独特竞争力,为其瞄准全球市场的国际化布局奠定坚实的基础。
反映到估值层面,笔者认为,随着市场情绪逐渐回归理性,LuX-Valve及更多产品上市兑现业绩,可以静待健世科技的价值升维。