您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2023-09-13 11:15
本文适用于吻合钉呈六排互相平行错位排列的二类无源的一次性使用腔镜用直线型切割吻合器及组件。吻合器的管理类别为二类,分类编码为02-13。
一、一次性使用腔镜用直线型切割吻合器工作原理和结构组成
1.工作原理
吻合器通过机械传动装置,将预先放置在组件中呈六排互相平行错位排列的吻合钉,击入已经对合好需要吻合在一起的组织内,吻合钉在穿过组织后受到前方抵钉座阻挡,向内弯曲,形成类“B”形互相错位排列,将组织吻合在一起。由于小血管可以从“B”形吻合钉空隙中通过,故不影响吻合部位及其远端的血液供应。
2.结构组成
一次性使用腔镜用直线型切割吻合器及组件(以下简称吻合器)由器身和组件组成。吻合器根据切割刀设计,分为切割刀装配于组件型和切割刀装配于器身型;根据关节结构,分为弯转型和不可弯转型。
切割刀装配于组件型腔镜切割吻合器,器身一般由击发杆、杆、关节头旋钮、旋转轴环、击发按钮、回复钮、卸载按钮、手柄等组成;组件一般由抵钉座、钉仓、钉仓座、切割刀和吻合钉等组成。
切割刀装配于器身型腔镜切割吻合器,器身一般由抵钉座、关节头、杆、旋转钮、调节拨片、刀片方向切换钮、击发指示窗、刀片方向指示窗、释放钮、手柄、关闭手柄、击发手柄、切割刀、钉仓座等组成;组件一般由钉仓和吻合钉等组成。
产品的基本型式见图1-4。
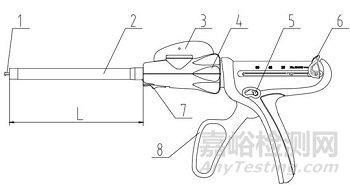
1、击发杆;2、杆;3、关节头旋钮;4、旋转轴环;5、击发按钮;6、回复钮;7、卸载按钮;8、手柄
图1 吻合器器身(切割刀装配于组件型)结构示意图
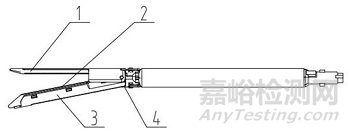
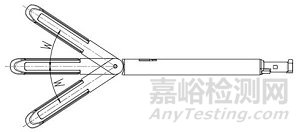
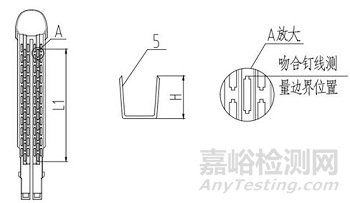
1、抵钉座;2、钉仓;3、钉仓座;4、切割刀;5、吻合钉
图2 组件(切割刀装配于组件型)结构示意图
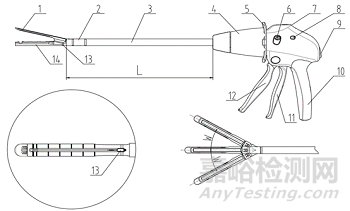
1、抵钉座;2、关节头;3、杆;4、旋转钮;5、调节拨片;6、刀片方向切换钮;7、击发指示窗;8、刀片方向指示窗;9、释放钮;10、手柄;11、关闭手柄;12、击发手柄;13、切割刀;14、钉仓座
图3 吻合器器身(切割刀装配于器身型)结构示意图
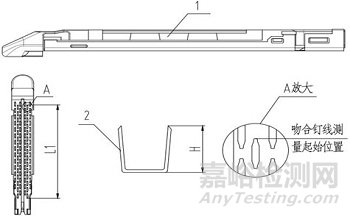
1、钉仓;2、吻合钉
图4 吻合器组件(切割刀装配于器身型)结构示意图
二、一次性使用腔镜用直线型切割吻合器性能研究实验要求
(一)产品性能研究
应当开展产品性能研究以及产品技术要求的研究,明确包括功能性、安全性指标以及与质量控制相关的其他指标的确定依据,所采用的标准或方法、采用的原因及理论基础。
依据:《腔镜用吻合器产品注册技术审查指导原则》、YY 0876-2013 直线型切割吻合器及组件。
1.吻合钉材料
应对吻合钉材料进行检测,若吻合钉原材料是钛丝,检测结果中化学成分应符合GB/T 13810-2017,若吻合钉原材料是钽丝,化学成分应符合ISO13782或YY/T 0966-2014。制成吻合钉材料的拉伸强度应不小于240MPa。
2.灵活性
吻合器开闭应灵活,不应有卡阻现象。
3.装配性
吻合器组件更换方便,定位可靠。组件经甩动后吻合钉不应露出钉仓表面。
4.锋利度
切割刀刃口应锋利,切割力应不大于0.8N。
5.吻合和切割性能
吻合器应具有良好的吻合和切割性能,更换组件,作不少于5次切割吻合,其每次吻合后的缝钉应成类“B”字形,同时每次吻合后的切割边缘应整齐,无毛边,每次吻合线长度比切割线长度至少长1.5倍钉长。
6.耐压性能
吻合后的吻合口应能承受不小于3.6kPa压强,在15s内漏水不超过10滴。
7.安全装置
吻合器应具有空钉仓安全保护装置,并保持其可靠性。
8.表面粗糙度
吻合器金属件表面粗糙度Ra应不大于0.8µm。
9.使用性能
(1)吻合器器身与组件连接应牢固可靠。
(2)弯转型吻合器,摆动到最大角度(明确具体角度及
允差)后,能顺利完成击发和复位。
(3)吻合器应具有击发过程反馈指示装置,能够指示击发过程或状态。
10.硬度
切割刀硬度应不低于377HV0.2。
11.耐腐蚀性能
吻合器头端外表面金属件部分的耐腐蚀性能应不低于 YY/T 0149-2006中5.4 b)的规定。
12.包装密封
(1)吻合器及组件的包装应完好,粘合密封区域应无通道或穿孔。
(2)吻合器及组件的包装封口剥离强度不小于0.1N/mm;剥离后两接触表面应光滑且连续均匀,无分层或撕裂现象。
13.外观
(1)吻合器外形光滑、轮廓清晰、无毛刺、划伤等缺陷。
(2)吻合器外表面上的字迹、标志清晰、不得有错位、歪斜等缺陷。
(3)吻合器表面不得有毛刺、凹陷等缺陷。
14.尺寸
吻合器及组件尺寸应符合制造商的规定。
15.灭菌
吻合器及组件应经已确认过的灭菌过程(明确灭菌方式)进行灭菌,产品应无菌。
16.环氧乙烷残留量
若采用环氧乙烷灭菌,环氧乙烷残留量≤10μg/g。
17.按照《腔镜用吻合器产品注册技术审查指导原则》研究闭合力、夹持力及其均匀性、抵钉座与钉仓的安全间隙等。
18.若组件可更换,需开展组件可更换最大次数的验证研究,验证次数需超过制造商规定的最大次数。
(二)生物相容性评价研究
应对产品中与患者和使用者直接或间接接触的材料的生物相容性进行评价。
生物相容性评价研究应当包括:
1、明确生物相容性评价的依据和方法,生物学评价依据GB/T 16886.1-2011、YY 0876-2013开展。
2、明确产品所用材料的及与人体接触的性质。产品按人体接触性质分类:除吻合钉之外,产品为外部接入器械b组织(与组织接触的器械);按接触时间分类为短期接触(在24小时以内一次,多次或重复使用或接触的器械)。明确吻合钉的材质,表面是否改性处理,吻合钉为植入器械(接触组织);按接触时间分类为持久接触(>30d)。吻合钉,选用表面作改性处理的纯钛、钛合金材料和纯钽材料,应按GB/T 16886.1-2011的规定进行生物学评价。
3、明确实施或豁免生物学试验的理由
产品可以用成品或原材料进行生物学试验,使用原材料生物学试验用于豁免成品生物学试验的企业应明确在生产加工过程中原材料没有进行改性处理。
4、对于现有数据或试验结果的评价。
根据有资质的检验机构出具的检验报告,生物学评价应符合要求。
(三)灭菌工艺研究
应明确灭菌工艺(方法和参数)和无菌保证水平(SAL)。
(四)产品有效期和包装研究
吻合器与组件分开包装的,应分别对其有效期和包装进行研究。
1.有效期:开展期限、加速老化或实时老化的试验。
2.包装及包装完整性:根据产品的包装材质,开展合适的包装完整性试验,如无菌实验、真空泄漏实验、染料渗漏试验、琼脂接触攻击试验、密封强度测试等,并进行外包装抗压、跌落、模拟运输等测试。
(五)其他
证明产品安全性、有效性的其他研究。

来源:嘉峪检测网


