首先我们看下一FDA认可的标准。近日FDA发布了认可标准的修订,认可清单编号为059。由于全部内容较多,本文主要谈及生物相容性方面的标准变化,如表1-2所示。
表 1——认可标准列表的修改
|
旧识别号 |
新识别号 |
标准名称 1 |
改变 |
|
B. 生物相容性 |
|
2–93 |
2–297 |
ASTM F763–22 Standard Practice for Short-Term Intramuscular Screening of Implantable Medical Device Materials |
撤回并替换为新版本。 |
|
2–276 |
2–298 |
ISO 10993–18 Second edition 2020–01 Amendment 1:2022–05 Biological evaluation of medical devices—Part 18: Chemical characterization of medical device materials within a risk management process [Including Amendment 1 (2022)] |
撤回并替换为新版本,包括修订。 |
|
2–289 |
|
ISO 10993–12 Fifth edition 2021–01 Biological evaluation of medical devices—Part 12: Sample preparation and reference materials |
过渡期延长。 |
|
2–296 |
|
ISO 10993–10 Fourth edition 2021–11 Biological evaluation of medical devices—Part 10: Tests for skin sensitization |
过渡期延长。 |
|
1本表中所有标准标题均符合各组织的格式要求。 |
|
表 2 --新增的认可标准列表
|
|
认可编号 |
标准名称 1 |
参考编号和日期 |
|
B. 生物相容性 |
|
目前没有新条目。 |
同时,可在FDA搜索数据库中查询当前 FDA 认可的共识标准列表:https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfStandards/search.cfm
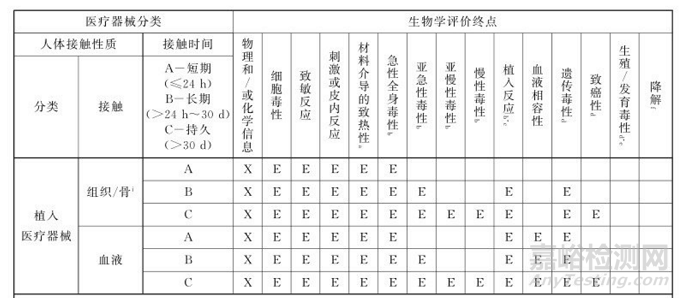
由上文我们看出FDA是认可ISO10993的。所以我们生物学评价按照ISO10993的要求进行是可以被接受的,此外目前GB/T16886.1-2022版本已经和ISO10993-1 2018版IDT啦。首先我们看下对于植入器械的分类:
按照接触分类分为:
1-与骨接触的医疗器械:如矫形钉、矫形板、人工关节、骨假体、骨水泥和骨内器械。
2-与组织和组织液接触的医疗器械:如起搏器、植入性给药器械、神经肌肉传感器和刺激器、人工肌腱、乳房植入物、人工喉、骨膜下植入物、结扎夹和不通过化学活性发挥作用的子宫内器械。
3-与循环血液接触的医疗器械:如起搏器电极、人工静脉瘘管、心脏瓣膜、人工血管、体内给药导管和心室辅助器械。
按照接触时间分为短期(0-24h)、长期(24h-30d)和持久(>30d),接下来我们看下生物学评价终点:
备注:由于ISO10993.1-2018与GB/T 16886.1-2022中生物学终点选择是一致的,这里就直接用GB/T 16886.1-2022的图啦。
我们看到在生物学评价中第一位的便是物理和/或化学信息的收集,如果在我们产品设计的预期用途范围内,所有材料、化学物质和过程的组合已有比较明确的、已知的安全应用史,且物理特性没有经过改变,则可能不必要开展表征和附加数据组(如可浸提物的化学或生物学试验),如之前提到的材料清单(ISO标准类的)。
若是新材料和新化学物质,则应展开化学表征获得材料及可沥滤物信息。补充一下:可沥滤物与我们日常进行的可浸提取(浸提液)是不同的。
可沥滤物是指医疗器械或材料在临床使用中释放的物质。
可提取物(或称浸提液)是指实验室浸提条件和介质下,从医疗器械或材料释放的物质。
可见,可提取物的范围要大于可沥滤物。
ISO10993-12 Biological evaluation of medical devices - Part 12: Sample preparation and reference materials
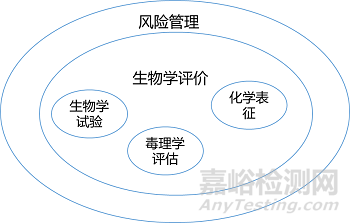
说到化学表征,我们不得不提下其重要性,首先我们从风险管理的角度看各自的重要性,如下图所示。
如之前文章描述化学表征是可以代替一些生物学试验的,关于这一点,CMDE发表的文章中有较为详细的介绍:
材料表征- 毒理学评价:即参照GB/T 16886.18(ISO10993-18)进行材料化学表征,参照GB/T 16886.17(ISO10993-17)进行毒理学评价。此种方式一般适用于评价系统性的毒性终点,如全身毒性、遗传毒性、生殖毒性、致癌性。当生物学试验的不确定度很高时,可以考虑采用材料表征- 毒理学评价的方式作为补充,但这种方式一般不用于评价细胞毒性、致敏、植入后局部反应、血液相容性等终点。毒理学阈值(TTC)评价方法也属于此种方式(ISO/TS 21726-2019,也在FDA认可标准清单中。)
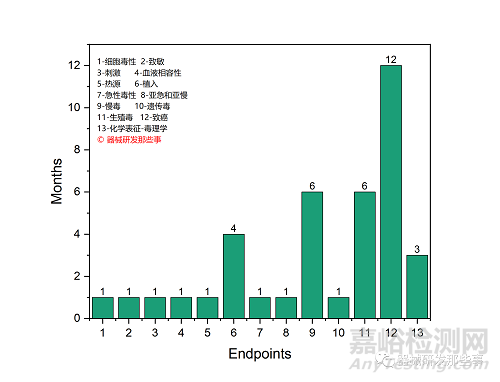
同时化学表征也是支持材料/器械等同性比较,我们在FDA产品研发过程中要充分用好化学表征,可以帮助我们节约大量的研发时间(可在下图中的测试周期看到),这里不赘述了,有几个概念值得我们注意。
化学等同性:两种材料或医疗器械的化学特性足够相似的情况,以至于其组分和加工不会引起额外的或不同的 毒理学问题。
物理等同性:两种材料或医疗器械的物理特性足够相似 的情况,以至于其构造、形态、形貌和摩擦学不会引起 额外的或不同的生物相容性问题。
材料等同性:证明两种材料或医疗器械在化学和物理方 面具有等同性的情况。
接触等同性:两种材料或医疗器械的预期临床使用足够 相似的情况,以至于生物学评价的终点相同。
生物学等同性:证明两种材料或医疗器械在材料和接触 方面具有等同性的情况。如果可以建立生物学等同性, 那么现有医疗器械的生物相容性就可以扩展到新的或改 良的医疗器械中。
根据ISO10993-1、ISO 10993-17、ISO 10993-18 、10993-19整理
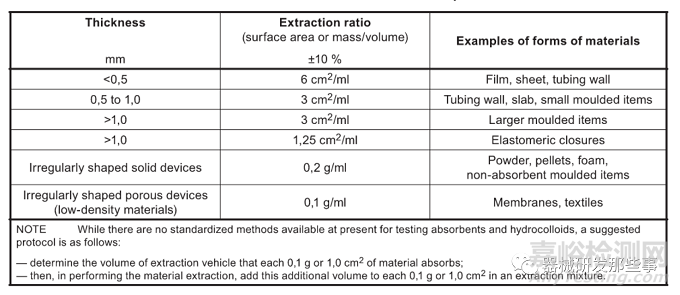
介绍到这里我们基本清晰了化学表征的目的,简单而言如果没有同等产品,则通过文献建立TI,无无法建立TI则需要进行生物学试验。针对生物学试验上图已给出了全面的介绍(ISO10993-1)。这里不在赘述,简单提下浸提条件的问题,这一点非常重要,选择不对生物学试验往往不会认可。通常对于FDA选择浸提优先采用比表面积进行计算(除非表面积无法计算)。对于存在厚度不均匀的,则采用最薄厚度进行选择。具体如下图:
关于浸提温度:对于长期(大于24h小于30天)或持久接触(大于30天)的医疗器械,建议采用72h浸提时间,同时对于植入部分,浸提温度建议选择50±2摄氏度。
关于浸提介质:应同时采用极性和非极性进行浸提,如果只用一种则应提供依据。
关于浸提液制备:
1-对于不同类型或与组织持续接触时间不同的器械部件,需要分别浸提和测试。和国内一致。(ISO10993-12)
2-应排除医疗器械非患者接触部分,或在计算浸提比例时排出该部分表面积。当存在不可能操作的情况时,选定浸提比例时应确保所有接触部分浸没在选定的浸提溶液中。(ISO10993-12)