今日头条
江苏迪哲EGFR-TKI获批上市。迪哲医药EGFR-TKI创新药舒沃替尼片(舒沃哲)获国家药监局批准上市,用于既往经含铂化疗出现疾病进展,或不耐受含铂化疗,并且经检测确认存在表皮生长因子受体(EGFR)20号外显子插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)患者。公布于ASCO2023年会上的注册研究(WU-KONG6)数据显示,经独立影像评估委员会(IRC)确认的客观缓解率达到60.8%。
国内药讯
1.罗氏IL-6R单抗皮下剂单药方案获批上市。罗氏托珠单抗注射液皮下注射剂型的单药方案获国家药监局批准,用于治疗对一种或多种改善病情抗风湿药物(DMARDs)既往治疗应答不充分或不耐受的,及甲氨蝶呤(MTX)应答不充分或不耐受MTX治疗的成人中重度活动性类风湿关节炎(RA)患者。托珠单抗是首个作用于IL-6R的创新抗体。此前该产品的静脉注射和皮下注射剂型的联合治疗方案均已在中国获批用于RA患者。
2.恒瑞改良型右美托咪定获批用于儿童。恒瑞医药2.2类新药盐酸右美托咪定鼻喷雾剂获国家药监局批准新适应症,用于儿童术前镇静(如儿童全身麻醉)。此前,该产品已被批准用于成人术前镇静/抗焦虑。右美托咪定是一种相对选择性α2-肾上腺素受体激动剂,原研产品由Oricon Pharma与雅培联合研发,商品名为Precedex。
3.康方IL-12/23单抗报银屑病NDA。康方生物IL-12/23单克隆抗体依若奇单抗(AK101)上市申请获CDE受理,推测申报的适应症为用于中重度银屑病的治疗。依若奇单抗通过靶向IL-12和IL-23的p40亚基并与之结合,同时抑制IL-12和IL-23与细胞表面受体的相互作用,进而减少T细胞对干扰素、TNF-α、IL-17等相关细胞因子的释放,阻断各自介导的细胞免疫反应。此前,该新药已在一项治疗中重度银屑病的III期注册临床中达到主要研究终点。
4.甘李「甘精胰岛素」欧洲报MAA。甘李药业开发的甘精胰岛素注射液用于糖尿病适应症的上市许可申请获欧洲EMA受理。这是一种长效胰岛素类似物,已于2005年在中国获批上市,商品名为长秀霖,只需每日注射1次,用于糖尿病患者控制血糖。在临床试验中,与赛诺菲原研药甘精胰岛素(商品名:Lantus)相比,该产品具有生物等效性。
5.凌科JAK1抑制剂脊柱炎Ⅱ期临床积极。凌科药业JAK1抑制剂LNK01001治疗强直性脊柱炎的Ⅱ期临床达到主要终点。12周治疗数据显示,与安慰剂相比,LNK01001高、低两个剂量组达到ASAS40应答的患者比例显著更高;其他疗效指标的改善与主要终点一致;药物总体安全性及耐受性良好。此前,LNK01001已在治疗类风湿关节炎、特应性皮炎的两项Ⅱ期研究取得积极结果。
6.康方PD-1/VEGF双抗拟纳入优先审评。康方生物PD-1/VEGF双抗依沃西单抗获国家药监局拟纳入优先审评,联合培美曲塞和卡铂用于经EGFR酪氨酸激酶抑制剂(EGFR-TKI)治疗后进展的EGFR突变的局部晚期或转移性非鳞非小细胞肺癌(NSCLC)的治疗。在Ⅱ期临床中,依沃西单抗联合化疗在这类患者中达到68.4%的客观缓解率(ORR),疾病控制率(DCR)为94.7%,中位无进展生存期(PFS)为8.2个月,6个月PFS率为69.3%。
国际药讯
1.罗氏TIGIT单抗联合治疗肺癌Ⅲ期临床积极。罗氏旗下基因泰克TIGIT抗体tiragolumab联合PD-L1抑制剂Tecentriq(atezolizumab)一线治疗PD-L1高表达的局部晚期或转移性非小细胞肺癌的Ⅲ期试验SKYSCRAPER-01最新结果积极。中位随访为15.5个月时,联合治疗较Tecentriq单药改善患者的总生存期(中位OS:22.9个月vs16.7个月;HR:0.81),联合疗法的耐受性良好。目前数据尚未成熟。
2.恩扎卢胺联合治疗nmCSPC获优先审评资格。辉瑞与安斯泰来开发的特异性雄激素受体(AR)抑制剂Xtandi(enzalutamide,恩扎卢胺)获FDA授予优先审评资格,用于治疗非转移性去势敏感性前列腺癌(nmCSPC)患者。在Ⅲ期EMBARK试验中,与安慰剂+亮丙瑞林组患者相比,Xtandi+亮丙瑞林组患者的无转移生存期(MFS)明显改善,其转移或死亡风险统计学显著降低58%(HR:0.42;95% CI:0.30-0.61;p<0.0001)。
3.眼科AAV2基因疗法欧盟获批临床。ViGeneron GmbH公司AAV2基因疗法VG901获欧洲药品管理局(EMA)临床许可,拟开发用于治疗CNGA1相关的视网膜色素变性症(RP)。VG901通过玻璃体内注射(IVT)递送CNGA1基因,降低了视网膜损伤风险。在临床前研究中,VG901已显示出可补充RP小鼠模型CNGA1基因的潜力,而且单次玻璃体内注射给药,VG901具有良好的安全性。
4.AZ布局强效mRNA贴片疫苗。阿斯利康与Vaxess公司将利用后者MIMIX缓释贴片技术,合作开发季节性流感RNA疫苗贴片。这种新型疫苗可通过耐储的皮肤贴片上的微针而非注射的方式给药,有利于未来在流感大流行时疫苗的分发和普及。这种微针贴片是用蚕丝蛋白尖端制成的,可在皮肤中溶解以产生更持久、强效的免疫反应。此次合作交易金额高达1030万美元。
5.拜耳宣布制药部门新的人事任命。8月22日,拜耳宣布新的人事任命,原拜耳执行副总裁(EVP)兼“拜耳飞跃计划(Leaps by Bayer)”负责人Juergen Eckhardt将任职拜耳制药部业务发展和许可/开放创新(BDL/OI)总监。Juergen Eckhardt将向拜耳制药部总裁Stefan Oelrich直接汇报。此外,Juergen Eckhardt仍然担任拜耳飞跃计划负责人,并向董事长Bill Anderson汇报。
医药热点
1.第四批鼓励研发申报儿童药品清单公布。为进一步做好保障儿童用药工作,促进儿童适宜品种、剂型、规格的研发创制和申报审评,国家卫健委会同科技部、工业和信息化部、国家医保局和国家药监局,通过组织专家遴选、社会公示等,研究制定《第四批鼓励研发申报儿童药品清单》。第四批清单有24个品种,涉及30个品规、9种剂型,覆盖神经系统用药、消化道和新陈代谢用药、抗肿瘤药及免疫调节剂等治疗领域。
2.河北医科大学建设新校区。近日,河北医科大学新校区一期建设项目环境影响评审公示,项目位于河北省石家庄正定新区,梦龙街以东,太行北大街以西,安济路以南,华光路以北。新校区总用地面积为1160亩,总建筑面积为48.9万平方米。新校区项目将分两期进行建设,其中一期项目总投资估算达到314000万元。
3.2023年国家医保基金飞行检查启动。8月23日,2023年全国医保基金飞行检查正式在贵州毕节市启动。本次飞行检查将重点聚焦于医学影像检查、临床检验、康复三个领域纳入医保基金支付范围的医疗服务行为和医疗费用。针对定点零售药店,主要检查是否存在违规刷卡、伪造信息、串换收费、为非定点机构结算医保费用等行为。针对医保经办机构,主要检查对定点医药机构和参保人申报的费用日常审核、支付以及核查情况,DRG/DIP付费方式下年度预算额度确定情况,智能审核系统使用情况等。
评审动态
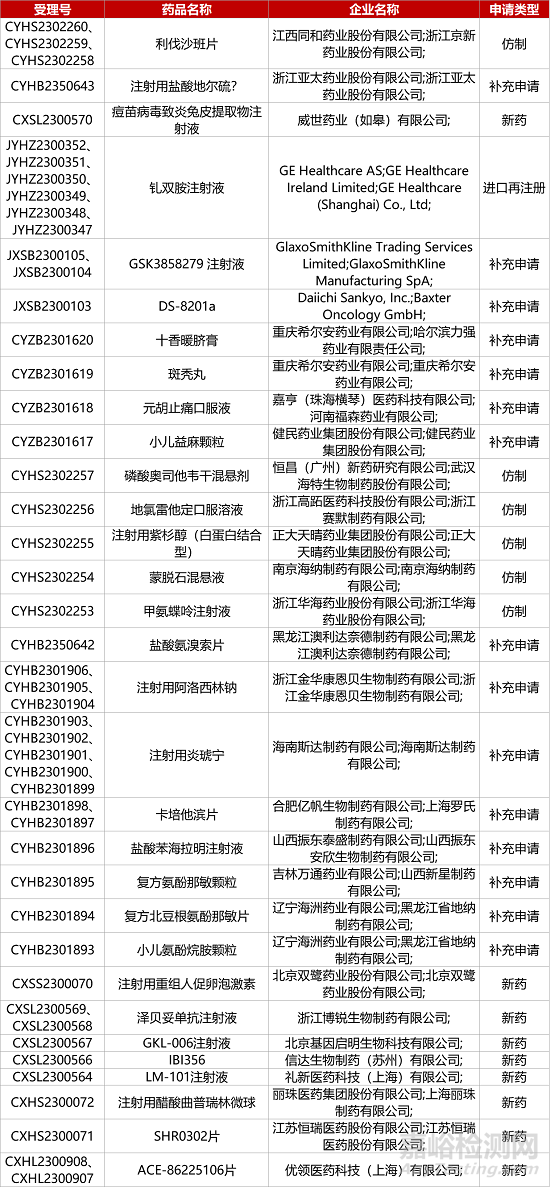
1. CDE新药受理情况(08月24日)
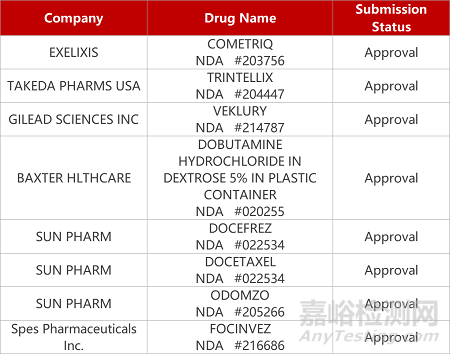
2. FDA新药获批情况(北美08月23日)