今日头条
苏州方拓眼科基因疗法获批DME临床。方拓生物1类生物制品FT-003注射液获国家药监局临床许可,适应症为糖尿病黄斑水肿(DME)。FT-003是一款新型重组腺相关病毒基因治疗产品,旨在通过外源基因导入靶细胞,以纠正或补偿缺陷和异常基因,进而达到治疗目的。今年4月,该产品已获CDE批准临床试验申请(IND),拟开发用于治疗新生血管性年龄相关性黄斑变性。
国内药讯
1.绿叶引进肺癌新药申报澳门上市。绿叶制药引进的RNA聚合酶II抑制剂芦比替定(lurbinectedin)向澳门药监部门提交上市申请,用于治疗接受铂类药物化疗期间或期后出现疾病进展的复发性小细胞肺癌成人患者。芦比替定是从海鞘Ecteinacidia turbinata中分离出的海洋化合物ET-736的衍生物,能够选择性地抑制多种肿瘤所依赖的致癌基因转录。今年6月,芦比替定用于上述适应症的新药申请已获得CDE受理。
2.再鼎ROS1/NTRK抑制剂拟纳入突破性品种。再鼎医药从Turning公司引进的ROS1/NTRK抑制剂repotrectinib胶囊获CDE拟被纳入突破性治疗品种,用于治疗既往接受过TRK TKI治疗失败的NTRK融合阳性的晚期实体瘤。一项Ⅰ/Ⅱ期临床数据显示,repotrectinib在TKI经治、NTRK阳性晚期实体瘤患者中达到48%的确认的客观缓解率。值得一提的是,该新药已有三项申请被CDE纳入突破性治疗品种;repotrectinib用于治疗ROS1阳性的局部晚期或转移性非小细胞肺癌的上市申请也已被纳入优先审评。
3.礼来双重激动剂中国减重III期临床积极。礼来公布GLP-1R/GIPR激动剂新药tirzepatide(替尔泊肽)用于肥胖或超重、非糖尿病患者的中国III期SURMOUNT-CN研究积极结果。数据显示,与安慰剂相比,tirzepatide(10mg和15mg)治疗组患者52周时体重较基线降幅显著(-14.4%和-19.9%,vs-2.4%);减重超过5%的患者比例更高(91.4%和92.7%,vs29.4%);减重超过15%的患者比例也更高(48.6%和72.1%,vs2.9%)。临床中未出现新的安全性信号。
4.科弈BCMA/CD19靶向CAR-T获批临床。科弈药业旗下上海科棋新一代CAR-T产品KQ-2003自体嵌合抗原受体T细胞注射液获国家药监局批准开展I期临床,评估用于已经接受过三线或者更多线治疗的复发/难治性多发性骨髓瘤(MM)患者的安全性与有效性。KQ-2003能同时靶向B细胞成熟抗原(BCMA)和CD19两个治疗靶点,已在IIT研究中显示出对复发/难治性MM患者的积极疗效,客观缓解率达到100%。
5.通化东宝口服GLP-1R激动剂报IND。通化东宝全资子公司东宝紫星口服小分子GLP-1R激动剂THDBH110胶囊的临床试验申请获CDE受理。在临床前研究中,THDBH110已显示出较好的降糖减重性能,有望在降糖、减重以及降低心血管风险等方面为II型糖尿病患者和肥胖患者提供全新的治疗选择。值得一提的是,该公司已布局包括利拉鲁肽注射液、多靶点的GLP-1/GIP双受体激动剂、口服小分子GLP-1R激动剂等多款GLP-1R激动剂类新药。
国际药讯
1.FDA批准辉瑞RSV疫苗用于婴儿预防。辉瑞双价呼吸道合胞病毒(RSV)疫苗Abrysvo(RSVpreF,PF-06928316)获FDA批准新适应症,通过孕妇主动免疫,预防出生至6个月大的婴儿患上RSV相关下呼吸道疾病(LRTD)。在III期MATISSE研究中,疫苗避免婴孩出生后90天内感染严重性MA-LRTI的保护力达81.8%,避免婴孩在出生后6个月的追踪期间感染严重性MA-LRTI的保护力达69.4%。此前,该疫苗已被批准用于预防60岁及以上人群出现由RSV引起的LRTD。
2.布地奈德IgA肾病sNDA获优先审评资格。Calliditas公司布地奈德(Tarpeyo)缓释胶囊的补充新药申请(sNDA)获FDA受理,并获得优先审评资格,PDUFA日期为今年12月20日。在Ⅲ期临床NefIgArd中,原发性IgA肾病(IgAN)成人患者在接受Tarpeyo治疗9个月并在之后15个月停药随访共两年期间,患者的估计肾小球滤过率(eGFR)具有统计学意义的改善(p<0.0001)。2021年12月,FDA已加速批准Tarpeyo上市,用于治疗原发性IgAN患者。
3.TKI联合PD-L1治疗mCRPC的Ⅲ期临床积极。Exelixis公司酪氨酸激酶抑制剂卡博替尼(cabozantinib,Cabometyx)联合PD-L1抑制剂Tecentriq治疗转移性去势抵抗性前列腺癌(mCRPC)的国际Ⅲ期试验CONTACT-02达到两个主要终点之一。与新型激素治疗相比,卡博替尼联合治疗显著改善患者无进展生存期(PFS);总生存期(OS)也显示改善趋势;联合用药的安全性与各单药的已知安全性特征一致。
4.礼来三靶点激动剂最新Ⅱ期临床积极。礼来GLP-1R/GIPR/GCGR三靶点激动剂新药Retatrutide将在EASD2023大会上公布用于治疗肥胖、糖尿病两项适应症的Ⅱ期临床最新数据。在针对糖尿病的临床试验中,Retatrutide治疗36周最多将HbA1c降低23.6mmol/mol,显著优于度拉糖肽;同时患者体重降幅达到16.9%。在治疗肥胖的试验中,患者治疗48周后体重降幅最多达到26.6%,心血管指标同样得到显著改善。
5.Eilean公司泛FLT3抑制剂上Ⅰ期临床。Eilean公司泛FLT3抑制剂ZE46-0134在首次人体Ⅰ期临床完成首例受试者给药。FLT3突变是急性髓系白血病(AML)中最常见的突变。ZE46-0134靶向FLT3内部串联重复突变(ITD)、酪氨酸激酶结构域突变(TKD)和其他临床相关的FLT3突变,同时避免靶向该蛋白的野生型。该新药有望为复发性、难治性AML患者提供新的治疗选择,以避免产生耐药突变,并同时抑制癌细胞逃逸机制。
6.AI药物公司Genesis完成B轮2亿融资。AI药物研发公司Genesis宣布完成2亿美元的B轮融资,以用于推进其先导候选药物进入临床开发,以及扩展发现管线。Genesis公司专有GEMS(Genesis Exploration of Molecular Space)平台旨在通过产生潜在分子进行合成和实验测试,以及AI赋能发现和优化多个循环过程的迭代来加速候选分子选择。目前,该公司已针对不可成药的靶点,建立了一个包含多个项目的内部管线。
医药热点
1.周思源出任CDE主任。8月21日,CDE官网“领导介绍”更新显示:原国家药监局药审中心副主任周思源,已升任国家药监局药审中心主任。根据公开信息,周思源,1982-1990同济医科大学公共卫生学院,医学硕士。2011-2015 国家食品药品监督管理局人事司干部处处长。2015后,任CDE副主任。
2.贵州优化高血压糖尿病报销机制。近期,贵州省医保局印发《关于完善城乡居民高血压糖尿病门诊用药保障机制的通知》,进一步优化经办管理和就医服务。《通知》明确,自10月1日起,取消备案1—3家定点医疗机构的限制,患者在所有医保定点医疗机构都能享受“两病”待遇,同时将“两病”医疗费用直接结算范围由统筹区内扩大到全省,在省内已开通城乡居民“两病”异地联网直接结算的定点医疗机构产生的,与办理病种有关的医疗费用可直接结算。
3.北京卫健委:严禁使用AI自动生成处方。日前,北京市卫健委发布《北京市互联网诊疗监管实施办法(试行)》指出,医疗机构应当对开展互联网诊疗活动的医务人员进行实名认证,确保医务人员具备合法资质。医师接诊前需进行实名认证,确保由本人提供诊疗服务。其他人员、人工智能软件等不得冒用、替代医师本人提供诊疗服务。
评审动态
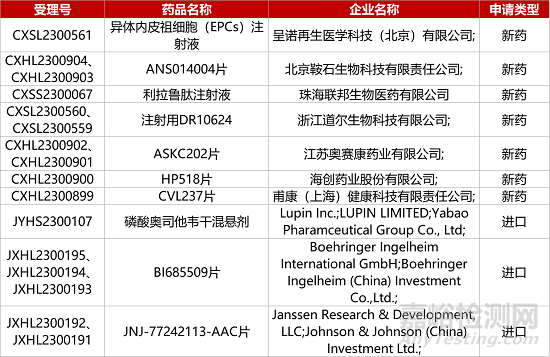
1. CDE新药受理情况(08月22日)
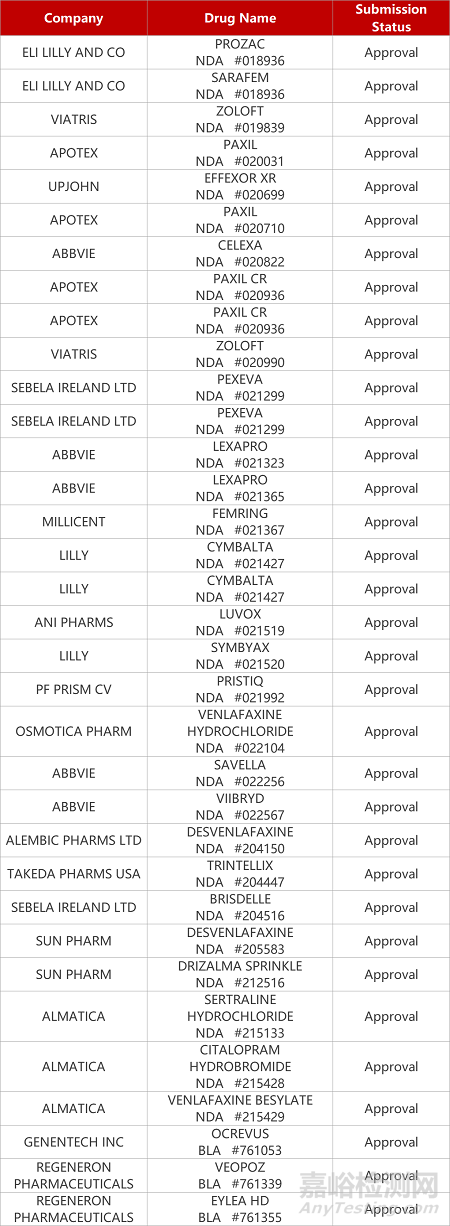
2. FDA新药获批情况(北美08月21日)