多肽偶联药物(PDC)介绍
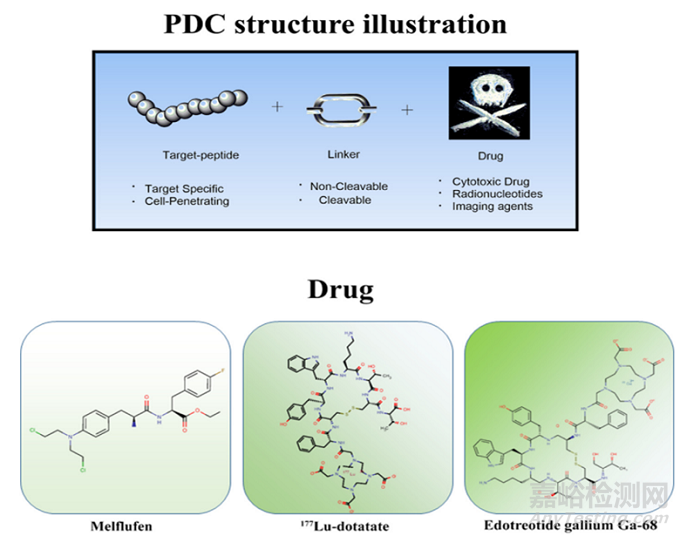
多肽偶联药物(PDC)是一种新兴的靶向治疗方法,可提高肿瘤的穿透性和选择性。PDC主要由三部分组成——多肽(peptide)、连接子(linker)以及具有细胞毒性的有效载荷(cytotoxicity payload)[1]。
图1多肽-药物偶联结构示意图,由不同有效载荷的靶肽、连接体和药物组成
与非靶向抗癌药物相比,PDC可显著延长血液循环时间、增加最大耐受剂量、增强肿瘤积聚和提高抗癌生物活性。因为正常细胞缺乏靶向受体不能与肿瘤靶向肽结合,化合物会在受体阳性肿瘤细胞中富集,可以降低给药剂量,减少毒副作用。另外,PDC还可以依靠多肽的特性来提高药物的溶解性、渗透性和选择性[1]。
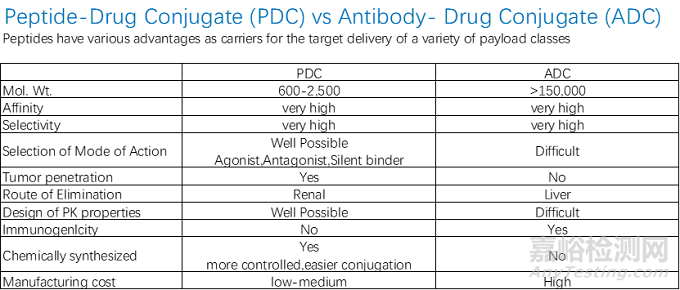
与ADC药物相比,PDC药物具有诸多优势:分子量小,肿瘤穿透性强,对实体瘤抑瘤效果好,且由于体积小,也容易合成单一同质物质;免疫原性低;细胞毒性药物选择面广,由于较强的肿瘤组织渗透性,PDC能够在靶标处累积达到高浓度,因此可以选择阿霉素、紫杉醇等毒性相对较低且普遍应用于临床的化疗药物;另外由于可原核表达或化学合成,PDC生产过程简单且易于规模放大,生产成本较低。因此,PDC有望成为继小分子药物、单抗、ADC药物之后新一代抗肿瘤药[6]。目前,全球已上市2款PDC药物。
图2 PDC与ADC药物对比
多肽偶联药物作用机制
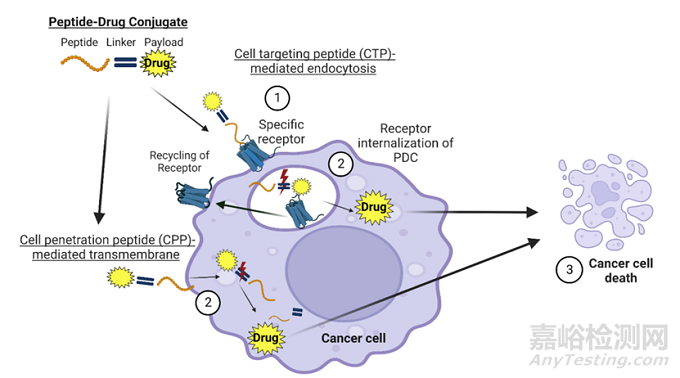
PDC的作用机制与ADC类似,通过连接子将靶向多肽和细胞毒素共价连接,精准靶向肿瘤细胞特定受体,可控释放细胞毒素,从而杀伤肿瘤细胞[2]。在早期研发中,除了PDC整体的药理/药效作用外,还需要对其各个组成部分的药理作用进行研究。
图3 PDC药物的肿瘤细胞内化步骤及作用机制
1、PDC中的多肽
多肽作为PDC的重要组成部分,是实现PDC多种功能的基础。PDC通过连接水溶性多肽或多肽组合可以增加疏水性药物的溶解度和成药性。肽可根据其功能分为:细胞穿透肽 (CPP)、细胞靶向肽 (CTP)和反应肽[5]。细胞穿透肽 (CPP)是指能进入细胞而不破坏其膜完整性的小分子、短分子多肽,一般由5-30个氨基酸组成。细胞穿透肽 (CPP)在生理环境下具有带正电荷和两亲性两种共同特征,在药物递送系统中得到了广泛的应用。
细胞靶向肽 (CTP)有被动靶向和主动靶向两大类。被动靶向是指由于给药系统本身的性质或靶组织的特性,药物与血液循环一起被动地聚集在病灶组织中。主动靶向是通过识别靶组织中特异性表达的受体或蛋白,将药物主动递送至病灶组织来实现的。大多数基于细胞靶向肽 (CTP)的PDC是通过主动靶向机制递送的。反应肽是在外界刺激下发生结构变化的肽,这种变化发生在结构水平上,而不是简单的连接子断裂。通常,外界环境刺激包括温度、pH、酶等,肿瘤微环境的弱酸性也成为靶向肿瘤的新途径[5]。
2、PDC中的连接子
作为 PDC中药物与多肽之间的连接桥梁,连接子决定了 PDC在体内的循环时间和稳定性。理想的连接子应在循环中保持稳定,以避免药物过早释放,同时一旦到达病灶组织,能够快速有效地释放药物。同时,连接子不应影响肽与其受体的亲和力和药物的活性[4]。此外,带有多肽和药物的连接子的合成工艺应尽可能简单,并在整个合成过程中保持稳定。连接子的疏水性不应过强,以防止 PDC因疏水性而聚集,导致体内稳定性差和药效降低,以及较强的全身毒性和免疫副作用。根据药物释放机制和连接物的裂解行为,连接物主要分为不可裂解连接子和可裂解连接子[5]。
2.1 不可裂解连接子
不可裂解连接子是指相对稳定,在血液循环过程中不断裂的连接子。与可裂解连接子相比,不可裂解连接子的最大优点是血浆稳定性好、较低的脱靶毒性、较大的治疗窗和较好的耐药性。不可断裂的连接子一般对外界刺激无反应,而是在肽代谢后释放药物。因此,在到达靶部位之前,不可断裂连接子可以在血液循环中保持稳定[4]。
2.2 可裂解连接子
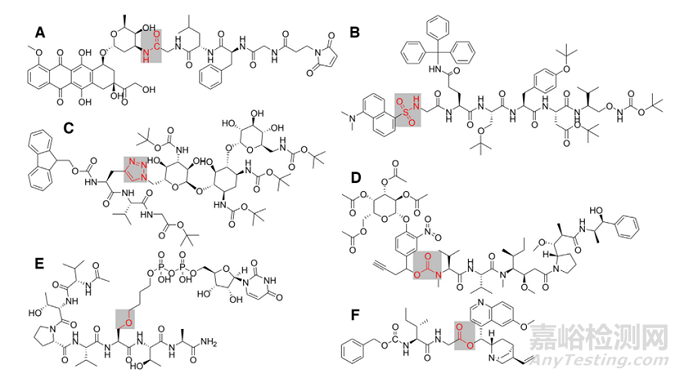
可裂解连接子是 PDC 构建中最常用的连接子,可在机体生理环境或酶存在的情况下裂解释放药物,包括蛋白酶敏感类、PH敏感类、氧化还原敏感类等类型(如图4 )。与不可裂解的连接子相比,这些 PDC最大的优点是可以在靶组织中特异性断裂,快速释放药物达到治疗浓度,降低了对其他组织或器官的毒副作用从而真正实现了智能给药的概念[4]。
图4. 不同可裂解连接子的连接化学键
3、PDC中的有效载荷
PDC的有效载荷是发挥细胞毒性或治疗作用的药物,这些药物大多存在水溶性低、选择性差、半衰期短和稳定性差等缺点,限制了其临床应用[1]。可以使用 PDC策略递送的药物需要有可行的连接位点。此外,药物应以结合形式不具有药理活性,当在病灶组织中释放时,应继续发挥具有明确作用机制和较强药理活性的治疗作用[2]。与多肽偶联后,可增强药物的溶解度,促进药物选择性,延长体内循环时间,优化生物利用度,防止药物对其他组织的副作用和毒性[3]。
PDC方法开发与案例分享
1、PDC方法开发的挑战
PDC的偶联结构特性,导致其体内过程多样,因此,生物分析方法具有一定的复杂性。药代动力学 (PK) 和毒代动力学 (TK) 的研究中主要检测PDC全药、多肽及游离小分子化合物。PDC的毒性作用与多肽、小分子化合物以及连接子的特性密切相关,随着多肽、小分子化合物和连接子的变换,其毒性反应特征也会产生变化。非临床安全性研究中,应关注药物组成结构、药代特征对毒性作用的影响,综合分析试验结果。
PDC药物的特殊结构和作用机制,使其在基质中的稳定性增加了不确定因素,需要考虑到多肽、连接子以及具有细胞毒性的有效载荷的各自稳定性,可添加酶抑制剂、调整PH值、添加氧化还原剂和控制实验环境等解决稳定性问题;PDC在LC-MS/MS中会有不同m/z的多电荷离子对产生,可通过调整流动相的PH值,改变电荷分布,优化仪器参数和液相条件等,使灵敏度满足分析需求;保证PDC在基质中的提取回收率也是至关重要的,应避免前处理时破坏PDC的结构;非特异性吸附和系统残留也是PDC生物分析中常遇到的问题。
2、案例分享
待分析的PDC药物分子量大于4500 g/mol,多肽与细胞毒性化合物通过可裂解连接子连接。为了检测大鼠给药后的血药浓度变化,需要开发一种可靠的生物分析方法来准确定量大鼠血浆中PDC全药的浓度,多肽和游离小分子化合物的生物分析策略与挑战会在后续研究中继续分享。
方法开发中,我们成功克服该PDC药物在血浆中的稳定性和非特异性吸附问题、多电荷的灵敏度问题、回收率和系统残留问题,用蛋白沉淀法成功建立了检测大鼠血浆(含稳定剂)中PDC药物浓度的LC-MS/MS 分析方法,其检测线性范围是 5.00 ~ 2500 ng/mL,r2 > 0.997, 呈良好的线性关系。在准确度和精密度分析批中,每个QC样品浓度水平的平均值准确度在±15.0%以内(LLOQ样品平均准确度偏差在±20.0%以内),每个QC样品浓度水平的精密度值(%CV)不超过15.0%(对于LLOQ不超过20.0%)。在大鼠血浆中加入稳定剂后,能有效的保证在样品处理过程中PDC的稳定性。经分析方法确证和样品分析,证明建立的分析方法稳健且重现性良好。
结语
与ADC药物相比,PDC药物具有强力的肿瘤穿透性、免疫原性低以及生产成本较低等特点,是继ADC之后的下一代靶向治疗药物[6]。目前全球已有两款PDC药物上市,数十款在研PDC进入临床阶段,并在肿瘤治疗中表现出良好的疗效,这预示了PDC药物未来巨大的临床应用前景[3]。
参考文献
1. Peptide-Drug Conjugate: A Novel Drug Design Approach. Curr Med Chem. 2017;24(31):3373-3396.
2. Eirinaios I. Vrettos, Gábor Mező and Andreas G. Tzakos. On the design principles of peptide–drug conjugates for targeted drug delivery to the malignant tumor site. Beilstein J. Org. Chem. 2018, 14:930–954. doi:10.3762/bjoc.14.80
3. Bethany M. Cooper, a Jessica Iegre, a Daniel H. O’ Donovan, et al. Peptides as a platform for targeted therapeutics for cancer: peptide–drug conjugates (PDCs) Chem. Soc. Rev., 2021,50, 1480-1494.
4.Liming Gong , Heming Zhao, Yanhong Liu ,. Research advances in peptide‒drug conjugates. Acta Pharmaceutica Sinica B. Received 26 November 2022; received in revised form 5 February 2023; accepted 15 February 2023
5.Chen Fu, Lifeng Yu, Yuxi Miao, et al. Peptide-drug conjugates(PDCs): a novel trend of research and development on targeted therapy, hype or hope?. Acta Pharmaceutica Sinica B, 2023, 13(02):498-516.
6.Peptides as a platform for targeted therapeutics for cancer: peptide–drug conjugates (PDCs). Chem. Soc. Rev., 2021, 50, 1480-1494.