法规要求
《动物源性医疗器械注册技术审查指导原则(2017年修订版)》指出,某些医疗器械可能含有动物来源的材料,这些材料是多种多样的,可以构成该器械的主要部件(例如牛/猪源心脏瓣膜、羊肠缝合线、止血材料等)、涂层或者浸渗剂(例如肝素、明胶、胶原等),也可成为生产过程中所用的辅助材料(例如牛脂等)。对于动物源性医疗器械,研究资料需增加涉及控制病毒和/或传染性因子(细菌、霉菌、酵母菌、寄生虫、病毒、TSE因子以及未被分类的病原体)感染以及免疫原性风险方面有关的技术内容,如对生产过程中灭活和去除病毒和/或传染性因子工艺过程的描述及有效性验证数据或相关资料。
YY 0970 及 ISO 14160提出,医疗器械最常使用的灭菌方式有湿热、干热、辐照和环氧乙烷灭菌,部分动物源性医疗器械可能适用于以上灭菌方式。但另一些医疗器械需于灭菌后保持组织所需物理性能,如生物心脏瓣膜或组织补片,则不适用传统灭菌方式,而更常使用液体化学灭菌。
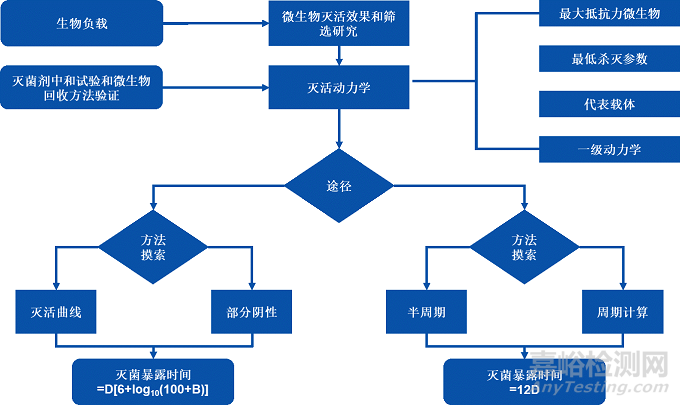
2023年03月14日,YY 0970更新发布,除标准名称、法规依据、名词调整外,最关键的技术细节有较多补充,其中变化较大、补充内容较多的为2023版本附录B《应用指南》(更新自2013版本附录A《指南》)章节,关于微生物杀灭效果、过程定义和微生物性能鉴定流程在2023版本中有了详细的描述(见下图),对如何达到法规要求提供了适合的方法和建议:
液体化学灭菌验证测试项目:
方法确认:
NO.1 生物负载回收率试验
评估筛选试验、灭活动力学试验等所用的生物负载测试方法的采集回收效率。
NO.2 中和鉴定试验
确保筛选试验、灭活动力学试验等所用的中和方法能有效地去除灭菌剂的抗菌性(中和效力试验),同时又不削弱微生物活力的恢复(中和毒性试验)。
NO.3 抑菌试验
确保半周期灭菌验证所用的中和方法能有效地中和/去除灭菌剂的抗菌性(中和效力试验),同时又不削弱微生物活力的恢复(中和毒性试验)。
过程确认:
NO.1 产品生物负载试验
测试产品上微生物的数量和/或种类,适用时,选取产品上的分离株进行筛选试验。
NO.2 菌株筛选试验
使用产品的生物负载、生产环境中的分离株、从菌种保藏中心获得的高抗微生物作为供试微生物。评估最差灭菌条件下供试微生物对灭菌剂的抗性。筛选得到对灭菌过程抗性最高的微生物,作为本灭菌过程的生物指示剂。
NO.3 灭活动力学
使用灭菌剂的下限浓度、下限pH和下限温度,旨在建立最差灭菌条件下,灭菌时间与高抗力微生物灭活动力学的数学关系,建立微生物灭活曲线,以计算供试微生物的D值。
NO.4 半周期灭菌验证
接种一定数量的高抗力微生物,使用下限灭菌剂浓度和下限温度进行半周期灭菌。
NO.5 全周期灭菌验证
使用上限灭菌剂浓度、上限灭菌温度、上限灭菌pH值和上限灭菌时间,旨在评价灭菌剂在灭菌过程中的是否存在浓度、pH变化,以及灭菌剂对材料的影响。
NO.6 二次灭菌确认
使用经过一次全周期灭菌的样品,其他同全周期灭菌验证,旨在评价当日常灭菌过程中出现灭菌失败时,产品进行二次灭菌后,产品性能依然符合技术要求。