医疗器械常用的包装设计验证标准有哪些呢,企业产品应该用哪一个标准比较合适?这些是小伙伴们困惑的地方,在不确定的情况下,如何快速了解包装系统的设计验证方法和思路呢?下面小编就给大家简单介绍一下,主要还是根据医疗器械产品的特性选择包装形式。
1、包装系统设计的要求
对于医疗器械产品,包装系统的设计开发应考虑许多因素,包括但不仅限于顾客要求、产品的质量和结构、物理和其他保护的需要、产品对特定风险的敏感性,如辐射湿度、机构振动、静电等、每包装系统中产品的数量、包装标签要求、环境限制、产品有效期限的限制、流通、处理和贮存环境、灭菌适应性和残留物。
对于包装首先要考虑的就是灭菌特性,包装材料的微生物屏障特性对保持包装的完整性和产品的安全性至关重要,包装材料分为不透气性材料和透气性材料两大类。
最终灭菌医疗器械包装有两个标准,分别是GB/T 19633.1-2015最终灭菌医疗器械包装 第1部分:材料、无菌屏障系统和包装系统的要求,GB/T 19633.2-2018最终灭菌医疗器械包装 第2部分:成形、密封和装配过程的确认的要求。
2、包装系统试验的要求
无菌屏障系统的完整性应在灭菌后进行性能试验,可用物理试验、透气性包装材料的微生物屏障试验,来确定无菌屏障系统保持无菌状态的能力。
无菌屏障系统通过稳定性试验来证明始终保持其完整性,稳定性试验采用实际时间老化方案来进行,实际时间的老化试验和加速老化试验建议同时开始。
注意:稳定性试验和性能试验是两个不同的试验。性能试验是评价在经受生产、灭菌过程、搬运、存储和运输环境后包装系统和产品之间的相互作用。稳定性试验主要是确定医疗器械产品的有效期。
GB/T 19633.1-2015附录B 给出了最终灭菌医疗器械包装 第1部分要求的试验和参考标准。
GB/T 19633.1-2015附录C给出了不透气型材料的阻气体通过的试验方法,证实材料是不透气性材料后,就意味着满足微生物屏障要求。
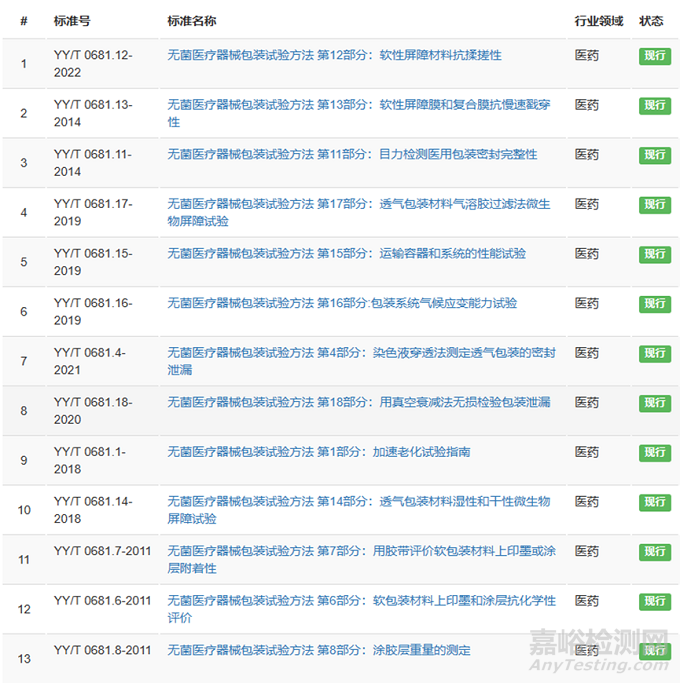
对于最终灭菌医疗器械包装材料参考YY/T 0698系列标准。
对于无菌医疗器械包装试验方法 参考YY/T 0681系列标准。
3、包装系统模拟运输验证要求
无菌医疗器械包装运输性能的试验一般通过模拟运输实验来进行,通过模拟产品实际的物流环境条件,选择合适的测试项目和等级开展测试,医疗器械包装运输验证标准有两个系列,分别是ISTA 2A/3A/3B/3E和 ASTM-D4169系列。
ISTA 2A :适用于质量不超过1501b(68kg)的单包装,ISTA 2A测试程序包括环境平、大气调节、抗压、振动(固定位移振动或随机振动)、冲击(自由跌落或斜面冲击)。
ASTM-D4169:适合国内外注册,标准中有分DC1-DC18,每个系列的内容都根据产品的尺寸重量来决定 ,一般用DC13的较多。
对于包装系统运输模拟验证标准的选择,具体还要参考产品实际和法规要求综合考虑。
综上所述,根据医疗器械产品的特性选择包装形式,并进行合理正确地验证确认,才能保障医疗器械包装系统的有效性和完整性。