今日头条
翰森引进口服抗真菌新药报产。Scynexis公司与翰森制药开发的葡聚糖合成酶抑制剂枸橼酸艾瑞芬净片(ibrexafungerp,HS-10366)的新药上市申请获CDE受理。ibrexafungerp是一款新型口服抗真菌药物,此前已获FDA批准上市,用于治疗外阴阴道念珠菌病(VVC),以及用于治疗复发性外阴阴道念珠菌病(RVVC)。据查询,艾瑞芬净已在中国完成一项治疗外阴阴道念珠菌病的Ⅲ期临床。
国内药讯
1.君实PD-1单抗报广泛期肺癌NDA。君实生物PD-1单抗特瑞普利单抗注射液(商品名:拓益)第10项适应症上市申请获CDE受理,用于治疗广泛期小细胞肺癌(SCLC)。在III期EXTENTORCH研究中,与安慰剂联合化疗相比,特瑞普利单抗联合化疗显著延长患者的无进展生存期(PFS)和总生存期(OS)。特瑞普利单抗是我国首个国产PD-1单抗,目前已在中国获批6项适应症。
2.再鼎PARP抑制剂卵巢癌Ⅲ期临床见刊。再鼎医药从Tesaro公司(后被GSK收购)引进的PARP抑制剂则乐(尼拉帕利)在JAMA Oncology上发表用于中国晚期卵巢癌患者一线维持治疗的Ⅲ期临床(PRIME)积极结果。与安慰剂相比,尼拉帕利维持治疗显著延长PFS(中位PFS:24.8个月vs8.3个月),使疾病进展或死亡风险降低55%。再鼎拥有该产品在中国内地、香港和澳门地区的开发和商业化授权。
3.必贝特PI3K/HDAC抑制剂拟纳入优先审评。必贝特医药1类新药注射用BEBT-908(注射用双利司他)获CDE拟纳入优先审评,用于至少经两种系统治疗的复发或难治弥漫性大B细胞淋巴瘤(r/r DLBCL)成人患者。BEBT-908是一款双靶点PI3K和HDAC抑制剂,可选择性抑制肿瘤赖以生存的核心靶点,协同性破坏肿瘤信号通路,抑制肿瘤细胞生长。此前,CDE已将该新药纳入突破性治疗品种。
4.苏州星济抗MRSA新药获批临床。星济生物1类生物制品注射用XJ101获国家药监局临床试验默示许可,拟用于治疗金黄色葡萄球菌血流感染,包括甲氧西林敏感金黄色葡萄球菌(MSSA)和耐甲氧西林金黄色葡萄球菌(MRSA)引起的菌血症、败血症和脓毒症等。XJ101是一款重组人源化单域抗体-Fc融合蛋白,已在临床前研究中显示出体外对金黄色葡萄球菌包括MRSA均具有较强的中和活性。
5.科伦博泰TROP2-ADC报新IND。科伦博泰1类生物制品"注射用SKB264"的新适应症临床试验申请获CDE受理。SKB264是一款采用专有毒素-连接子策略研发的靶向TROP2的创新ADC,正在中国、美国、加拿大等多个国家进行临床开发。此前,该产品已被CDE纳入三项突破性疗法认定,用于治疗局部晚期或转移性三阴乳腺癌,治疗EGFR-TKI经治、局部晚期或转移性EGFR突变非小细胞肺癌,以及治疗至少二线系统化疗经治的局部晚期或转移性HR+/HER2-的乳腺癌。
6.普米斯与BioNTech公司达成战略合作。BioNTech公司与普米斯生物达成全球合作许可协议,将获得后者用于恶性肿瘤的一款临床前双抗药物和一款临床期单抗的全球独家选择权。普米斯生物正在推进超过20个1类生物新药,靶点包括PD-L1+TGFβ、PD-L1+VEGF、TIGIT+PVRIG、4-1BB+PD-L1、CD73、EGFR+cMET、TIGIT等。根据协议,普米斯生物将获得预付款,进一步开发、注册和商业里程碑潜在付款以及分级销售提成。
国际药讯
1.K药联合同步放化疗宫颈癌Ⅲ期临床积极。默沙东PD-1疗法Keytruda(pembrolizumab)联合同步放化疗治疗新诊断的高风险局部晚期宫颈癌的Ⅲ期试验(KEYNOTE-A18)达到无进展生存期(PFS)主要终点。由独立数据监测委员会(IDMC)评估,与单独同步放化疗相比,Keytruda联合治疗显著提高患者的PFS;另一个主要终点总生存期(OS )也显示改善趋势。详细结果将公布于医学会议上。
2.Acumen公司AβOs单抗早期临床积极。Acumen公司靶向毒性可溶性β淀粉样蛋白寡聚体(AβOs)的单抗药物ACU193,在治疗早期阿尔茨海默病(AD)患者的Ⅰ期临床获积极结果。大脑淀粉样蛋白PET扫描结果显示,较高剂量ACU193治疗12周后。患者淀粉样蛋白斑块水平显著降低;最常见的治疗后出现不良事件为ARIA。ACU193药代动力学特征支持每月一次给药的用药方案。
3.安博PSMA-ADC获FDA快速通道资格。Ambrx公司靶向前列腺特异性膜抗原(PSMA)的抗体偶联药物(ADC)ARX517获FDA授予快速通道资格,用于治疗接受雄激素受体通路抑制剂治疗后疾病进展的转移性去势抗性前列腺癌(mCRPC)。在Ⅰ期临床(APEX-01)中,与基线相比,ARX517(2.0mg/kg)降低队列6患者(n=3)的前列腺特异性抗原(PSA)水平超过50%,其中2例患者PSA水平下降程度超过90%,药物总体耐受性良好。
4.AZ/第一三共HER2-ADC启动新III期临床。阿斯利康与第一三共开发的HER2-ADC新药Enhertu(trastuzumab deruxtecan,DS-8201)在clinicaltrials.gov登记启动一项IIIb期开放标签研究 (DESTINY-Breast15),拟评估用于不可切除/转移性HER2低表达或HER2免疫组化(IHC) 0(包括HR阴性和HR阳性的患者)乳腺癌的治疗效果。今年3月,基于III期DESTINY-Breast04研究结果,该新药获批日本上市,用于治疗HER2低表达(IHC 1+或IHC 2+/ISH-)不可切除或转移性乳腺癌经治患者。
5.补体C3抑制剂报告6例视网膜血管炎事件。美国视网膜专家协会日前宣布,Apellis公司的补体C3疗法Syfovre(Pegcetacoplan)在治疗时出现眼部炎症病例,其中6例出现闭塞性视网膜血管炎(炎症可能致盲)。事故原因尚不清楚,他们敦促“警惕和报告任何与治疗相关的不良事件”,并在服用Syfovre后进行“密切随访”。目前,该新药已在美国获批用于治疗阵发性睡眠性血红蛋白尿症,和地图样萎缩。
6.诺华2023H1总营收266亿美元。7月18日,诺华发布2023年二季度财报,上半年营收265.75亿美元,同比增长8%。创新药收入上半年净销售额为218.13亿美元(+8%),主要来自于Entresto(沙库巴曲缬沙坦钠),Kesimpta(奥法妥木单抗),Kisqali(瑞波西利)以及Pluvicto等产品强劲增长的推动。Entresto已晋升为诺华最畅销药物,上半年销售额29.15亿美元(+35%),预计全年超过60亿美元。
医药热点
1.国家儿童医学中心儿童意外伤害中心揭牌。7月19日,国家儿童医学中心儿童意外伤害中心在北京儿童医院正式揭牌成立。未来,国家儿童医学中心将成立儿童意外伤害预防专家团队、设计开发培训课程、开展科普讲座和宣传等活动,重点针对中小学及幼儿园开展形式多样的儿童意外伤害预防综合干预,积极开展儿童意外伤害相关临床研究,探索适合中国的儿童意外伤害预防模式,并向全国推广。
2.福州市第一总医院整形外科中心成立。7月19日,福州市第一总医院整形外科中心正式成立,授牌仪式在福州市第一总医院皮肤病防治院召开。福州市第一总医院整形外科中心旨在依托总医院平台,融合皮肤病防治院整形外科,达道院区整形烧伤与创面修复科、口腔科,儿童院区烧伤整形科的优势,建立福州市第一总医院皮肤病防治院、达道院区、儿童院区间的绿色转诊通道和协同对接机制,达到资源共享、优势互补、共同发展的目的。
3.美国每年近80万人因误诊死亡或终身残疾。美国约翰斯·霍普金斯大学下属研究所的一项最新研究报告显示,美国各级医疗机构出现误诊的几率为11%,其中,中风、败血症、肺炎、血栓和肺癌等五大疾病的整体误诊率较高;美国各级医疗机构每年因误诊造成37.1万人死亡,42.4万人终身残疾,人数之多已达到“公共卫生紧急事件”的程度。
评审动态
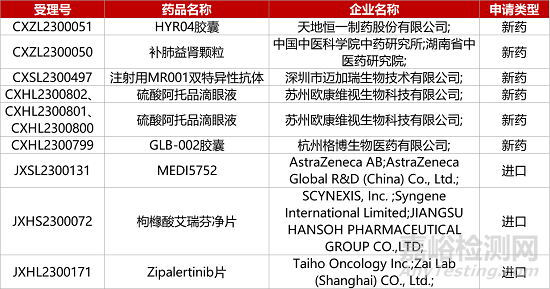
1. CDE新药受理情况(07月20日)
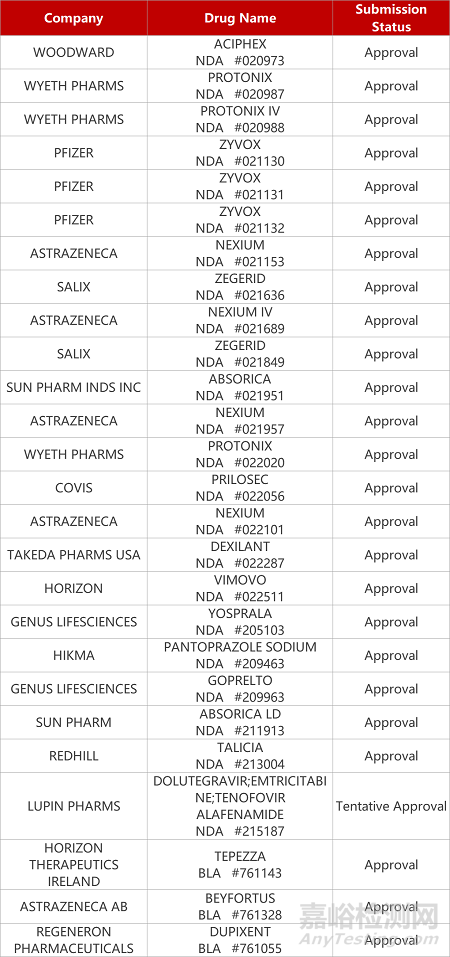
2. FDA新药获批情况(北美07月18日)