今日头条
华东医药利拉鲁肽获批减肥适应症。华东医药旗下利拉鲁肽注射液(利鲁平®)获国家药监局批准新适应症,用于肥胖或超重患者。这是一款GLP-1R激动剂,由诺和诺德原研开发,临床主要用于改善成人2型糖尿病(T2DM)的血糖控制,以及用于肥胖或体重超重患者的治疗。今年3月,利鲁平®已获NMPA批准上市,用于成人2型糖尿病患者控制血糖,成为首款获批上市的国产利拉鲁肽注射液。
国内药讯
1.绿叶戈舍瑞林长效微球获批上市。绿叶制药自主研发的注射用戈舍瑞林微球(LY01005)获国家药监局批准上市,用于前列腺癌患者的治疗。LY01005是一种基于创新微球技术开发的促性腺激素释放激素激动剂,以肌肉注射的方式每28天给药一次,能有效控制睾酮至去势水平,疗效与对照药物相当。目前,该产品治疗乳腺癌适应症的上市申请正处于审评阶段。
2.艾伯维JAK1抑制剂获批治疗克罗恩病。艾伯维JAK1抑制剂乌帕替尼缓释片(商品名:瑞福)获国家药监局批准新适应症,用于治疗对一种或多种肿瘤坏死因子(TNF)抑制剂应答不佳或不耐受或禁忌的中重度活动性克罗恩病成人患者。在两项诱导研究(U-EXCEED和U-EXCEL)以及U-ENDURE维持研究中,Rinvoq治疗组患者达到临床缓解与内镜缓解的比例显著更多。这是该产品在华获批的第5个适应症。
3.三生制药新机制止痒药获批上市。三生制药与东丽株式会社联合开发的盐酸纳呋拉啡口腔崩解片(TRK-820,日本商品名:REMITCH)获国家药监局批准上市,用于改善血液透析患者现有治疗疗效不理想的瘙痒症。TRK-820是一款选择性阿片κ受体激动剂,通过与现有的抗组胺药或抗过敏药完全不同的新的作用机制发挥止痒作用。三生制药拥有在中国除香港、澳门及台湾以外的地区开发及商业化TRK-820口腔崩解片制剂配方的独家权利。
4.和誉EGFR Exon20ins抑制剂获批临床。和誉医药新一代EGFR Exon20ins抑制剂ABSK112获FDA批准,即将开展针对非小细胞肺癌(NSCLC)的国际首次人体Ⅰ期临床,评价药物的安全性、耐受性、药代动力学(PK)和初步抗肿瘤活性。ABSK112具有高脑渗透性和广泛Exon20ins突变覆盖谱等特点,已在临床前研究中多种EGFR Exon20ins突变、小鼠肿瘤模型中显示出积极的体内药效,具备成为新一代EGFR Exon20ins抑制剂的潜力。
5.加科思KRAS G12C抑制剂获批胰腺癌临床。加科思自研KRAS G12C抑制剂格来雷塞(JAB-21822)获国家药监局批准,开展一项单臂、开放研究,评估用于KRAS G12C突变的二线或以上胰腺癌患者的疗效及安全性。JAB-21822可以将KRAS p. G12C锁定在非活化状态,阻断KRAS向下游的信号转导,从而发挥抗肿瘤作用。去年年底,JAB-21822已被CDE纳入突破性治疗品种,针对的适应症为携带KRAS p. G12C突变的局部晚期或转移性非小细胞肺癌患者。
6.康方CLDN18.2/CD47双抗报IND。康方生物1类生物制品AK132注射液临床试验申请获CDE受理。AK132是一款CLDN18.2/CD47双抗,同时特异性结合CLDN18.2/CD47分子,具有协同抗肿瘤的潜力。此前,国内已有两款同类产品BC007(宝船生物)和SG1906(尚健生物)获批临床,两款新药正在中美两国同步进行临床开发,分别评估用于晚期实体瘤的治疗潜力。
国际药讯
1.益普生石人综合症新药获FDA推荐批准。FDA内分泌和代谢药物咨询委员会推荐批准益普生选择性RARγ激动剂palovarotene上市,用于治疗进行性肌肉骨化症(FOP,也称为“石人综合征”)。Ⅲ期临床(MOVE)结果显示,与未经治疗组患者相比,palovarotene组患者的异位骨化比率下降了62%。如果获批,palovarotene将成为FDA批准的首个治疗FOP的药物。
2.武田ADAMTS13重组蛋白Ⅲ期临床积极。武田重组ADAMTS13蛋白TAK-755用于预防性治疗先天性血栓性血小板减少性紫癜(cTTP)的国际Ⅲ期临床中期结果积极。与基于血浆的疗法相比,TAK-755降低血小板减少事件的发生率60%(95% CI,30%-70%);与治疗相关的不良事件发生率也显著更底(10.3%与50%)。没有患者在接受TAK-755预防性治疗期间发生急性TTP事件。今年5月,FDA已授予TAK-755用于预防和治疗cTTP的优先审评资格。
3.IL-31Rα单抗结节性痒疹III期临床积极。Galderma公司靶向IL-31受体α的“first-in-class”单抗Nemolizumab在WCD大会上公布用于结节性痒疹患者的关键III期OLYMPIA 2研究最新结果。数据显示,接受nemolizumab单剂量治疗第4周后就有19.7%的患者达到无痒状态(每周平均瘙痒峰值数字评定量表(PP-NRS)评分<2),而安慰剂组仅有2.2%(p<0.0001)。此前,Galderma已在AAD2023年会上公布III期OLYMPIA 2研究达到所有主要终点和关键次要终点的详细数据。
4.GSK肺结核疫苗Ⅲ期临床获超5亿美元资助。惠康基金会(Wellcome)和比尔及梅琳达·盖茨基金会宣布提供资金,以支持葛兰素史克与Aeras公司和国际艾滋病疫苗行动组织(IAVI)共同开发的结核病(TB)候选疫苗M72/AS01E开展Ⅲ临床试验。在Ⅱb期临床中,该疫苗显著降低HIV阴性、潜伏性结核感染成人患者的TB发病率,在接种后3年内的疫苗效力为50%。
5.强生口服IL-23R抑制剂银屑病II期临床积极。强生口服IL-23R抑制剂JNJ-77242113(PN-235)在第25届世界皮肤病学大会上公布用于治疗中重度斑块状银屑病的II期FRONTIER 1研究积极结果。与安慰剂相比,JNJ-77242113治疗组第16周时达到PASI75(银屑病面积和严重程度指数改善≥75%)的患者比例显著更高(25mg QD 37.2%,50mg QD 58.1%,25mg BID 51.2%,100mg QD 65.1%,100mg BID 78.6%,安慰剂组为9.3%);两组发生不良事件的发生率相似。
6.Baudax Bio公司收购Treg细胞疗法公司。Baudax Bio公司宣布收购一家Treg细胞疗法研发公司Teralmmune,并获得该公司临床早期下一代自体FVIII TCR-Treg细胞疗法候选药物TI-168,以及神经肌肉阻断(NMB)产品组合(BX1000和BX2000)。消息传出后,Baudax Bio股价于6月30日飙升近125%。2022年10月,FDA已批准TI-168开展Ⅰ/Ⅱa期临床试验,以评估用于治疗患有血友病伴抑制物的先天性血友病A(HA)患者的潜力。
医药热点
1.2023年医保药品目录调整方案公布。近日。国家医保局发布《2023年国家基本医疗保险、工伤保险和生育保险药品目录调整工作方案及申报指南的公告》,正式确定了今年国家医保目录调整工作的方案及申报指南。《方案》明确,2018年1月1日以后获批上市或修改适应证的药品可以提出申报。同时考虑到疫情防控形势的变化,不再单列新冠治疗药品的申报条件,该类药品可通过条件正常申报。本次网上申报的时间为7月1日9点至7月14日17点。
2.AI医生与三甲医院医生诊断医学一致性达到96%。6月30日,医联于成都与北京两地举行了国内首次AI医生与真人医生的一致性评测,并进行了全天候实时直播。结果显示,医联MedGPT驱动的AI医生与三甲主治医生在评测比分结果上的一致性达到了96%之高,被评审专家认为结果“超出预期”。
3.欧洲军团病患病概率增至历史最高。当地时间7月3日,欧洲疾病预防与控制中心发布的最新统计数据显示,欧盟和欧洲经济区国家2021年每10万人口中有2.4人罹患军团病,已激增至历史最高水平 。欧洲疾控中心表示,军团病激增的原因仍不清楚,这可能与国家检测政策和监测系统的变化、人口老龄化以及建筑供水系统的设计、基础设施的建设和维护等因素相关。该机构提醒欧洲各国应对此保持警惕。
4.英国医生持续罢工。综合英媒报道,英国苏格兰地方政府首席大臣胡穆扎·优素福当地时间3日表示,初级医生大罢工将会对苏格兰地区的国家医疗服务体系(NHS)带来“重大破坏”。据英国广播公司(BBC)报道,当地英国医学协会(BMA)的初级医生们是在拒绝了未来两年涨薪14.5%的选择后,决定在7月12日到15日再次进行罢工,以表达不满。因为他们此前提出的涨薪23.5%的诉求并未得到满足。
评审动态
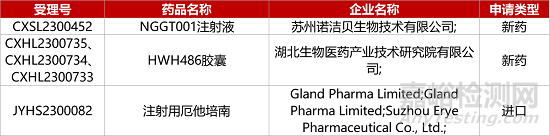
1. CDE新药受理情况(07月05日)
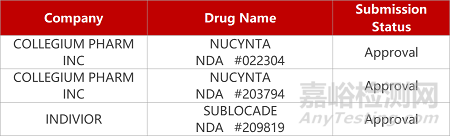
2. FDA新药获批情况(北美07月03日)