摘 要Abstract
疫苗国家监管体系(NRA)评估是疫苗预认证工作的重要组成部分,是对国家监管能力评估的关键手段。我国疫苗监管体系于2022 年第三次通过世界卫生组织(WHO)评估,达到3 级成熟度水平。本文主要介绍了NRA 评估内容及在评估中使用的全球基准评估工具,重点阐述其中临床试验监管(CT)板块的指标设置和评价要求等,并结合第三次NRA 评估情况简述近年来我国临床试验监管工作的开展和完善情况,此外,还根据CT 板块评估要求进一步分析了目前临床试验监管方面尚待改进的问题。
The WHO's assessment of the national regulatory system for vaccines is an important part of vaccine prequalification and a key means of assessing national regulatory capacity. China's vaccine regulatory system reached level 3 maturity in the third WHO assessment in 2022. This article introduces the content of NRA assessment and the benchmarking tools used in the evaluation, focusing on the indicator setting and assessment requirements of the clinical trial oversight functions. It also describes the development and improvement of China's clinical trial regulatory system in recent years based on the third NRA evaluation, and further analyzes the issues that still need improvement in clinical trial supervision according to the requirements of the clinical trial oversight functions.
关键词Key words
疫苗;国家监管体系评估;全球基准评估工具;临床试验监管
vaccine; national regulatory authority assessment; GBT; clinical trial oversight
世界卫生组织(World Health Organization, WHO)向联合国儿童基金会和其他采购疫苗的国际机构提供疫苗预认证(Prequalification,PQ) 服务,以确保使用的疫苗是安全和有效的[1]。通过该项工作,国际机构每年向全球10 岁以下儿童提供25 亿剂通过预认证的合格疫苗,有65% 的婴儿因此获益[2]。疫苗预认证工作有赖于疫苗生产国家的监管机构与WHO 之间的密切协作,一方面,国家监管机构通过WHO 国家监管体系(National Regulatory Authority,NRA)评估是开展预认证工作的先决条件,只有国家监管机构被认定为具有成熟功能的NRA,该国疫苗生产商才能申请WHO 的预认证;另一方面,国家监管机构的审评审批、监督检查等监管职能可帮助WHO 简化疫苗预认证工作程序,为其提供关键支撑[1]。
我国疫苗监管体系曾于2011年、2014 年两次通过WHO 疫苗NRA 评估,2022 年8 月23日,WHO 宣布我国再次通过最新一轮评估[3],我国监管机构连续通过评估,表明我国疫苗监管体系运行稳定,符合国际标准且能够不断提升,既可为本国居民提供良好的公共卫生保障产品,也为我国疫苗走出国门,供应全球,促进发展中国家的疫苗可及性做出贡献。在历次NRA 评估中,临床试验监管(Clinical Trials Oversight, CT)板块均取得了令人满意的成绩,说明我国在疫苗临床试验方面可持续符合国际标准,为上市疫苗的有效性和安全性提供坚实的基础。
本文简要介绍了2022 年NRA 评估使用的评估工具及其发展历史,详述该工具中CT 板块的具体评价指标和评价内容。同时笔者根据本次NRA 评估中CT板块的评估情况,进一步结合临床试验监管体系工作职责和近年来药品审评审批制度改革的重要成果,分析我国临床试验监管工作的开展和完善情况,以期为后续工作提供借鉴。
1、NRA 评估概况
1.1 NRA 评估工具及评估指标
疫苗国家监管体系包括执行监管职能的组织机构、监管框架和工作流程以及所需的资源等。1997 年WHO 发布了包含一系列指标的NRA 评估工具,该工具不断迭代, 基于这套评估工具WHO 对150 多个国家的监管机构进行了基准测试[4],包括我国于2011 年和2014 年的开展的两次NRA 评估。2013 年起,WHO 对内部和外部的一系列评估工具进行了摸底, 以开发一个真正的全球基准评估工具(Global Benchmarking Tool,GBT),最大限度地发挥监管成果并减轻监管机构的负担。GBT由一系列结构化的指标、亚指标组成,2022 年评估使用的GBT( 发行于2018 年11 月, 版本号:修订VI 第1 版)[4] 包括国家监管体系(National RegulatorySystem,RS) 下的八项监管职能, 分别为注册和上市许可(Registration and Marketing Authorization,MA)、药物警戒(Vigilance,VL)、市场监管(Market Surveillance and Control,MC)、机构许可(Licensing Establishments,LI)、监督检查(Regulatory Inspection,RI)、实验室检验(Laboratory Testing,LT)、临床试验监管(Clinical Trials Oversight,CT)及批签发(NRA Lot Release,LR),共9 个板块,268 个亚指标。与境内既往评估中使用的工具相比,增加了2 个板块和86 个亚指标,评估内容更加全面和严格。
1.2 成熟度水平及评估要求
GBT 进一步引进了成熟度水平(Maturity Level,ML) 的概念对监管体系的评估结果进行评分,成熟度分为4 个级别:ML1代表存在某些基本要素的监管系统;ML2 代表部分履行基本监管职能的不断发展的国家监管体系;ML3 代表稳定、运行良好和集成的监管系统;ML4 代表以高级性能和持续改进水平运行的监管系统[5]。GBT 中的268 个亚指标包括:ML1 级亚指标28 个、ML2级亚指标32 个、ML3 级亚指标151 个、ML4 级亚指标57 个[4]。评估时根据各亚指标打分情况综合确定监管机构最终的成熟度评定等级。评估应以ML3 级为目标,需要所有ML1 和ML2 亚指标以及不少于90% 的ML3 亚指标达到完全实施。截至2020 年11 月WHO 的194 个会员国中仅有27% 的监管当局达到ML3或ML4[5]。
2、CT 板块评估
2.1 CT 板块评估指标分析
CT 板块在2011 年、2014年和2022 年三次评估中均作为独立的监管职能板块参评。既往的NRA 评价工具中,CT 板块包含6 项主指标,分别为监管体系、质量管理体系、人力资源、临床试验提交内容、临床试验评估、伦理,下设26 个亚指标,WHO评估专家以YES 或NO 对亚指标给出评分。
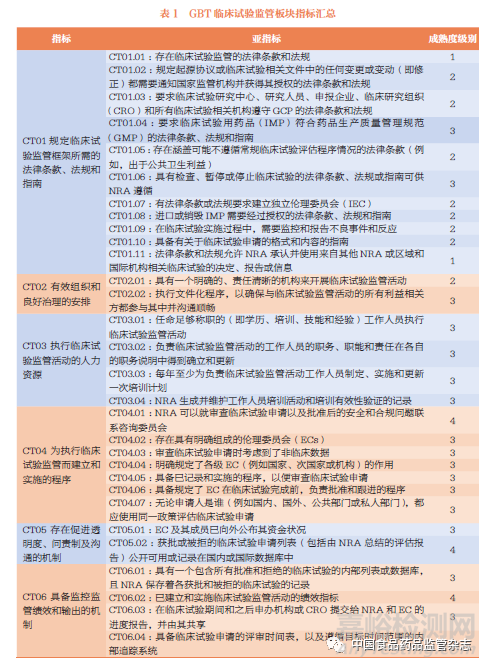
2022 年评估使用的GBT 中CT 板块仍包含6 个主指标,依次为监管法律法规、监管框架、人力资源、监管程序、透明度和绩效评价, 下设30 个亚指标,包括ML1 级亚指标2 个、ML2级亚指标8 个、ML3 级亚指标17 个、ML4 级亚指标3 个, 见表1。WHO 专家评估时将对各亚指标按完全实施、部分实施、正在实施、未实施及不适用分别打分。
表1 所示的现行GBT 中CT板块内容包含了整个临床试验监管的全流程和多层面的评价要求,以下根据各指标的设置情况详细阐明CT 板块的评估要求和内容。
CT01 主指标为规定临床试验监管框架所需的法律条款、法规和指南,从法律法规体系层面对临床试验监管的各个方面提出要求, 旨在保护临床试验受试者的权利, 确保临床试验的设计、实施基于科学和合理的目的。CT01 主指标下设11 个亚指标,明确了监管主体和监管范围应事先取得的法律授权;展示了法律法规所授权的监管范围应涵盖临床试验申请和实施的全过程,根据亚指标设置主要包括临床试验的变更、GCP 和伦理委员会、临床试验用药品监管、加快审批程序(如疾病大流行期间加快临床试验审批)、报告和监控不良反应、检查、暂停或终止临床试验等方面。
CT02 主指标为有效组织和良好治理的安排,主要指的是执行监管活动的组织架构和职责定位。根据其亚指标的分项要求,应明确临床试验监管体系中所涉及的各个组织及其职责,既包括来自监管机构内部的组织,也包括可能参与的外部组织,同时还应有相关的规范性文件,使各相关方在整个监管活动中可以保持顺畅有效的沟通联系。
CT03 主指标为执行临床试验监管活动的人力资源,其亚指标主要涉及人力资源的配置和发展两个层面,即首选具备充分且获得合理安排的人员以满足监管活动要求,进而对人员开展有计划的培训,并通过培训记录和考核结果验证培训的有效性。
CT04 主指标为执行临床试验监管而建立和实施的程序,旨在确保监管活动的各个步骤可按照既定程序规范化开展。对于监管机构来说,包括临床试验监管活动需要审查的数据、所使用的技术标准、审查程序(包括可能使用的内外部专家委员会)等要素。笔者认为,监管机构应制定并公开临床试验评估的数据要求和技术标准等内容,同时对于审评的具体流程,也应在内部通过制定并实施管理规范和程序细则等文件进行全程管理,以确保所有的临床试验评价活动均合法、公正和尺度统一。此外,由于伦理委员会(Ethics Committee,EC)全程参与临床试验监管,该部分指标也包含EC 的设立、组成和职责、程序等方面内容。
CT05 主指标为存在促进透明度、问责制及沟通的机制,主要涉及EC 的独立性和临床试验评估情况公开。
CT06 主指标为具备监控监管绩效和输出的机制,主要指的是临床试验质量管理和绩效指标。该主指标涉及两个层面,一是设立临床试验监管活动的数据系统,记录和保存监管活动的内容、实施过程和结果等,以便对监管活动开展追踪和评价;二是设立监管活动相关的质量管理系统和绩效指标,以评估监管活动的可靠性和一致性。
2.2 GBT 中CT 板块评估指标的完善和发展
现行GBT 与2011 年和2014年使用的评估工具相比,在临床试验监管职能方面主要有以下几方面的调整和完善。
一是突出了法律法规在临床试验监管方面的顶层作用(CT01)。这能够帮助监管体系在法律授权下运行,明确监管的实体和监管范围,此外,监管体系也通过立法进一步推进规章制度、工作程序和技术指南等配套文件的制修订工作。
二是专门设立了要求在特定情况下加快临床试验评估程序的指标(CT01.05)。指标要求应立法允许监管机构在遭遇突发公共卫生事件时可依法对所需药品采取简化的临床试验审批程序,以满足公众的需求。2020 年全球新型冠状病毒感染疫情暴发,凸显了该指标设立的前瞻性和重要性。
三是细化了对内外部专家的管理要求。原评估工具中仅在评估程序和人力资源等方面涉及内外部专家内容,GBT 中专设CT04.01 亚指标,其评估内容既包括专家委员会的设立、遴选和人员构成要素,也包括专家委员会在监管活动中的利益冲突和职权范围等具体要求。
四是加强了执行层面和反馈层面的考察。既往NRA 评估工具中各亚指标仅设定简要说明和证据列表,当前GBT 中对指标内容、目的和要求进行了详细阐释,同时列出了证据审查要求和参考文件。这些审查要求逐层递进,从法律制度规定、工作程序文件、执行记录和绩效反馈等方面形成闭环,可以推动监管体系根据绩效考核结果和反馈记录不断完善工作流程,提高监管能力。例如根据CT06 主指标要求,监管体系应建立一个可追溯的系统,记录所有临床试验数据和评价活动,并进一步通过设立绩效指标和开展考察,衡量临床试验监督活动的有效性,执行必要的调整或优化。
3、境内临床试验监管体系及制度改革与工作优化
3.1 临床试验监管体系的组成和工作职责
疫苗监管从属于整个药品监管体系,临床试验监管是药品监管体系的一项重要职能。执行疫苗临床试验监管的组织机构,既包括国家药品监管机构内部的国家药监局及相关直属单位,也包括其他外部机构如伦理委员会。
3.1.1 国家药监局及相关直属单位
根据《中华人民共和国药品管理法》(以下简称《药品管理法》)[6] 和《药品注册管理办法》[7]等的相关规定,国家药品监督管理局主管全国药品注册管理工作,负责建立药品注册管理工作体系和制度,设置或指定专门机构承担药品注册审评审批、监督检查、核查和评价等工作。国家药品监督管理局药品审评中心(以下简称药审中心)负责药物临床试验申请及相关补充申请等的审评并代国家药监局作出药品临床试验审批决定。国家药品监督管理局食品药品审核查验中心承担药品注册管理所需的核查工作。临床试验用疫苗应具备由中国食品药品检定研究院出具的检验报告[8]。
3.1.2 伦理委员会
根据《药品管理法》[6] 规定,开展药物临床试验,应当经伦理委员会审查同意。《涉及人的生物医学研究伦理审查办法》(2016年版)[9] 进一步规定:“国家卫生计生委负责全国涉及人的生物医学研究伦理审查工作的监督管理,成立国家医学伦理专家委员会”。“省级卫生计生行政部门成立省级医学伦理专家委员会”。“县级以上地方卫生计生行政部门负责本行政区域涉及人的生物医学研究伦理审查工作的监督管理”。此外,各医疗卫生机构是研究伦理审查工作的管理责任主体,应当设立伦理委员会,并采取有效措施保障伦理委员会独立开展伦理审查工作。伦理委员会应按照GCP开展工作,与监管机构不同,伦理委员会的主要职责是保护受试者的权益和安全,应当特别关注弱势受试者[10]。
3.2 境内临床试验监管工作的完善与优化
3.2.1 临床试验审评审批默示许可制度的确立和完善
根据2007 年版《药品注册管理办法》[11], 我国境内新药临床试验申请(Investigationalnew Drug,IND)法定审评审批时限为110 个工作日。加之审评过程中可能多次补充资料导致审评时间大大超出法定时限,进一步延缓了药品进入临床试验的时间。2018 年,《国家药品监督管理局关于调整药物临床试验审评审批程序的公告》[12] 发布,明确实施60 日默示许可制度,将临床试验审评审批时限大大缩短。随后颁布的新修订《药品管理法》[6] 和《药品注册管理办法》[7] 正式从法律和法规层面确立了临床试验默示许可制度,这项制度增强了企业临床研发计划的可预见性,缩短了临床试验项目启动时间,有力地推动了临床研发进程。
2020 年和2021 年, 我国IND 申报数量保持年均50% 以上的增长速度,临床试验审评审批按时限率分别达到99.87% 和99.86%,在申报量高速增长的背景下保持了极高的按时限完成率[13-14]。默示许可制度及相关配套措施的实施,为临床试验申请和审评审批提供了清晰的路线流程、顺畅的沟通机制和明确的技术要求,符合NRA 评估GBT 中CT01、CT02 和CT04 主指标项下关于法律法规授权、指南文件发布、相关方角色定义和沟通机制的审查要求,正式实施以来的高完成率,也印证了默示许可制度的良好运转。
3.2.2 疫苗临床试验机构由审批制改为备案制
在新修订《药品管理法》实施以前,疫苗临床试验机构在每次开展临床试验前需向药品监督管理部门提出疫苗一次性临床试验机构资格认定申请,获批后方可开展临床试验。该批件只对所申报的疫苗临床试验有效,开展新的疫苗临床试验需再次申报。
2019 年12 月1 日,《药品管理法》[6] 和《药物临床试验机构管理规定》[15] 同时实施,药物临床试验机构开始实行备案管理。药物临床试验应当在具备相应条件并按规定备案的药物临床试验机构开展,疫苗临床试验应当由三级医疗机构或者省级以上疾病预防控制机构实施或者组织实施,《关于印发一次性疫苗临床试验机构资格认定管理规定的通知》同时废止。临床试验机构由审批式管理改为备案管理,强化了申请人和临床试验机构等相关方的主体责任,同时针对疫苗特定的获益风险考虑提出进一步要求,也兼顾了临床试验质量和受试者权益,做到了科学监管和严守底线的平衡。
3.2.3 强化临床试验过程监管
既往药品监管体系和流程存在两头重、中间轻的特点,通常把监管重点置于某些关键节点的审查,如临床试验申请、药品注册申请等,易忽视临床试验期间的过程监管。随着我国药品监管法律法规和监管理念的完善以及药品监管水平的提高, 临床试验期间监管的重要性日渐突出,2018 年药审中心增设临床试验管理处,专门负责药物临床试验期间审查、评价及相关协调工作。
3.2.3.1 加强临床试验期间的安全性报告:NRA 评估中WHO 特别关注临床试验期间的安全性报告和评价, 我国加入国际人用药品注册技术协调会(The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use,ICH)后, 国家药监局陆续发布公告,适用《E2A :临床安全数据的管理:快速报告的定义和标准》《E2B(R3):临床安全数据的管理:个例安全报告传输的数据元素》《E2F :研发期间安全性更新报告》等ICH 指导原则报告可疑非预期严重不良反应(SUSAR) 和研发期间安全性更新报告(DSUR),与国际接轨[16-17]。药审中心还配套制定了《研发期间安全性更新报告管理规范(试行)》[18] 等文件,进一步明确了报告内容、报告程序和时间限制。此外,药审中心内部还建立了相应的药物警戒系统、药物临床试验风险管理系统,及时开展安全性报告监测和评估。一旦发现确实存在风险,影响受试者权益的,可要求申办者立即采取调整临床试验方案、暂停或者终止临床试验等措施。
3.2.3.2 临床试验期间试验方案变更的管理:《药品注册管理办法》[7] 要求申办者对于临床试验期间方案变更是否影响受试者安全进行评估,并根据评估结果提出了不同的监管要求。但是申办方普遍反映缺乏具体的技术标准和申报要求,实际操作过程尚存在一定的困难, 也不利于确保受试者安全。结合GBT 中CT01.02 亚指标关于临床试验期间变更的评估目的和证据审查要求,药审中心调研了美国食品药品监督管理局(FDA)、欧洲药品管理局(EMA)等机构的监管要求,及时制定了《药物临床试验期间方案变更技术指导原则(试行)》[19],弥补了临床试验期间方案变更方面的监管空白。
为推动药物警戒系列指导原则落地实施,药审中心多次举办临床试验期间药物警戒系统应用培训活动,以确保临床试验各相关方建立药物警戒和风险管理的全面认识,正确开展安全性风险信号的报告和评价,熟练掌握相关电子系统操作。
3.2.4 推动审评审批和临床试验信息公开透明
所有经默示许可批准在境内开展临床试验的,药审中心在7日内将药品名称、申办方、适应症等基本信息推送至官方网站信息公开栏目,供公众和申请人及时查询。药审中心每年还发布年度药品审评报告,详细总结所有药品注册受理和审评审批情况、注册申请存在的主要问题,进一步梳理重点品种情况和制度建设方面的成果,并提出下一年工作计划。
此外,依据《赫尔辛基宣言》公开临床试验信息的明确规定,参考国际通行做法,药审中心设立药物临床试验登记与信息公示平台,要求申办方在临床试验受试者招募前登记信息,公开临床试验的方案设计、受试者人数、试验进展,以及参与临床试验的申办方、研究者和伦理委员会的基本信息等。2020 年起,基于对该平台登记信息的总结,药审中心发布《中国新药注册临床试验现状年度报告(2020 年)》,公开临床试验进展信息,为新药研发、资源配置和药品审评审批提供参考[20]。
经调研多个国家和地区的相关监管机构官方网站, 包括WHO 严格监管当局FDA 和EMA,及近期通过NRA 评估的南非、越南、新加坡等国家和地区的监管机构,与之相比我国的临床试验公开信息内容更详实,透明度更高,更好地体现了对公众知情权和受试者健康权的保护。
4、NRA 评估对临床试验监管工作的启示
4.1 加强人力资源投入和队伍建设
我国临床试验监管体系承担的任务极为繁重,以承担技术审评的药审中心为例,2020 年和2021 年受理的需技术审评的注册申请分别为7147 件和9235件,较上一年分别增长15.29%和29.11%,其中新药临床试验申请分别为1548 件和2412 件,较上一年分别增长51.62% 和55.81%[13-14]。以上数据表明,近年来我国技术审评任务特别是临床试验技术审评任务飞速增长,默示许可制度的实施进一步强化了对临床试验审评的时限要求,技术审评工作强度极高,审评人力资源需求的缺口较大。
疫苗作为一类特殊的药品,广泛应用于健康人群,特别是婴幼儿甚至是新生儿,风险较大,监管工作要求较高。2020 年以来为应对疫情,药审中心启动了特别审评审批程序,在不降低标准的基础上对新冠疫苗开展了加速审批。此外,药审中心在与疫苗申报企业开展前期沟通交流、派员参加WHO 线上会议了解最新研发信息和审评标准等方面投入了较多审评资源,审评人力资源紧张进一步加剧。笔者建议国家药监局及相关直属单位如药审中心等首先通过加快公开招聘速度,以及合理分配现有人员等方式提高人力资源供给。其次,监管机构应进一步优化审评流程,减轻冗余程序带来的资源浪费。最后,建议采取积极措施尽快推动国家药品监督管理局药品审评检查长三角分中心、国家药品监督管理局药品审评检查大湾区分中心发挥应有的作用。
4.2 加强官方网站关于临床试验资源的整合
目前,国家药监局关于临床试验监管的法律法规、制度文件、指导原则和工作程序,根据职责分工,分别发布于国家药监局和药审中心的网站。如对疫苗临床试验申请紧密相关的生物制品注册分类及申报资料要求和收费信息由国家药监局发布,生物制品注册受理审查指南则由药审中心发布。即使均属于药审中心同一监管事项的不同文件,可能也分散位于通知公告、信息公开、办事指南等多个专栏。现有网站界面对申请人和不具备注册知识的普通公众使用存在不便,信息查找较为困难。考虑到药审中心承担了临床试监管的大部分职能,建议在药审中心网站设立临床试验专栏,将所有临床试验监管相关的法规指南、工作程序等文件进行整合,降低信息获取门槛,更好地服务公众。
5、结语
疫苗国家监管体系对保障疫苗质量和公共用药安全至关重要,我国疫苗监管体系自2011 年至今已三次通过WHO 评估,证明监管体系稳定可靠,运行良好,可为全球提供安全、有效、质量可控的疫苗产品,在此基础上,我国已有数个疫苗通过WHO 预认证,走出国门,助力全球公共卫生事业。近年来,药品审评审批制度改革工作推进及《药品管理法》《疫苗管理法》和《药品注册管理办法》等法律法规颁布实施或修订进一步提升了我国的临床试验监管水平,主要表现为临床试验模式许可制度的确立和临床试验机构备案制度的实施,极大加快了临床研发过程;强化临床试验期间监管,推进ICH 药物警戒相关指导原则落地,使我国的临床试验期间监管水平与国际接轨;设立临床试验登记与信息公示平台,每年发布药品年度审评报告和新药临床试验年度报告,向公众充分公开临床试验的监管信息,保障知情权和健康权。临床试验监管工作的完善与监管水平提高,使国家药品监督管理局顺利通过CT 板块评估,达到3级成熟度水平。下一步,建议结合GBT 部分亚指标的评价要求,加强人力资源供给和调配,合理优化工作流程,推进分中心工作进展,进一步节约审评审批资源,稳定审评队伍;优化官方网站信息,设立临床试验专栏,将相关的法律法规、制度文件和指导原则集中呈现,增加网站的用户友好程度,提高信息透明度和易获取性。
引用本文
殷霄,苏瑶,陈维,高晨燕*,王海学*.疫苗国家监管体系评估临床试验监管板块要求及对监管工作的启示[J].中国食品药品监管.2023.05(232):8-17.