摘 要: 微球属于复杂的长效缓控释注射剂, 目前国内外均无针对微球药学研究的技术指南。分析国内外微球上市及申报现状发现,无论是新药还是仿制药,国内微球药学研究仍有待完善。本文结合药品审评工作,从释放机制、处方工艺、质量控制等方面,提出微球药学评价的特殊关注点。
微球(microspheres)属于长效注射剂的一种剂型,《中国药典》2020 版四部通则 9014《微粒制剂指导原则》将其定义为药物溶解或分散在载体辅料中形成的微小球状实体,粒径通常为几微米到几百微米[1]。 微球经肌肉或皮下等途径注射后,在注射部位形成药物储库,通过聚合物辅料的溶蚀、扩散、降解等机制缓慢释放药物[2],可降低给药频率,多开发用于需要长期用药以及顺应性较差 (如精神病患者)的患者。
微球制剂技术壁垒高,处方工艺复杂,实现缓释作用的关键辅料种类少,产业化难度大,微球生产的厂房、设备以及无菌控制等要求高,使得药物研发较为困难。 因此作为仿制药开发的微球产品面临与原研制剂保持质量和疗效一致性的巨大挑战。鉴于微球释放周期长, 体内吸收和释放行为复杂,且关键辅料存在某些垄断、质量差异及批间稳定性不确定等问题, 加之专利保护等均增加了仿制难度。 目前 FDA 尚无微球类长效注射剂的仿制药上市;欧洲有部分微球仿制药上市,如注射用醋酸奥曲肽微球;国内仅有北京博恩特药业有限公司和上海丽珠制药有限公司注射用醋酸亮丙瑞林微球(规格 3.75 mg)以及山东绿叶制药有限公司的注射用利培酮微球(Ⅱ)上市。
微球制剂具有减少患者用药次数、 减轻医疗负担的巨大优势,市场发展空间巨大,而我国微球制剂刚刚起步, 因此微球制剂的开发与研究意义重大。 2021 年 12 月 22 日工业和信息化部联合 9部门印发《“十四五”医药工业发展规划》(工信部联规〔2021〕217 号),要求加快产品创新和产业化技术突破, 明确提出要强化对微球等复杂长效缓控释制剂的关键核心技术攻关[3]。 但现阶段,国内外监管机构及行业协会均未发布微球制剂相关指导原则,对该类制剂的研发评价也缺少国际共识。本文结合已上市微球的审评实践,从释放机制、处方工艺、关键辅料、质量控制等方面进行介绍,旨在为微球药学评价提供参考。
一、 释放机制
微球通过可生物降解的聚合物辅料实现缓释作用,其释放机制包括:①聚合物表面溶蚀释放出被物理包裹的药物;②聚合物-药物化学键断裂,经扩散释放药物; ③药物随聚合物生物降解扩散释放[4]。微球体内释放行为复杂,通常为多种释放机制共同作用。 微球在体内存在早期突释,后续稳态释放,有些药物还存在释放停滞期,微球释放行为的复杂性与体内微环境以及自身复杂的释放机制相关。 一般认为水扩散进入微球,微球表面以及表层药物迅速溶解释放,造成微球突释;之后,聚合物上孔隙通道不断打开和关闭,加之药物与聚合物之间的相互作用,共同决定了药物后续释放行为[5]。
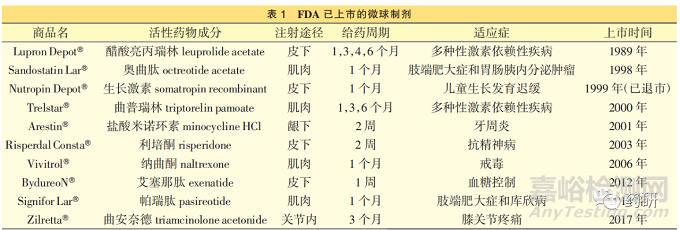
自 1989 年 FDA 批准首个注射用醋酸亮丙瑞林微球(商品名 Lupron DepotⓇ)以来,全球共计有 10个微球类长效注射剂上市,其中 Nutropin DepotⓇ已退市,详见表 1。 这些微球制剂作为初始剂型开发的品种很少,目前上市的微球制剂均基于已上市的普通制剂(如片剂、胶囊剂、口服溶液、注射剂),通过改变剂型和给药途径的方式获批上市。
二、处方和工艺
应围绕拟定适应症、用药周期、用药途径、血药浓度范围等进行微球制剂的开发, 优选高包封率、低突释、载药量适当的微球。 应特别关注微球突释带来高血药浓度的可接受性。 除理化指标的评价外, 积累微球在动物和人体药代动力学研究数据,能够加深对产品的理解,有助于指导处方和工艺开发,并建立微球理化指标和体内行为的相关性。
2.1 处方
目前上市的 9 种微球有 5 种为多肽类药物,4种为小分子化学药物。 微球的活性药物成分(activepharmaceutical ingredient,API) 通常具有较高的生物活性,如折算每日用药量甚至为微克级,从而确保少量药物即可实现长效释放。 这主要是皮下(2 mL)或者肌肉注射(5 mL)给药量有限。 微球制剂通常开发多种规格,以满足不同适应症、给药周期以及给药剂量调整的需求。 不同规格开发并不是简单的处方等比例变化,甚至可能选择不同的缓控释辅料。
微球制剂处方中最主要的缓控释功能性辅料为聚合物。 通过分析已上市品种发现,9 个微球品种共计 21 种规格, 其中使用乙交酯丙交酯共聚物[poly(lactide-co-glycolide),PLGA]作为缓控释辅料的有 19 种,使用乳酸聚合物(polylactic acid,PLA)的有 2 种。 不同类型的聚合物在体内降解和释放速度不同,且均可生物降解、安全性高,非常适合作为微球的缓控释辅料。
为保证药物释放行为一致,绝大部分微球需配套专用溶剂,按要求制备微球混悬液后给药。 其辅料除水外,还使用甘露醇、氯化钠等作为渗透压调节剂,羧甲基纤维素钠(carboxymethyl cellulose-Na,CMC-Na) 作为助悬剂, 以及非离子型表面活性剂(如吐温、泊洛沙姆)。 需针对适应症、给药途径、用药剂量等,结合体内外研究数据,对微球及专用溶剂的处方合理性进行评估。 部分微球的混悬操作复杂,而且也存在给药剂量准确性的问题,建议在产品开发中对上述问题予以关注。为提高使用便利性,部分产品改进为双腔室的预充针或者开发为其他类型聚合物药液直接给药,减少了复杂的配伍操作。
2.2 生产工艺
目前,有多种工业化方法制备微球,主要根据药物性质选择适当的制备方法,包括喷雾干燥法、热熔挤出法、相分离法和乳化法等[6]。 建议参照 ICH Q8评价各个工序对于关键质量属性的影响,确认关键物料属性、关键工艺参数及控制范围。 通常将微球的包封率、载药量、微球形态以及释放度等关键质量属性作为工艺研究的考察指标, 并根据不同生产工艺对可能影响微球质量的指标进行针对性研究,如固化步骤对残留溶剂的控制等。
2.2.1 喷雾干燥法
该方法将含有药物和聚合物的溶液、混悬液或者乳剂通过喷雾进入热空气的技术。 随着溶剂快速蒸发,雾化液滴转化为固体颗粒。已上市的曲安奈德微球(商品名 ZilrettaⓇ)采用该工艺生产。 喷雾干燥通常包括雾化、液滴与气体混合、溶剂挥发以及产品分离 4 个步骤。 其中雾化的工艺条件和参数对液滴粒径分布起决定性作用,进而影响微球形态,关键工艺参数包括喷嘴压力、进料和空气流量等[7]。
2.2.2 热熔挤出法
该方法工艺简单, 仅需将 API和聚合物混合后热熔挤出、 粉碎。 已上市的微球TrelstarⓇ和植入剂 OzurdexⓇ均采用此法制备[8]。热熔挤出可实现连续生产,但是对热敏感的原辅料在热熔挤出过程中可能会降解。 该技术无需使用有机溶剂,不存在去除溶剂固化的过程,因而微球孔隙较少,产品具有较高的包封率[9]。 建议关注热熔挤出前物料混合的均匀性。 螺杆送料、搅拌、捏合、高温熔融等工序影响物料混合均匀性,冷却、粉碎的工艺参数控制与微球形态相关。 存在多晶型的药物,需考虑进行晶型控制的考察。
2.2.3 乳化法
该方法是目前微球最常见的生产工艺。已上市产品 Lupron DepotⓇ和 Risperdal ConstaⓇ等均采用乳化法制备。 根据 API 的亲脂性不同,乳化法可选择单乳法(O/W 法)或复乳法(初乳 W/O法,复乳 W/O/W 法)。 乳化法过程复杂,通常需制备水相、药物-聚合物均匀分散的有机溶剂相,将有机溶剂相缓慢加入水相中制备均一乳剂,之后通过溶剂替换/挥发等方法去除有机溶剂固化微球,随即洗球,最终干燥制得成品。 乳化是形成微球形态的第一步; 固化和干燥过程中随着溶剂不断萃取和挥发,溶解在有机溶剂中的聚合物会凝结固化,形成多孔结构的微球[10]。 两相溶剂的选择、乳化、固化、洗球、干燥等工艺参数的差异,可能影响微球的载药量、形态等关键质量属性,进而影响药物体内行为。
2.2.4 相分离法
该方法通过将聚合物/药物的混合溶液加入互不相溶的另一种溶剂体系中并不断搅拌,聚合物随着溶解度降低而发生相分离,进而固化形成微球[11]。 已上市的注射用醋酸奥曲肽微球(商品名 Sandostatin LarⓇ)即采用相分离法。 微球固化的溶剂体系、搅拌速度、温度和时间影响微球成型以及特性,后续干燥过程影响微球残留的有机溶剂和水分。
2.3 缓控释辅料 PLGA
PLGA 是目前已上市微球的主要缓释聚合物辅料。因此其质控对微球质量非常关键,可影响药物体内行为。不同的生产工艺能够制备分子量不同、端基类型、丙交酯-乙交酯比例(L∶G 比例)和构型各异的PLGA,从而具备不同的理化性质和释放特性[12]。 因此有必要充分理解 PLGA 生产工艺,如合成路线、合成条件等。 上市许可持有人应强化 PLGA 生产商的审计以保障 PLGA 的连续供应。 另外, 还应确定PLGA 合适的内控标准和方法, 积累多批次辅料研究数据,确保 PLGA 质量稳定可靠。
建议结合生产工艺,重点关注 PLGA 结构表征,如分子量及分布、L∶G 比例及乙醇酸嵌段、 封端结构、链型(直链、多臂、星型等)等。 PLGA 释放功能性相关指标包括特性粘度、玻璃化转变温度(Tg)或熔融温度(Tm)、残留单体等,这些指标是 PLGA 关键特性的反映。 其他与产品质量相关的指标包括性状、炽灼残渣、残留溶剂、元素杂质、水分、微生物负荷、细菌内毒素、酸度、堆密度、粒径、拉伸强度等,建议结合微球质量控制要求合理进行内控。
三、质量控制
除常规的性状、鉴别、有关物质、元素杂质、含量均匀度、可见异物、细菌内毒素、无菌以及含量等指标外, 微球制剂相关的质控项目还包括载药量、包封率、释放度、分子量及分布、微球形态(外观、粒径及分布、孔隙率、药物分布状态)、残留溶剂、通针性、混悬性等。
3.1 释放度
微球通常采用多点法控制溶出,一般包括早期表征突释的、表征产品性能稳定的以及表征释放完全的时间点。 为模拟药物长期缓慢释放,微球释放度考察时间较长,需要采用较为温和的体外溶出方法,除常规药典收载方法外,还包括透析池法、转瓶法、摇床法等。 需关注长期使用溶出介质的无菌问题[13]。 释放度方法应具备一定的区分力,能够适度区分可能影响微球释放的关键物料属性(如不同类型和降解程度的聚合物辅料)、 关键工艺参数以及微球形态。
3.2 载药量和包封率
这两个指标是反映微球制剂中药物含量的重要指标,与产品释放密切相关,是评价生产工艺成熟的标志,而且包封率可能影响样品突释,建议积累微球包封率和载药量的研究数据。 《中国药典》2020 版《微粒制剂指导原则》规定考察上述两个指标,其中包封率一般不得低于 80%,应根据药物和聚合物的溶解性, 合理选择测定方法并进行验证,如凝胶柱色谱法、离心法或透析法等。
3.3 有关物质
需关注原辅料自身降解以及相互作用杂质的研究与控制。 很多微球的 API 是多肽, 如 LupronDepotⓇ和 Sandostatin LarⓇ。 研究表明多肽中亲核性伯胺(例如 N 端和赖氨酸侧链)与 PLGA 或其降解产物的羧酸端基相互作用,形成酰化衍生物,可能导致活性降低[14]。 部分微球采用终端工艺灭菌,需关注灭菌工艺下 API 和辅料的降解,如湿热灭菌下辅料 CMC-Na 可能降解产生小分子醛类杂质。 此外,PLGA 通过水解和自催化降解为乳酸和乙醇酸,降解产生的酸性产物可能形成高酸性的微环境[15]。 建议模拟体内酸性环境,开展微球在酸性条件下的降解研究,用于有关物质方法的开发。
3.4 分子量及分布
由于水解和自催化降解, 聚合物辅料在体内存在不断降解的趋势。 因此建议微球考察聚合物的分子量及分布。需关注稳定性末期的分子量,结合稳定性研究以及关键临床若干批数据合理制定分子量及分布限度。 以 PLGA 为例,其分子量分布大,自催化降解速度快,研究中需关注。
3.5 微球形态
与微球形态相关的指标包括外观、 粒径及分布、微球孔隙率以及微球中药物分布状态等。 微球粒径及分布对微球的通针性、分散性和释放行为均有较大影响。 粒径检测的技术手段相对比较成熟,除成像技术外,多采用激光散射法测定粒径。 通针性也是评价微球粒度的一种方法,针头尺寸小能够降低患者注射时的疼痛感。 对于乳化法制备的微球而言,有机溶剂从微球内部向外迁移替换的过程中会形成大量孔隙。 迁移过程中 API 可能随有机溶剂向微球表面迁移。 孔隙率以及药物分布状态也可能对药物早期释放产生影响。 常见检测微球形态的技术手段包括光学显微镜、电子显微镜(透射电子显微镜、扫描电子显微镜、聚焦离子束扫描电子显微镜)、X 射线显微镜、 近红外和拉曼光谱等。 微球孔隙率和药物分布状态的研究发展迅速,有研究采用聚焦离子束扫描电子显微镜技术可全面了解微球的状态,包括粒径及分布、API 和聚合物分布、孔隙率等;还有研究尝试建立基于微球形态的图像定量指标和体外释放特性的相关性[16]。
3.6 残留溶剂和水分
控制残留溶剂不仅出于溶剂本身安全性的考虑, 还因微球内部的残留溶剂和水分可能与药物、聚合物辅料相互作用进而影响药物体内行为。 另外,微球水分与聚合物辅料降解相关,可能影响微球长期放置后的释放行为。
3.7 无菌和细菌内毒素
聚合物通常不溶于水, 常规方法仅能检测微球表面是否无菌和有无细菌内毒素,球内无法检测。已有研究显示[17],可采用二甲亚砜为溶剂完全溶解微球后进行球内无菌和细菌内毒素检查。 应注意所选择的检测方法需经适当的方法学确认, 特别关注稀释溶剂对样品检测的干扰。
3.8 与专用溶剂配伍
大部分微球使用前需采用专用溶剂配伍后给药,不存在按体积给药的情况。 微球混悬液通常具有一定的粘度,以保证皮下或肌肉注射后能够迅速形成储库。 因此需关注使用相应给药器具进行给药的剂量准确性。 另外,应考察药液配伍后可能影响药物释放的混悬性、粘度、pH、渗透压等理化指标。
四、思考
4.1 关键辅料产业发展
乙交酯、丙交酯类聚合物种类繁多,因其安全无毒、相容性良好,广泛应用于可降解的医疗器械、制剂载体等;蛋白质类、肽类等药物载体的研发也一直在进行。 我国“十四五”规划相关要求有助于促进微球产业的发展,但是构建微球等高端制剂产业链格局,还需要加强配套关键辅料产业化的支持与保障,破除关键辅料“卡脖子”的窘境。 国内已有一些企业开展此类聚合物的研究与生产,一些微球制剂企业也已自行生产聚合物辅料以确保稳定供应。此类聚合物生产工艺的控制较为复杂,不同批次间产品质量可能会存在变化。 目前我国申报临床或者已上市的微球制剂, 仍有大部分选择进口辅料 PLGA。 高端辅料的发展仍是我国制药行业的一大短板,如何促进这类使用量小但质量属性关键的辅料发展,也是一项重要的系统工程。 建议一方面统筹各方力量,促进技术的转化实施,解决质量控制的难点;另一方面,从审评角度明确微球与关键辅料评价的技术要求,依托辅料关联审评逐步建立微球质量与关键辅料质控的相关性,促进研发与审评有机结合。
4.2 仿制药药学开发
微球注射于体内后会引发体内的系列应激反应,加之微球本身复杂的释放特性,共同形成了微球仿制药研发的技术堡垒。 就药学角度而言,应基于释放机制加深处方和生产工艺对产品质量影响的理解,努力建立产品特性和药物释放之间的关联性。建议加强对参比制剂药学物质基础的研究,如聚合物辅料的表征与控制、微球形态、微球含水量及残留溶剂等,结合体内外释放研究,充分了解参比制剂微球的特点。从原辅料、工艺、包材以及微球特性,开展全面的反向工程研究,积极拓展新技术的使用。受限于专利保护, 很多微球类仿制药较难实现突破。通过改变缓控释辅料的类型从而改变释放机制,或开发其他不同剂型的缓控释制剂也是一种尝试,如CamceviⓇ活性成分为亮丙瑞林, 使用辅料 PLA 和N-甲基吡咯烷酮制备粘稠液体供皮下注射使用。