今日头条
博锐LIV-1靶向ADC报IND。博锐生物1类生物制品注射用BRY812的临床试验申请获CDE受理。BRY812是国内首款申报临床的LIV-1靶向ADC药物,也是博锐生物首款申报临床的ADC新药。BRY812通过CysLink™不可逆化学偶联平台和高度稳定的连接子,将靶向LIV-1的抗体与小分子毒素偶联。LIV-1是一种多次跨膜蛋白,具有锌转运蛋白和金属蛋白酶活性,在多种癌症中异常表达。
国内药讯
1.百济神州PD-1单抗获批治疗食管癌。百济神州PD-1抗体替雷利珠单抗(商品名:百泽安)的新适应症上市申请获国家药监局批准,联合化疗用于一线治疗不可切除的局部晚期、复发或转移性食管鳞状细胞癌(ESCC)。这也是该产品在国内获批的第11项适应症。在国际Ⅲ期临床RATIONALE 306中,替雷利珠单抗联合化疗使患者死亡风险降低34%,中位OS达到17.2个月(vs10.6个月),无论患者PD-L1表达如何,均观察到联合治疗的OS获益。
2.拜耳PI3K抑制剂获批中国上市。拜耳PI3K抑制剂注射用盐酸可泮利塞(copanlisib)获国家药监局批准上市,用于治疗既往至少接受过两种系统性治疗的复发或难治性滤泡性淋巴瘤(FL)成人患者。在Ⅱ期临床(CHRONOS-1)中,copanlisib单药治疗这类FL患者的总缓解率(ORR)达到59%,包括14%的完全缓解(CR);治疗滤泡性B细胞非霍奇金淋巴瘤患者的ORR为59%,其中包括20%的CR。
3.君实PD-1单抗报三阴性乳癌NDA。君实生物PD-1单抗特瑞普利单抗新适应症上市申请获国家药监局受理,拟联合注射用紫杉醇(白蛋白结合型)用于PD-L1阳性(CPS≥1)的初治转移或复发转移性三阴性乳腺癌的治疗。在III期临床TORCHLIGHT研究(NCT04085276)中,与注射用紫杉醇相比,特瑞普利单抗联合用药一线治疗显著延长PD-L1阳性人群的无进展生存期,而且次要终点总生存期也显示明显获益趋势。
4.先博CD19靶向CAR-NK疗法报IND。上海先博生物1类生物制品“靶向CD19的嵌合抗原受体基因修饰的NK细胞注射液”(SNC103)临床试验申请获CDE受理。SNC103是先博生物采用其创新设计、拥有自主知识产权的CAR结构开发的一款靶向CD19的通用型CAR-NK细胞疗法,已在临床前研究中显示出比同类CAR设计更有效的抗肿瘤免疫反应。今年4月,这款CD19 CAR-NK疗法已在国内提交IND申请并获CDE受理。
5.来凯FIC单抗获批实体瘤临床。来凯医药潜在“first-in-class”单抗药物LAE102获FDA临床许可,即将在美国针对非小细胞肺癌等实体瘤开展I/II期临床研究。LAE102是来凯医药首个进入临床阶段的原创新药项目,其靶点对肿瘤生长、免疫激活、肌肉再生和造血发育等都有调控作用。目前,该公司在生物药和小分子领域还有10个临床前项目,有望为肿瘤及肝纤维化患者带来更多的新型疗法。
6.信诺维中美双报ADC报IND。上海信诺维生物1类生物制品注射用XNW28012的临床试验申请获CDE受理。这是一款创新型抗体偶联药物(ADC),尚未有官方信息披露详情。今年1月,信诺维宣布与AmMax Bio公司达成合作许可协议,授予后者一款用于实体瘤治疗的创新性ADC药物除大中华区外的全球研发和商业化的独家转让权益;并预计于2023年中期递交该新药的中国和美国IND申请。
7.中国抗体制药IL-17RB单抗报IND。中国抗体制药旗下杏联药业IL-17RB靶向单抗“SM17单克隆抗体注射液”的临床试验申请获CDE受理。SM17可通过与2型先天淋巴细胞(ILC2s)上的IL-17RB结合来抑制Th2细胞的免疫反应,从而阻止人白细胞介素25(IL-25)诱发的一连串反应。杏联药业计划针对哮喘适应症在中国启动一项I期临床试验,旨在桥接中美人群并探索SM17在中国人群中的安全性和有效性。
国际药讯
1.辉瑞二价RSV疫苗获推荐用于婴儿。FDA疫苗和相关生物制品咨询委员会(VRBPAC)推荐批准辉瑞重组呼吸道合胞病毒(RSV)融合前F蛋白双价疫苗RSVpreF(PF-06928316)上市,用于通过孕妇主动免疫使出生六个月内的婴儿预防RSV感染引起的需要医疗护理的下呼吸道疾病(MA-LRTI)和严重性MA-LRTI。在III期临床MATISSE(NCT04424316)中,疫苗避免婴孩出生后90天内感染严重MA-LRTI的保护效力达到81.8%。
2.HER2-ADC乳腺癌Ⅲ期临床见刊柳叶刀。阿斯利康与第一三共开发的HER2-ADC新药德曲妥珠单抗(优赫得)治疗HER2阳性转移性乳腺癌经治患者的Ⅲ期临床(DESTINY-Breast02)积极结果发表在《柳叶刀》期刊上。与常规疗法(卡培他滨+曲妥珠单抗,或卡培他滨+拉帕替尼)相比,德曲妥珠单抗显著提高患者的无进展生存期(中位PFS :17.8个月vs6.9个月)和总存期(中位OS:39.2个月vs26.5个月)。药物的安全性与已知研究一致。
3.口服司美格鲁肽减肥III期临床成功。诺和诺德GLP-1激动剂司美格鲁肽50mg片剂(每日1次)用于伴有一种或多种并发症的肥胖或超重成人减重的IIIa期OASIS 1研究达到主要研究终点。与安慰剂相比,司美格鲁肽(50mg)治疗组患者68周后体重较基线降幅更多(17.4%vs1.8%);减重≥5%的比例也更高(89.2%vs24.5%),此外,司美格鲁肽50mg片剂具有良好的安全性和耐受性。诺和诺德预计今年在美国和欧盟提交司美格鲁肽50mg片剂的上市申请。
4.亲环蛋白B抑制剂NASH Ⅱ期临床积极。Hepion公司亲环蛋白B抑制剂Rencofilstat在治疗晚期非酒精性脂肪性肝炎(NASH)的Ⅱ期临床ALTITUDE-NASH达到主要终点。与基线相比,rencofilstat(225mg)治疗组患者4个月后DSI(疾病严重性指数)评分平均降低1.62分(p<0.05);SHUNT(肝脏微结构变化)降低2.8%(p<0.05);HR(肝脏储备)提高3.9%(p<0.01);RISK ACE(每年发展为不良临床结果的风险)降低1.2次事件每100例患者(p<0.001)。此外,rencofilstat还达到包括肝损伤生物标志物下降等多个次要终点。
5.诺华拟购进一款HSC基因疗法。诺华与AVROBIO公司就后者研究性造血干细胞(HSC)基因疗法达成合作许可协议,拟开发HSC候选疗法用于治疗胱氨酸病。根据协议,诺华将在交易结束时向AVROBIO支付8750万美元的现金,此外,AVROBIO还向诺华独家授权了与AVROBIO公司基因治疗平台有关的某些其他资产、技术和其他知识产权,用于治疗胱氨酸病。AVROBIO保留了其治疗高雪氏病1型和3型、亨特综合征和庞贝病的全部权利。
6.TNF-α靶向药干眼症III期临床失败。HanAll Biopharma公司潜在“first in class”靶向肿瘤坏死因子-α的抗炎疗法Tanfanercept在治疗中重度干眼病患者的III期VELOS-3研究未能达到主要终点。第8周时,Tanfanercept治疗组患者角膜中央染色评分(CCSS)或干眼评分(EDS)的改善均未显示出统计学意义。药物的安全性结果与已知研究一致。在中国,和铂医药拥有Tanfanercept(HBM9036)的大中华区权益;由于在临床中观察到HBM9036的疗效不足趋势,和铂医药已终止其中国III期研究。
医药热点
1.国产新冠口服药个人自付最低只需31.5元/盒。近日,南京市医保局发文称,将先诺特韦/利托那韦组合包装、氢酸气瑞米德韦片、来瑞特韦片临时纳入基本医疗保险支付范围,按乙类管理。其中,利托那韦组合包装个人先行自付比例0.05,氢酸气瑞米德韦片个人先行自付比例0.1,医保限定支付范围仅限新冠确诊患者或新冠疑似患者使用。本通知自2023年5月13日起执行。按照三款药品各自630元/盒、630元/盒、628元/盒的挂网价格计算,三款药品最低自付金额分别为31.5元/盒、63元/盒和62.8元/盒。
2.5年为患者减负超5000亿元。国家医保局相关负责人日前在新闻发布会上介绍“贯彻落实党的二十大重大决策部署 着力推动医保高质量发展”有关情况。2018—2022年,全国人口参保率稳定在95%左右,职工医保和城乡居民医保政策范围内住院费用报销比例分别达到80%和70%左右。农村低收入人口和脱贫人口参保率稳定在99%以上,医保助力近1000万户贫困居民成功脱贫。大批独家品种的抗癌药、罕见病用药被纳入医保目录,报销后累计为患者减负超5000亿元。
3.英国试验用电动耳机治疗抑郁症。据英国天空新闻网21日报道,瑞典医疗器械公司“流动神经”设计了一款类似耳机的设备,通过温和的电流刺激抑郁患者大脑中不活跃区域,从而缓解抑郁症状。该公司称,88%参与试验的抑郁症患者在6周后有所缓解。目前,这款头戴设备正在NHS患者中进行试验,私人购买者可能需要支付高达399英镑(约合3490元人民币)的费用。
评审动态
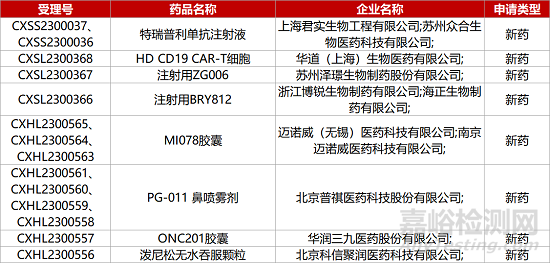
1. CDE新药受理情况(05月23日)
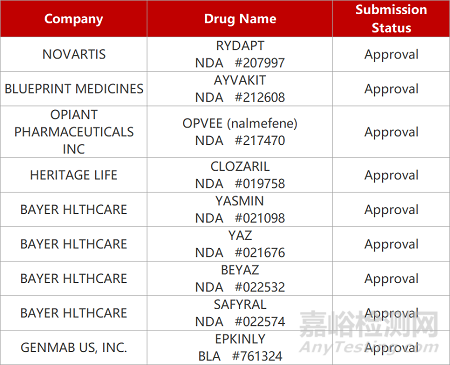
2. FDA新药获批情况(北美05月22日)