今日头条
恒瑞BTK抑制剂获NMOSD孤儿药资格。恒瑞医药旗下瑞石生物开发的二代口服BTK抑制剂Edralbrutinib获FDA授予孤儿药资格,用于治疗视神经脊髓炎谱系疾病(NMOSD)。Edralbrutinib片目前针对NMOSD的II期临床研究已完成所有患者访试,正在进行数据分析。目前国内同类产品只有萨特利珠单抗注射液和伊奈利珠单抗注射液获批NMOSD适应症。
国内药讯
1.泽布替尼两项新适应症获批上市。百济神州新一代BTK抑制剂百悦泽®(泽布替尼)获国家药监局批准两项新增适应症,用于治疗新诊断的成人慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)患者和新诊断的成人华氏巨球蛋白血症(WM)患者。今年4月底,国家药监局也将泽布替尼附条件批准的既往至少接受过一种治疗的成人CLL/SLL和WM患者适应症转为常规批准。
2.阿斯利康MEK抑制剂中国获批上市。阿斯利康MEK1/2抑制剂司美替尼(Selumetinib)获国家药监局批准上市,用于3岁及3岁以上伴有症状性/进展性、无法手术的神经纤维瘤病I型(NF1)相关丛状神经纤维瘤(PN)患者的治疗。该药此前已被CDE以“符合儿童生理特征的儿童用药品新品种、剂型和规格”为由纳入优先审评。Selumetinib是全球首款治疗NF1的创新疗法,已于2020年4月获FDA批准上市,商品名为Koselugo。
3.诺和诺德每周1次长效胰岛素报产。诺和诺德1类生物制品依柯胰岛素注射液(icodec)的上市申请获CDE受理。这是一款超长效胰岛素,拟用于一周一次皮下注射治疗1型与2型糖尿病患者。在ONWARDS临床研发项目中(包含6项Ⅲa期全球临床试验),icodec可以为需用胰岛素治疗的1型与2型糖尿病患者带来临床获益。目前,该公司已在美国和欧盟同步递交了icodec的上市申请。
4.君实PD-1单抗肺癌III期临床积极。君实生物PD-1抑制剂特瑞普利单抗联合依托泊苷及铂类一线治疗广泛期小细胞肺癌的III期临床EXTENTORCH研究(NCT04012606)达到主要研究终点。与安慰剂联合化疗相比,特瑞普利单抗联合化疗显著延长患者的无进展生存期(PFS)和总生存期(OS)。特瑞普利单抗安全性数据与既往研究相似。详细数据将在国际学术大会上公布。该公司计划近期递交该新适应症的上市申请。
5.邦耀两款通用型CD19靶向CAR-T报IND。邦耀生物发布公告,宣布其通用型细胞平台(TyUCell)开发的两款靶向CD19基因修饰的异体嵌合抗原受体T细胞注射液(BRL-301和BRL-301A)的临床试验申请(IND)已获得CDE受理。基于基因编辑技术改造的BRL-301和BRL-301A能够有效避免异体细胞移植中可能存在的移植物抗宿主病(GVHD)风险,针对的适应症分别为B细胞恶性肿瘤、自身免疫系统疾病。
6.百力司康HER2-ADC超20亿美元授权卫材。百力司康宣布与卫材株式会社就其临床早期HER2 ADC药物BB-1701达成合作许可协议,卫材将获得BB-1701的全球(除大中华区外)开发和商业化权益。去年11月,百力司康已在中美同步开展BB-1701用于治疗局部晚期和转移性HER2阳性实体瘤的Ⅰ期临床。根据协议,百力司康将获得首付款,总计高达20亿美元的开发与商业化里程碑潜在付款,以及产品的销售分成。
国际药讯
1.辉瑞RSV疫苗启动高危人群III期临床。辉瑞重组RSV融合前F蛋白双价疫苗RSVpreF(PF-06928316)在clinicaltrials.gov网站上登记启动针对18~60岁严重呼吸道合胞病毒(RSV)高危成人患者的III期临床(MONET)。辉瑞近期已在《新英格兰医学杂志》公布用于保护老年人与婴孩避免感染RSV相关下呼吸道疾病的两项Ⅲ期试验积极结果。数据显示,疫苗在预防老年人至少有两种症状的RSV相关下呼吸道疾病方面的有效率达到66.7%(96.66% CI:28.8-85.8);PF-06928316避免婴孩出生后90天内感染需要医疗护理的RSV相关下呼吸道疾病的有效率达(99.5% CI:40.6-96.3)。
2.RAS靶向药联合治疗胰腺癌Ⅱ期临床积极。Golden Biotechnology公司创新RAS靶向药Hocena(antroquinonol)联合标准治疗方案(nab-paclitaxel+gemcitabine)在一线治疗转移性胰腺癌的Ⅱ期临床获积极中期结果。Antroquinonol联合治疗的中位无进展生存期(mPFS)为5.3个月,中位总生存期(mOS)为12.6个月,6个月总生存率(OS)为86%,12个月总生存率为60%。与过去标准治疗方案的Ⅲ期试验结果相比,antroquinonol联合疗法的中位总生存期、6个月和12个月的总生存率均有显著提高。
3.Arthex公司融资推进AON疗法开发。Arthex Biotech公司宣布完成4200万欧元B轮融资,以用于推进其先导化合物ATX-01开展治疗强直性营养不良1型(DM1)的Ⅰ/Ⅱa期临床试验。ATX-01是一种针对miR-23b的antimiR药物,与调节DM1病理发生中涉及的MBNL蛋白表达有关。目前尚无针对DM1病因的治疗方法。2022年12月,ATX-01已分别获得FDA和EMA授予治疗DM1的孤儿药资格。
4.Convergentg融资开发前列腺癌放射性抗体。Convergentg公司宣布完成由OrbiMed和RA Capital Management领投的9000万美元的A轮融资。此轮融资将用于推进其靶向前列腺特异性膜抗原(PSMA)的创新放射性抗体药物CONV01-α的临床开发。CONV01-α旨在将锕-225(Ac-225,放射性α粒子发射器)靶向运送至前列腺癌细胞,同时将对周围健康组织的损害降至最低。CONV01-α有望成为首个获批用于前列腺癌治疗的Ac-225放射性抗体。
5.DEARA治疗肾小球硬化III期临床失败。Travere公司双重内皮素血管紧张素受体拮抗剂(DEARA)sparsentan用于治疗局灶节段性肾小球硬化(FSGS)的关键III期DUPLEX研究未达到主要终点。与厄贝沙坦相比,sparsentan治疗在108周时患者的肾小球滤过率(eGFR)总斜率改善为每年0.3 mL/min/1.73m2 (95% CI: -1.74, 2.41),对eGFR慢性斜率改善为每年0.9 mL/min/1.73m2 (95% CI: -1.27, 3.04),但不具统计学显著性;该组蛋白尿较基线平均减少50%(vs32%);药物安全性与厄贝沙坦相当。Sparsentan是FDA批准针对IgA肾病的首个非免疫抑制疗法。
6.Incyte削减PI3K抑制剂等6项管线。Incyte公司日前公布2023Q1业绩,总产品营收为6.93亿美元,同比增长14%。其中,治疗白癜风的Opzelura(芦可替尼软膏)同比增长343%至0.57亿美元。该公司同时在财务报表中透露,已终止包括PI3Kδ抑制剂Parsaclisib针对温抗体型自身免疫溶血性贫血的III期临床等6项研究。2023年3月,Incyte曾宣布独立数据监测委员会认为Parsaclisib联合芦可替尼片治疗骨髓纤维化的III期LIMBER-304研究不太可能达到主要终点。
7.咖啡因或可改善肠道有益菌丰度。近日,贝勒医学院的研究团队发表在营养学知名期刊Nutrients上的最新研究显示,与咖啡因摄入量较低的人群相比,咖啡因摄入量较高的人群肠道Faecalibacterium菌和Alistipes菌的相对丰度较高,而丹毒杆菌的相对丰度较低。较高的咖啡摄入量(超过2杯)人群肠道菌落表现出同样的趋势。多元分析调整维生素B2后,丹毒梭菌数与咖啡因摄入量仍然呈显著负相关。丹毒杆菌属厚壁菌门,已有研究表明其在脂质代谢、糖耐量调节、代谢相关性脂肪肝等反应中起不良作用。
医药热点
1.我国建成世卫一级传统医学临床试验注册平台。近日,由中国中医科学院等机构搭建运行的“国际传统医学临床试验注册平台”,已被认证为世卫组织国际临床试验注册平台一级注册机构。这是世卫组织认证的全球首个以传统医学为主题的临床试验注册平台,将面向全球接收传统医学临床试验的注册,包括中医、针灸、推拿、草药、阿育吠陀、顺势疗法、尤那尼医学、补充和替代药物等传统医学领域。
2.跨省异地就医直接结算最新数据发布。5月5日,国家医保局公布2023年一季度跨省异地就医直接结算有关情况。据统计,2023年一季度,全国住院费用跨省联网定点医疗机构达6.75万家,住院费用跨省直接结算212.55万人次,减少个人垫付268.75亿元。全国门诊费用跨省联网定点医药机构达36.44万家,门诊费用跨省直接结算1742.09万人次,减少个人垫付28.4亿元。
3.中国科学家开发出肿瘤治疗纳米粒子。中国科学院精密测量科学与技术创新研究院周欣研究员团队利用肿瘤微环境与正常组织的差异,开发出一种可智能识别肿瘤的纳米粒子GQD NT,这种纳米粒子通过在肿瘤中不断变形,延长了粒子内的药物在肿瘤中的驻留时间、增强了药物在肿瘤中的穿透性,以极低的药物剂量实现了癌症的长时磁共振成像检测与高效治疗。相关研究成果已发表于国际期刊《先进材料》上。
评审动态
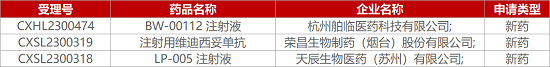
1. CDE新药受理情况(05月08日)
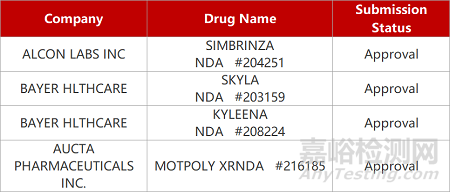
2. FDA新药获批情况(北美05月05日)