摘 要 / Abstract
疫苗流通安全关系百姓接种安全,疫苗流通过程的质量安全是决定达到接种单位的疫苗质量安全的关键,而追溯是对疫苗流通过程跟踪和监管的最佳手段。《疫苗管理法》第五条和第十条对疫苗追溯进行了明确规定,国家药品监督管理局疫苗追溯协同服务平台已经完成了上市许可持有人追溯数据和疾病预防控制机构追溯数据的交换,各级监管部门也针对疫苗流通过程建立了以流向为核心的监管系统。目前的追溯是以流向为核心,对流通过程的作业过程、质量控制等涉及不多,通过现有追溯体系实现对疫苗流通过程和质量风险的监管还有所不足。本文通过对疫苗流通全业务过程的分析,依托于国药控股上海生物医药有限公司的疫苗业务,探讨了满足疫苗特征的追溯数据验证方法和在现有追溯数据基础上对疫苗供应链-物流作业过程、质量控制等方面的扩展,有利于监管部门在疫苗流向监管的基础上,通过追溯数据以数字化方式实现对业务过程的规范性、高质量的监管。
The safety of vaccine distribution is related to the safety of public vaccination.The quality and safety of the vaccine distribution process is the key to determining the quality and safety of vaccines reaching vaccination sites,and traceability is the best way to track and supervise the vaccine distribution process.Articles 5 and 10 of the Vaccine Administration Law clearly stipulate the traceability of vaccines.The vaccine traceability collaborative service platform of the National Medical Products Administration has completed the exchange between traceability data of marketing license holders and disease prevention and control institutions.The regulatory authorities at all levels have also established a regulatory system centered on the flow of vaccines for the distribution process.The current traceability is based on the flow direction,and there is not much involvement in the operation process and quality control of the distribution process.It is still insufficient to realize the supervision of the vaccine distribution process and quality risk through the existing traceability system.Based on the analysis of the whole process of vaccine distribution and relying on the vaccine business of Sinopharm Holding Shanghai Biopharmaceutical Co.,Ltd.,this paper discusses the traceability data verification method that meets the characteristics of vaccines and the expansion on vaccine supply chain-logistics operation process and quality control,etc.based on the existing traceability data.On the basis of the supervision of vaccine flow,the regulatory authorities can realize standardized and high-quality supervision of the business process in a digital way through traceability data.
疫苗属于温度敏感的生物药品,其生产、经营受到相关法规的严格约束。疫苗从上市许可持有人到接种单位的流通过程涉及了上市许可持有人、各级疾控中心、接种单位和第三方物流服务商。疫苗流通全程监管既包括对疫苗流向的跟踪,也包括对相关业务机构围绕疫苗业务的合规性和疫苗流通过程质量的监管。本文对疫苗流通全程业务场景和追溯场景进行了分析,针对疫苗流通全程业务的监管场景,提出了疫苗追溯数据的验证思路,探讨了追溯数据在业务环节的扩展实现方式。
1、疫苗流通全业务流程简介
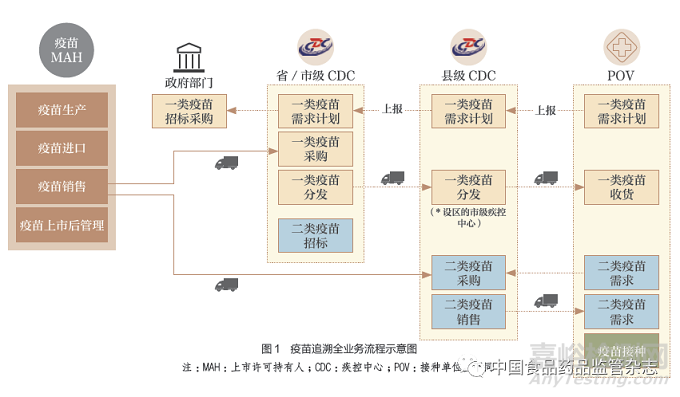
疫苗由上市许可持有人在中标后,向疾控中心进行销售,再由疾控中心向接种单位进行疫苗销售或分发,最后在接种单位完成向接种者的接种使用。整个疫苗流通过程涉及政府相关管理部门(组织招标和进行监管)、上市许可持有人、各级疾控中心、接种单位以及第三方物流服务商(图1)。
2、疫苗流通全程监管的法规要求
疫苗流通过程相关的法规和标准包括《疫苗管理法》[1]、《疫苗流通和预防接种管理条例》[2]、《疫苗储存和运输管理规范》[3]、《新冠病毒疫苗货物道路运输技术指南》[4]、《疫苗生产流通管理规定》[5]、DB31/T 1206—2020《疫苗冷链物流运作规范》[6]。
2.1 疫苗流通全程监管的目标
疫苗由疫苗上市许可持有人向疾病预防控制机构供应,再由疾病预防控制机构向接种单位供应,这一供应链单向不可逆。
疫苗流通全程监管的主要目标是:①确保疫苗流通业务合规。依据相关法规要求上市许可持有人/疾控中心在疫苗购销、退货、接种、召回等业务过程中合规且可以被追溯。②业务风险监测和告警。对疫苗业务过程中的业务风险进行监测,及时发现业务风险和冷链质量风险,跟踪风险的处置情况,通过监管手段规避接种风险的发生。③疫苗流通全程的冷链质量安全。通过对疫苗存储运输过程的冷链监控,保障疫苗流通过程中冷链质量安全。
2.2 疫苗流通全程监管的主要内容
按照《疫苗管理法》的规定,疫苗流通全程监管的主要内容包括以下5个方面。
2.2.1 批签发制度的落实
国家实行疫苗批签发制度;疫苗上市许可持有人在销售疫苗时,应当提供加盖其印章的批签发证明复印件或者电子文件;疾病预防控制机构、接种单位在接收或者购进疫苗时,应当索取前款规定的证明文件,并保存至疫苗有效期满后不少于五年备查。
2.2.2 疫苗采购和销售业务过程监管
疫苗上市许可持有人应当按照采购合同约定,向疾病预防控制机构供应疫苗。疾病预防控制机构以外的单位和个人不得向接种单位供应疫苗。
2.2.3 疫苗储存和运输冷链质量监管
疫苗在储存、运输全过程中应当处于规定的温度环境,冷链储存、运输应当符合要求,并定时监测、记录温度。疾病预防控制机构、接种单位接收或者购进疫苗时,应当索取本次运输、储存全过程温度监测记录,并保存至疫苗有效期满后不少于五年备查。
2.2.4 疫苗购销记录检查
建立真实、准确、完整的接收、购进、储存、配送、供应记录,并保存至疫苗有效期满后不少于五年备查。
2.2.5 疫苗生命周期质量管理检查
疫苗上市许可持有人应当建立健全疫苗全生命周期质量管理体系,制定并实施疫苗上市后风险管理计划,开展疫苗上市后研究,对疫苗的安全性、有效性和质量可控性进行进一步确证。
3、国内通过追溯监管疫苗流通的应用情况
3.1 现有追溯体系下的疫苗流通过程追溯数据
《疫苗管理法》第十条规定:“国家实行疫苗全程电子追溯制度。国务院药品监督管理部门会同国务院卫生健康主管部门制定统一的疫苗追溯标准和规范,建立全国疫苗电子追溯协同平台,整合疫苗生产、流通和预防接种全过程追溯信息,实现疫苗可追溯。疫苗上市许可持有人应当建立疫苗电子追溯系统,与全国疫苗电子追溯协同平台相衔接,实现生产、流通和预防接种全过程最小包装单位疫苗可追溯、可核查。疾病预防控制机构、接种单位应当依法如实记录疫苗流通、预防接种等情况,并按照规定向全国疫苗电子追溯协同平台提供追溯信息。”
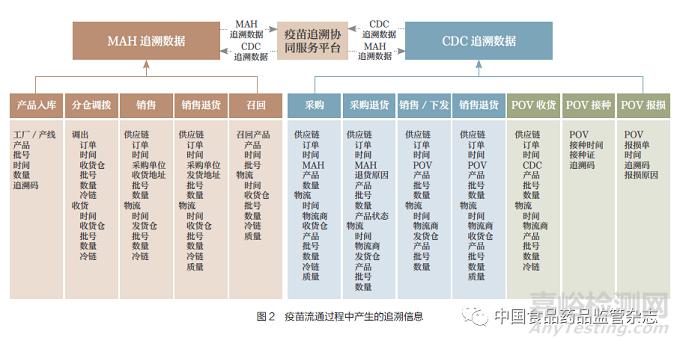
疫苗全业务流程中生成追溯数据的业务场景如图2所示。
疫苗流通过程的追溯数据按数据生成的主体分为上市许可持有人追溯信息和疾病预防控制机构追溯信息。
上市许可持有人追溯信息是指上市许可持有人(包括委托的第三方物流机构)在业务过程中产生的追溯数据。主要包括:①疫苗产品生产入库的追溯信息。②多个仓库之间疫苗调拨时的调拨出库、入库追溯信息。③疫苗销售和销售退货时的追溯信息。④疫苗召回产生的退货追溯信息。
疾病预防控制机构追溯信息是指疾病预防控制机构和接种单位在疫苗购进、接收、销售(二类疫苗)和分发(一类疫苗)、退货、报损、接种疫苗产生的追溯信息。主要包括:①疫苗购进、入库追溯信息。②疫苗销售、分发和接种单位接收追溯信息。③疫苗退货、报损追溯信息。④疫苗接种追溯信息。
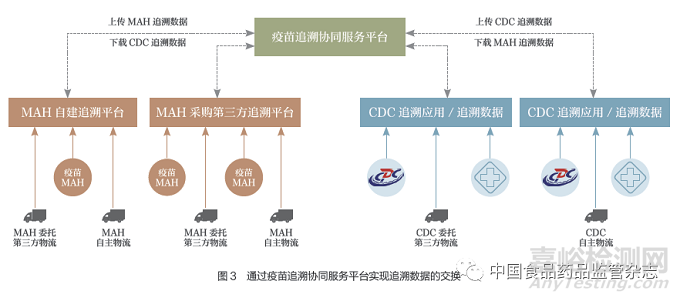
3.2 通过疫苗追溯协同服务平台实现追溯数据的交换
疫苗上市许可持有人和疾病预防控制机构向国家药品监督管理局疫苗追溯协同服务平台上传追溯数据,通过疫苗追溯协同服务平台完成追溯数据的交换(图3)。
3.3 通过追溯数据对疫苗流通全程进行数字化监管的可行性
疫苗流通全程涉及疫苗上市许可持有人(包括委托的第三方物流机构)、疾病预防控制机构(包括委托的第三方物流机构)和接种单位,分别有各自独立的信息系统。
疫苗追溯码作为疫苗的身份代码具有全流程唯一性,追溯数据的生成也是以追溯码为关键字段,通过追溯信息可以有效完成对上市许可持有人业务流程和疾病预防控制机构业务流程的串接。因此,追溯数据具备对疫苗从上市许可持有人到接种单位的流通全程监管的基础。
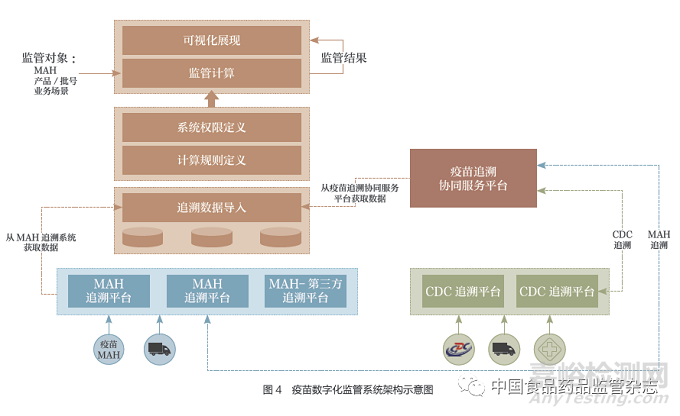
3.4 基于追溯数据的数字化监管平台设想
基于疫苗追溯数据的数字化监管平台的架构如图4所示。
3.4.1 数据接入和存储
从上市许可持有人追溯平台、疫苗追溯协同服务平台获取追溯数据;对追溯数据按照规则进行校验和存储,确保获取数据的完整性。
3.4.2 计算规则和权限定义
从疫苗采购、销售、库存和有效期、疫苗退货、疫苗物流、疫苗接种等场景来定义追溯数据计算规则;定义不同监管部门、不同监管层次(省、市、县)的监管数据访问权限。
3.4.3 数据计算和展现
根据不同监管场景算法,生成计算结果,进行可视化展现。
3.5 现有追溯体系在疫苗流通全程监管中的不足
目前国内主要追溯系统同时面向包括疫苗在内的全部药品,以收集药品流通过程的供应链单据信息、温度信息等方式来产生追溯信息,并未针对疫苗的管理特性对追溯数据进行严格的要求,主要存在以下不足之处:①对追溯数据缺乏严密的验证规则,无法确保流通全业务流程中全部环节数据的完整性、上报及时性和时序合理性。②追溯数据满足疫苗流向的追溯,但不能完全满足《疫苗管理法》等法规对疫苗业务规范性、质量和异常控制等管理要求。
笔者针对上市许可持有人业务过程、疾病预防控制机构疫苗采购和销售过程、疫苗接种过程和疫苗物流作业过程进行了跟踪,对比现有主要的追溯平台数据采集/上传要求,进行了追溯数据校验规则的设计和追溯信息在业务过程的内容扩展探索。
4、疫苗流通追溯数据的校验方式
追溯数据的完整性和合理性是实现对疫苗流通全程监管的基础,因此从上市许可持有人追溯平台或疫苗追溯协同服务平台获取追溯数据,并导入到监管平台进行数字化监管,都需要对追溯数据进行校验,校验的内容主要包括以下几个方面。
4.1 追溯数据完整性校验
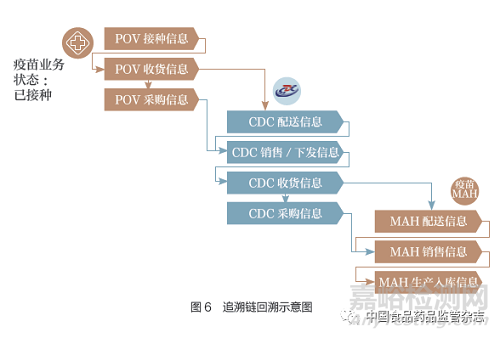
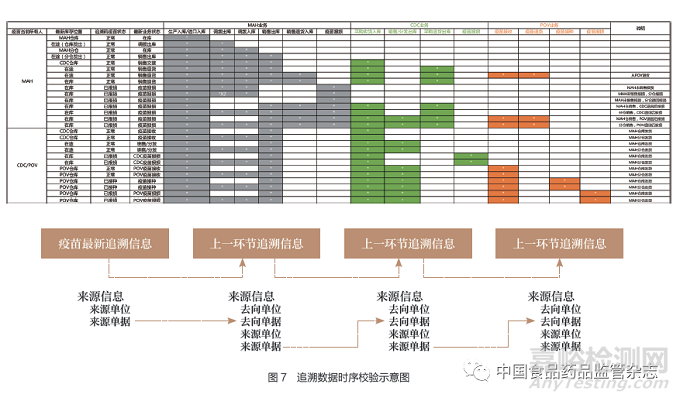
追溯数据完整性校验是依据疫苗当前状态和当前业务环节,从追溯数据中对疫苗流通过程的追溯数据以数据链形式进行回溯,检查前序业务环节的追溯数据是否存在,并针对缺失的业务环节追溯数据进行报警。图5是疫苗追溯数据完整性规则示例图。
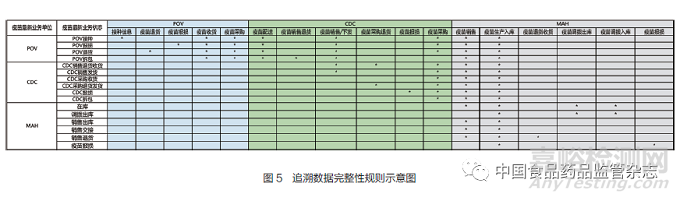
对于接种单位接种的疫苗,以逆向回溯的完整追溯链应该包括:①接种单位追溯数据:接种单位接种信息→接种单位收货信息→接种单位采购信息。②疾控中心追溯数据:疾控中心配送信息→疾控中心销售/下发信息→疾控中心收货信息→疾控中心采购信息。③上市许可持有人追溯数据:上市许可持有人配送信息→上市许可持有人销售信息→上市许可持有人生产入库信息(图6)。
4.2 追溯数据时序校验
由于疫苗追溯协同服务平台主要扮演的角色是追溯数据在上市许可持有人和疾病预防控制机构之间的交换,对上市许可持有人通过疫苗追溯协同服务平台上传和疾病预防控制机构上传的追溯数据的规范性尚未强制执行,因此进行追溯数据的分析需要对追溯数据链进行校验。图7为追溯数据时序校验示意图。
追溯数据的校验以追溯码中最新追溯数据为源头进行回溯,根据当前追溯信息中的来源信息(来源单位、来源单据、来源时间等)逆向查询上一环节的追溯信息,直至最初的追溯数据源头(生产入库/进口产品入库)。
4.3 按业务场景的数据完整性和重复性校验
按照满足业务监管的需要,针对不同业务环节所产生的追溯数据的完整性进行校验,并按照业务环节对追溯数据进行重复性检查,确保用于监管的追溯数据的纯净度。
5、疫苗流通追溯信息的扩展
目前疫苗追溯领域的核心数据标准为NMPAB/T 1004—2019《疫苗追溯基本数据集》[7],追溯信息的扩展主要是在现有国家标准数据集的基础上,以扩展数据字段和增加辅助数据集的方式进行扩展,从而既可以满足现有追溯平台和疫苗追溯协同服务平台数据的要求,又能针对性扩展对业务过程监管的内容。
5.1 现有追溯数据集构成情况
NMPAB/T 1004—2019《疫苗追溯基本数据集》中将疫苗追溯基本数据集分为基础信息数据子集和应用信息数据子集2类。
5.1.1 基础信息数据子集
①国产疫苗/进口疫苗基本信息数据子集:国家药品标识码、通用名称、商用名、本位码、剂型规格、包装、有效期、批准文号、是否属于国家免疫规划疫苗、生产企业、上市许可持有人等。②生产企业/进口疫苗代理企业基本信息数据子集:境内疫苗生产企业(国产疫苗上市许可持有人)基本信息、境外疫苗生产企业基本信息、进口疫苗代理企业(进口疫苗上市许可持有人)基本信息。③疾病预防控制机构/接种单位基本信息数据子集:疾病预防控制机构/接种单位名称、地址等。④疫苗配送单位(接收上市许可持有人或疾病预防控制机构委托进行疫苗仓储和配送)基本信息数据子集:疫苗配送单位名称、地址等。⑤药品生产许可证/药品经营许可证基本信息数据子集:许可证编号、统一社会信用代码、企业名称、注册地址、法定代表人、企业负责人、有效期、发证机关等。
5.1.2 应用信息数据子集
①生产信息数据子集:以疫苗最小销售包装(最小追溯码赋码单元)为计量标准,记录生产企业、生产地址、批号、生产数量、疫苗状态等信息。②进口信息数据子集:以同批号进口的疫苗最小销售包装为计量标准,记录进口企业、生产企业、进口数量、疫苗状态等信息。③生产企业自检信息数据子集:记录疫苗的检验日期、检验报告等信息。④批签发信息数据子集:记录疫苗的批号和批签发信息。⑤发货单信息数据子集:记录上市许可持有人或疾控中心的疫苗发货信息,包括发货单、发货机构、发货地址、收货机构、收货地址、单据验证状态、疫苗产品信息等。⑥收货单信息数据子集:记录上市许可持有人或疾控中心、接种单位的疫苗收货信息,包括收货单、发货机构、发货地址、收货机构、收货地址、收货类型、单据验证状态、疫苗产品信息(疫苗产品、批号、应收数量、实收数量)等。⑦使用信息数据子集:接种单位接种疫苗时产生使用追溯数据,包括接种单位、使用时间、接种疫苗追溯码等。⑧召回信息数据子集:疫苗召回时产生召回追溯数据,包括召回机构、开始和结束时间、召回数量、召回疫苗追溯码等。⑨温度信息数据子集:记录疫苗储存、运输过程中的温度数据,包括疫苗追溯码、温度采集位置、温度采集时间、温度数据等。⑩消费者查询基本信息数据子集:药品追溯码、上市许可持有人、生产日期、生产批号、有效期、剂型、规格等。
5.2 追溯数据扩展的方式
追溯数据将采取现有数据集字段扩展和新增业务数据集方式来进行扩展,同时可以满足现有疫苗追溯协同服务平台数据上传需求和扩展后追溯系统及追溯应用的需求。
5.3 追溯数据的扩展内容
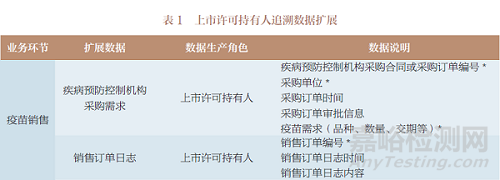
追溯数据按其产生主体(上市许可持有人和疾病预防控制机构)的业务场景进行扩展,表1~表3是追溯数据扩展的部分示例。
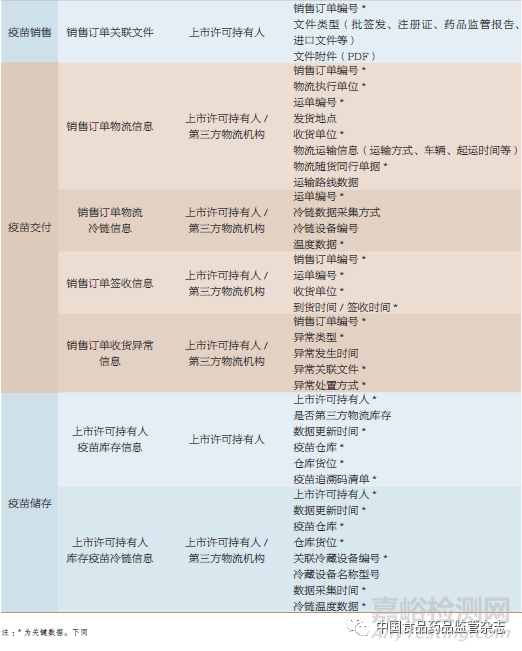
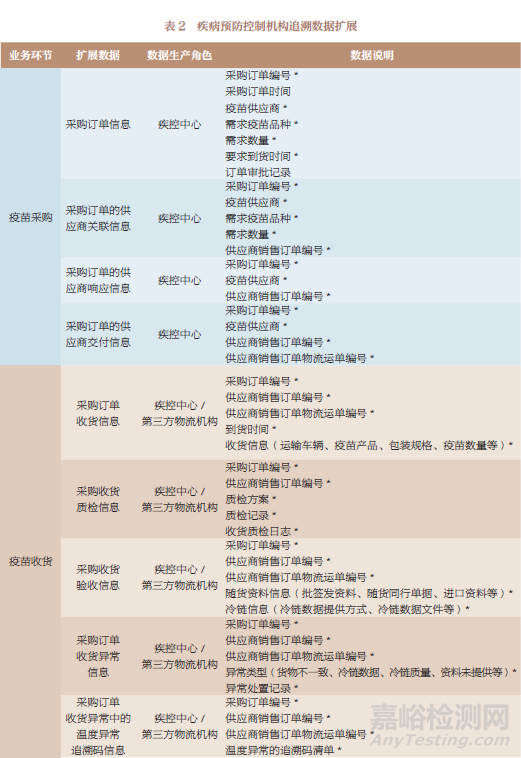
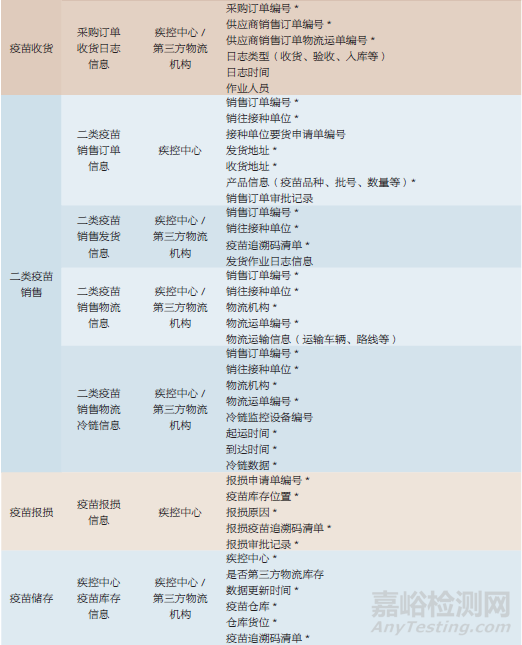

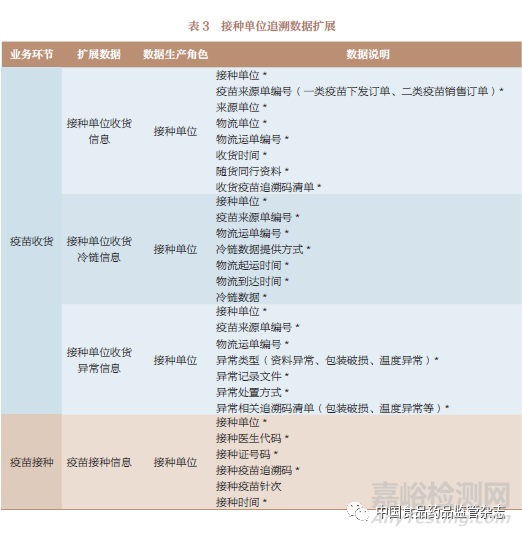
5.4 疫苗业务状态数据扩展
NMPAB/T 1004—2019《疫苗追溯基本数据集》中对疫苗生产流通使用过程中对应疫苗所处的状况定义如下:已自检、已批签、已过期、已损坏、已销毁、召回中、已召回、已使用、已停用、其他,共10种类型。
考虑到疫苗在流通过程中如果追溯平台能通过追溯码的应用场景为业务操作提供验证、控制等服务,同时结合冷链质量过程,可以考虑增加:①“正常”状态:上市许可持有人在疫苗生产/进口完成批签,质检合格后入库时的状态。“正常”状态下可以直接采购、销售或接种。②锁定状态,包括“待定、待召回、异常”3种状态类型:在流通过程中因冷链、待召回、流通所需资料不完整等原因导致疫苗暂时不能流通和接种时,疫苗处于锁定状态。“待定”状态需针对疫苗质量状态进行判定,可以调整为“正常”“待召回”“异常”;“异常”状态的疫苗只能退货或退货后进行销毁,处于“异常”状态的疫苗需要提供异常原因;“待召回”状态的疫苗将由上市许可持有人进行召回后处理。
5.5 供应链业务相关的证明文件扩展
《疫苗管理法》第三十八条规定:“疫苗上市许可持有人在销售疫苗时,应当提供加盖其印章的批签发证明复印件或者电子文件;销售进口疫苗的,还应当提供加盖其印章的进口药品通关单复印件或者电子文件。疾病预防控制机构、接种单位在接收或者购进疫苗时,应当索取前款规定的证明文件,并保存至疫苗有效期满后不少于五年备查。”
NMPAB/T 1004—2019《疫苗追溯基本数据集》仅仅在发货单/收货单中记录了单据验证状态、单据验证日期和未通过验证原因。
追溯数据中证明文件的扩展包括证明文件类型、证明文件提供方式、证明文件编号、证明文件电子版/扫描版附件内容。
6、追溯验证和追溯数据扩展在生产中的应用
国药控股上海生物医药有限公司作为疫苗领域的供应链-物流服务商,自主研发的“全溯”系统在遵照《疫苗追溯基本数据集》标准的同时,对追溯数据进行了扩展,并在疫苗供应链业务过程、物流作业过程和疫苗接种时进行追溯数据验证,初步验证了追溯数据扩展和验证在实际业务操作中的可行性,取得了良好的应用效果,主要应用场景如下。
6.1 疫苗流通全程验证场景
在物流收货、发货和接种单位接收疫苗时,通过追溯数据对疫苗来源单位、供应链业务单据和追溯码、冷链质量等进行验证,并通过验证服务实现对疫苗流向的报警和控制。
6.2 接种时的扫码验证场景
在疫苗接种时通过扫描追溯码进行追溯数据验证,检查待接种疫苗的当前状态、合法来源、有效期、流通过程是否冷链异常、是否被标注为异常疫苗等,确保验证通过的疫苗才能被接种使用。
6.3 异常疫苗锁定场景
基于疫苗批号和追溯码对异常疫苗进行标注,并调整疫苗状态为“待定”“待召回”“异常”,上传标注相关的原因、质量资料(如异常的温度数据),通过追溯平台的验证服务实现对异常疫苗的锁定。
6.4 通过追溯码跟踪业务操作过程和质量的场景
扩展追溯信息到供应链-物流业务信息和作业信息,通过扫描追溯码实现追溯数据关联供应链订单信息和物流作业信息及冷链配送信息,实现通过追溯码跟踪业务作业过程和冷链质量。
7、结 语
本文结合疫苗流通实际业务场景,提出了一种验证疫苗追溯数据完整性和数据合理性的方法,对疫苗追溯数据从业务操作过程和关联信息角度进行了扩展,既实现了通过追溯数据对业务作业过程的记录和再现,又确保了追溯数据的完整性和合理性,无论是通过追溯实现疫苗全流程上下游的数字化协作,还是通过追溯实现业务合规性监管都具备可操作性和较强的现实意义。