质量源于设计在制剂的设计过程中发挥到关键性的作用,使得最终的制剂产品安全有效,质量可控。本文以国内 28 篇文献为依据,对质量源于设计在制剂设计中的应用进行了概述和总结,阐述了质量源于设计(quality by design, QbD)的概念并探讨了其在药物制剂设计过程中发挥的作用;对 QbD 的总体研究思路以及其在固体制剂、液体制剂设计中的应用进行了概述并阐述了 QbD 理念在中药缓控释制剂的研发思路;最后总结了 QbD 理念在制剂设计中的应用前景并进行了讨论。质量源于设计理念在制剂设计中的应用是一种科学有效的新方法,具有很高的研究价值,具有着极其重要的作用。
质量源于设计(QbD)是于 2006 年由美国食品药品监督管理局(FDA)首次提出的一种先进的科学理念——用于药品的研发生产,随后,便被人用药品注册技术要求国际协调会(ICH)纳入了新药开发和质量风险管理规范当中。目前,质量源于设计这个先进理念正逐渐被人类认知并应用于各种制剂的研发生产制备当中,其正处于蓬勃发展的关键时期,而这一理念的应用,为人类药品研发生产制备带来的结果是的最终产品的高效生产率、高质量、低风险和低召回。根据ICH的质量指导文件中已明确提出的 QbD 原则[1]表明,建议医药行业应当从传统的“质量源于检测”的观念转变为“质量源于设计”的观念[2-3],进而从根本上进一步地改变医药行业的制剂研发制备生产的理念。
何谓“质量源于检测”,顾名思义,我们可以该理念理解为:药品的最终质量是否过关,只依赖于最终产品的检验环节;而“质量源于设计”则彻底打破了这种传统的理念,该理念强调的是从目标产品的设计源头开始,在设计及生产制备中就逐步进行“检验”,让制剂的整个研发生产过程伴随着检验。质量源于设计这种先进的理念在制剂的设计过程中,具有着得天独厚的优势,为高质量药品的生产奠定了基础。
1、QbD 的概念及其在药物制剂设计过程中发挥的作用
1.1QbD 的概念
根据 ICH Q8(R2)指南,其将质量源于设计(Quality by Design, QbD)这个理念定义成为“一套系统的研发方法,即从预定的目标开始,基于科学的风险质量管理技术,重视对影响药品性质的质量属性,重视对制备工艺过程的理解以及对生产过程的控制”。
实施 QbD 理念强调充分理解原料药物的性质和工艺参数对药品质量的影响,同时还强调对工艺参数的控制,将药物的处方设计研发、工艺参数的优化、过程质量的控制及质量的监督管理相结合,以加深对药品及其生产过程的理解[4-7],只有对药品研发制备生产过程有着更加深入层次的理解,才可以提高药品的质量。
按照 QbD 的概念,我们可以将其理解为“一个药品从开始研发就要考虑到药品的最终质量”,即在处方的设计及选择、制备工艺路线的确定及优化、工艺参数的选择及优化、物料配比的控制等各个相关方面都要进行深入的研究,积累详尽的理论和数据,在深入透彻理解的基础上,确定药品的最优配方配比和药品生产的最佳工艺路线,从而满足工艺参数的需求和最终产品的质量需求。
1.2QbD 理念在药品生产研发过程中发挥的作用
一个药品的生产研发过程是需要经过极其繁琐复杂的各种步骤,但无论研发生产方式如何,最终都殊途同归,目的都是要保证药物的安全有效且质量可控。基于 QbD 的这种理念,不但可以更加保证药品的安全有效性与质量可控性,同时还可以大大提高药品的生产效率,减少物料损耗。在未将 QbD 运用到药品生产研发中之前,药品的合格与否只依赖于药品的最终检验,而当QbD 的理念被发掘并投入其中之后,从过去的只单纯依赖药品的最终检验,到对生产过程进行合理的控制,再到药物的设计和研究阶段的控制,使得药品质量监管的位置逐渐前移。简单来讲,就是从源头上逐步强化了质量监督管理体系,是一种科学有效的控制方法,更加确保了药品质量,保证了药物的安全。在生产研发过程中,由于研发开始前积累了详尽的数据,并通过各种方法手段确定了最优的配方配比以及生产工艺路线,便大大降低了研发生产中的难度,提高了药品质量,降低了药品的召回率,同时,也大大提高了生产效率。
2、QbD 理念的总体研究思路以及其在制剂设计中的应用
固体制剂是我们非常熟悉的一种制剂,本综述将从以下几种不同剂型的药物对 QbD 进行概述——散剂、颗粒剂、片剂、胶囊剂、液体制剂、缓控释固体制剂和微球制剂,由于片剂、胶囊剂及缓控释固体制剂的制备工艺较为复杂,需要考虑的因素较为繁多,本综述会着重进行探讨。
2.1QbD 理念的总体研究思路
根据 QbD 的理念,一个药品的生产研发过程可以分为以下三个主要的阶段。第一个阶段是处方前研究阶段,即对所预选的化合物进行一些列基本性质的研究探讨,比如物理性质、化学性质等等,并且对研发风险进行一些列的评估,为后期生产研发提供各种依据和数据;第二个阶段是处方和工艺的设计及优化,使得药品的研发生产达到物料消耗最少,生产效率最优;第三个阶段是将最终设计空间转化为实际生产[8]即投入到车间生产。
基于 QbD 理念而实施的研发生产步骤,可以大致分为以下几步:第一,需要确定目标产品,也就是最终想要获得的产品;第二,针对于该目标产品,需要确定其质量概况(产品质量特征需求,QTPP);第三,确定该药品的关键质量属性(CQAs),并对其进行一系列风险评估;第四,定义该药品的设计空间(DS)——与关键质量属性相关联的关键物料属性(CMAs)和关键工艺参数(CPPs)的建立及优化,并对其进行风险评估;第五,定义工艺流程的设计空间;第六,设计并实施控制策略——控制工艺流程;第七,进行工艺验证;通过验证之后投入到实际生产中并且可以通过过程分析技术(PAT),对制备工艺进行持续的改进。
2.2QbD 理念在固体制剂设计中的应用
2.2.1 散剂
散剂相对于其他剂型而言,其制备工艺极其简单。虽然只需要药物粉末与辅料直接混合,但是需要考虑到的因素仍然有许多。例如粒度,水分,药物与辅料之间是否发生相互作用等等,若只进行产品的最终检验,且结果是不合格的情况下,会造成物料的浪费,增加了生产消耗。而将QbD 的理念运用其中,我们就可以在生产研发前,进行处方前研究,针对于所预选的药物化合物及辅料进行基本性质的研究,针对以产品特征需求和产品质量特征需求来严格筛选生产工艺参数和物料配比,增加对制备工艺的理解,进行风险评估逐步排查各个步骤中所存在的风险因素及问题,通过试验设计,对工艺进行优化及验证。这些大大提高了药品的质量并且降低了生产过程中误差的出现。在将质量源于设计理念应用于冰硼散散剂的质量研究[9]中,通过风险评估(RA),识别出影响该制备工艺参数的关键工艺步骤是物料的前处理(干燥、洗净、切割等)、粉碎、过筛、混合分装以及包装贮存,而影响关键质量属性(含量均匀度、装量差异、包装密封性等)的关键工艺参数包括过筛筛网的目数、混合时间、包装热合温度;通过试验设计(DoE),对关键质量属性、关键物料属性和关键工艺参数进行函数关系的确定,确定合适的设计空间和控制空间,对工艺及处方物料进行优化,确保了该散剂的有效性、稳定性和安全性。
2.2.2 颗粒剂
我们可以将颗粒剂理解为,在散剂的基础上,向其中加入一定量的粘合剂,制成干燥颗粒后所得的制剂。并且其制备过程相对于其他剂型而言也较为简单,但是在处方中由于粘合剂的加入,相当于物料的多样性有所增加,且由于其制备工艺的多样性,在制备、前、中后需要考虑的因素会有所增加,所以,颗粒剂的质量检查项目也有所增加,结合 QbD 的理念会使得制备的难度降低,在保证药品高质量的同时提高了生产效率。在基于质量源于设计理念的红花颗粒的制备实验中[10],经前期的处方前研究,确定了原料药及各种辅料的性质、各种物料的配比以及制备工艺的最优方法,在降低了制备该颗粒剂的难度同时提高了该颗粒剂各项质量检查项目的合格率。基于QbD 的理念,并通过对颗粒剂各项工艺参数的优化,使得所得产品的各项性质在一定程度上都达到了最优。所以我们不难看出,这便是融入 QbD 理念的优势所在,为颗粒剂的质量检查的高合格率提供了有效且合理的数据支持和理论依据,再者而言就是降低了制备过程中的各种风险的发生,使得生产制备过程较为顺利的完成。
2.2.3 片剂
片剂是原料药物与合适的辅料制备成的片状固体制剂,有多种制备工艺,由于片剂内需要多种辅料。如润湿剂、崩解剂、稀释剂、润滑剂,所以每种制备工艺均需考虑诸多因素,以保证药物与辅料之间,辅料与辅料之间的相互影响达到最优甚至相互无影响而达到相辅相成。若将一种药物制备成缓控释片剂,则其制备工艺会难上加难,并且需要考虑到骨架材料的缓控释效果以及是否影响药物的释放的诸多因素。片剂的崩解度会影响药物的吸收速率,这便要求物料的配比和制备工艺参数达到最优化,应用 QbD 理念将会使这种复杂的,有难度的,要求高的制备工艺相对简单化,研发制备之前的详尽的数据,为工艺参数的优化提供了数据支持;每个步骤的优化都相当于每个步骤的监管,大大提高了药品的质量,同时降低了物料的消耗。以仙曲片片剂薄膜包衣工艺为例[11],该实验以 QbD 理念为依据,采用合理的实验设计方法,通过建立合理的设计空间为仙曲片薄膜包衣过程提供了预测模型,提高了包衣过程的可控性和可适用性,保证了稳定的产品质量。在实验前,基于 QbD 理念进行实验步骤,首先明确了产品质量的目标,通过了解仙曲片理化性质,分析薄膜包衣过程中的各种风险因素,确立了关键工艺参数并对仙曲片薄膜包衣工艺进行设计与优化,取各项指标均符合药典标准的仙曲片素片,选择折光系数符合要求的包衣预混剂对其进行薄膜包衣,通过单因素实验进行筛选,利用 Box-Behnken 响应面法[12-13]优化薄膜包衣参数,筛选出仙曲片薄膜包衣最优的工艺参数并对其结果进行验证,为产品的工业化生产奠定了质量基础。通过 QbD 理念在该实验中的应用,使得制备的工艺参数趋于最优化,降低了生产操作中的误差,提高了药品的生产效率,降低了包衣过程的难度,使得整个制备工艺可以较为顺利的进行。
2.2.4 胶囊剂
胶囊剂相对于以上所述的三种固体制剂,由于其在原料药物和辅料之外还包装了空心胶囊或者软质囊材,所以胶囊剂有着更高的质量要求和更难的制备工艺。由于胶囊外壳和片剂包衣有着本质上的区别(无论是制备材料还是制备工艺),所以需要考虑的相互影响因素更加繁琐复杂,包括药物与辅料之间、辅料与辅料之间、药物与胶囊外壳之间和辅料与胶囊外壳之间。根据盐酸坦索罗辛缓释胶囊的处方工艺研究,其基于 QbD 的理念,应用于该药物的开发。由美国 FDA 批准的Flomax(盐酸坦索罗辛缓释胶囊)自上市以来,由于其疗效良好而被广泛应用。该试验以其为参比制剂,基于 QbD 的理念,制备了一种体外溶出行为与其相似的盐酸坦索罗辛缓释胶囊[14]。该药物在小肠中和胃部的释放度受较多条件的限制,所以其可以设计的空间较小。但是将 QbD 的理念应用于其中后,结果证明:应用 QbD 理念于其中后,不仅可以快速寻找出设计空间,而且还可使得该药物的质量得到了提高,对其制备进行了有效控制,降低了制备中的风险,同时提高了生产效率。
2.2.5 缓控释片剂
与传统的药物剂型相比,缓控释制剂具有显著的优势,首先最基本的一点就是可以延长药物在体内的半衰期,其次缓控释制剂使药物得释放趋于一个平稳的状态,避免了药物的突释所带来的副作用,可将药物浓度较长时间维持在最小有效浓度和最小中毒浓度之间,降低了用药的次数,显著提高了用药的安全性和患者的依从性[15]。
基于以上的优势,将药物制备成缓控释制剂已经逐渐趋于常态化,尤其是口服缓控释片剂最为常见,其中缓控释骨架片剂是占主导地位,其以亲水性凝胶骨架材料为释放药物的载体。现将QbD 理念融入到制备缓控释骨架片剂之中,将市售的茶碱缓释片作为参比制剂,以确定 QbD 理念在制剂制备中的科学有效性。制备缓释片的关键在于它的释药过程,该研究首先通过文献查阅了解茶碱的理化性质,茶碱的临床常用剂型为氨茶碱片剂,之后进一步确定了影响关键物料属性的各种因素,确定了处方的组成及物料配比,如粘合剂、稀释剂的性质及用量,并进行了风险评估,接着采用了 4 因素 3 水平 L18 正交表对实验进行了设计和试验,并且对试验结果进行了验证,确定了对实验有影响的关键工艺参数,最后找出了设计空间,进行了工艺参数以及处方组成的最优化和验证。由最后参比制剂和研究制备的制剂,对比了两制剂的释放度曲线的相似因子,表明融入 QbD 理念所制备的缓释凝胶骨架片各项均符合要求[16]。
2.3QbD 理念在液体制剂设计中的应用
液体制剂相对于固体制剂而言,剂量易于划分,药物以分子或者小微粒分散在分散介质中,药物吸收速度快,生物利用度较高,同时可减少药物的刺激性[15]。以下着重介绍 QbD 在注射剂设计中的应用和注射用无菌粉末设计中的应用。
2.3.1 注射剂
注射剂作为目前临床应用范围较广的剂型之一,除了具有上述优点以外,还具有以下特点:
①可以定位给药和局部给药
②无法口服的药物可以制备成注射剂
③无法口服给药的患者可用注射剂给药。
注射液是直接进入血液循环中,所以风险系数相对于片剂更高[17],就要求其需要更高且更多的质量要求,如要求无热源,无菌,不溶性微粒、渗透压、Ph 应符合要求等诸多质量要求,所以无论是在制剂设计还是研发生产过程中,对每一步的所得产品的质量控制应更为严格合理。应用 QbD 理念进行注射剂的研发生产具有重大意义,主要是对引起注射剂的一切风险来源进行分析,包括处方因素和工艺因素,并且应用 QbD 对注射剂进行有效的质量控制,使得最终的产品达到安全有效、质量可控。
首先应对注射剂的风险来源进行分析,主要包括无菌保证是否合格、热源、不溶性微粒(生产过程中引入的杂质)、注射器具和储存器具对药物稳定性的影响。根据 QbD 对上述风险进行研究,包括处方、制备工艺以及储存,通过对外界环境中和生产过程总的影响因素进行科学有效的控制,使以上风险降至最低甚至不存在。其次通过查阅文献或者是对原研药的说明书进行解读,定义目标产品的质量概况,由风险来源分析,确立关键质量属性,包括无热源,无菌,不溶性微粒、渗透压、pH 和颜色。再次是对关键物料属性进行分析,如分配系数、溶解度、pKa 等等,对处方工艺进行风险评估,最为重要的是无菌保证,即对灭菌工艺进行风险评估,在条件允许的情况下,选择风险最小的灭菌工艺,一般为过度灭杀法。然后进行设计空间的寻找并进行试验设计,确立关键工艺参数并进行有效控制,最终得到最优的处方和工艺参数达到产品的安全有效、质量可控[17]。
2.3.2 注射用无菌粉末
注射用无菌粉末亦被称为粉针剂,根据生产制备的工艺路线的区别,可将其分为注射用无菌分装制品和注射用冷冻干燥制品[15]。二者的质量要求除上述相同之外,还有装量差异,和冷冻干燥工艺的要求应符合规定。
2.3.2.1 注射用无菌分装制品
注射用无菌分装制品中的风险来源除除无菌保证是否合格、热源、不溶性微粒(生产过程中引入的杂质)、注射器具和储存器具对药物稳定性的影响之外,还包括装量差异以及药物的稳定性。通过文献查阅得知影响装量差异的因素是待分装制品的流动性,因其会对产品的质量产生影响,所以也同样是关键物料属性(CMAs)之一。通过对关键物料属性的识别,通过各种方法进行有效的控制,若由于物料吸湿性较高而引起的流动性较差,应通过试验设计寻找出适宜的环境湿度并且控制储藏的密封性;若由于药物本身的流动性差,可通过试验设计寻找出合适的方法如粉碎或者是喷雾干燥以改变物料粒度大小和形态[15]。寻找设计空间以确保各因素变动的可接受范围内,药物治疗得到有效控制。
2.3.2.2 注射用冷冻干燥制品
注射用无菌粉末中的风险来源除无菌保证是否合格、热源、不溶性微粒(生产过程中引入的杂质)、注射器具和储存器具对药物稳定性的影响之外,还包括冷冻干燥工艺参数的影响,即关键工艺参数(CPPs)之一,冷冻干燥可能会引入的风险因素包括,药物含水量过高、产品外形不饱满、喷瓶[15]。应对该工艺进行风险评估,通过试验设计制定有效的控制策略,并对该工艺进行优化,这要求对该工艺进行深入层次的理解,考察关键工艺参数的可变动范围,确保药品质量在可接受范围内满足需求。
2.4中药缓控释制剂
中药可以说是一种复方制剂,与现阶段应用极为广泛的化学药物相比,它包含的成分复杂且繁多,用途多,作用位点不明确,不同用途的有效成分有可能存在差异,并可能存在不明确的成分。因此若想对中药制剂进行有效的质量控制,而进行有效合理的控制就在于 QbD 理念的融入,即在目标产品的设计过程中,寻找并确定影响关键质量属性和关键工艺参数的因素进而将其优化[18]。现以模拟制备中药渗透泵片剂为例,遵循 QbD 的研发理念,应在制备该制剂时,考虑一下要点:首先明确该中药渗透泵片的用途,由于中药中成分复杂繁多,应明确其主要有效成分;其次确定该有效成分的累计释放度并绘制曲线;再次是关键质量属性(CQAs)的确定:在渗透泵片剂中,关键的物料影响因素有很多,比如致孔剂的用量和类别;渗透压活性物的用量和类别;推动剂的用量和类别;半透膜材料的选择;包衣液的浓度和增塑剂的用量及类别[19],然后就是通过风险评估,寻找制剂生产的风险因素,进行试验设计(DoE)来确定关键工艺参数(CPPs)及其设计空间(DS),在设计空间的可接受范围内,控制关键影响因素并寻找到风险最低的制备工艺,来提升制备工艺的稳定性和灵活性[20]。中药的缓控释制剂属于近些年来中药制剂中研究的热点与焦点,极具应用前景,将 QbD 理念与中药缓控释制剂结合,一定是极具发展前途的研发制备方法。
2.5微球制剂
微球是指将主药溶解或者分散在天然或者合成的高分子材料中所形成的微小球状聚合物;微球制剂主要由主要和高分子材料两部分组成,其中高分子材料作为载体必须是生物可降解的。在微球制剂的研发过程中应用 QbD 理念,以得到最优的微球制剂。
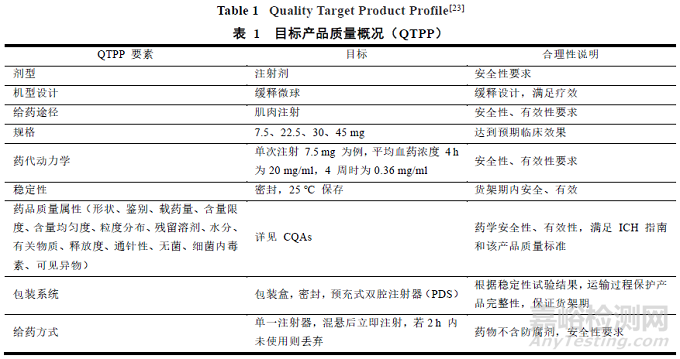
首先需要通过查阅文献,运用 QbD 理念确定微球制剂的 QTPP,以醋酸亮丙瑞林微球[21-22]为例进行概述。首先,目标产品的质量概况包括要素包括剂型、剂型设计、给药途径、规格、药代动力学、稳定性、药品质量属性和给药方式,见表 1[23]。
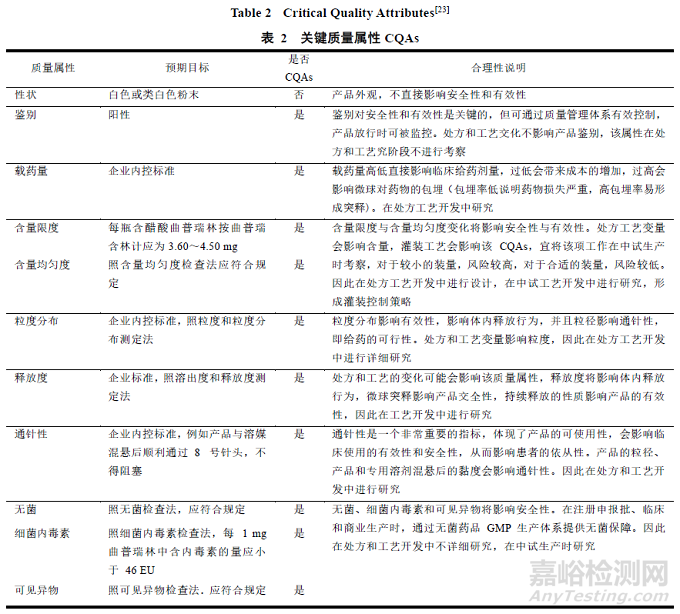
其次,确定产品的 CQAs——物理、化学、微生物、生物性质或者特征,应确保 CQAs 在界定的范围内,从而达到预期产品的质量合格[24]。
参照国家食品药品监督管理总局注射用醋酸曲普瑞林进口药品注册标准(JX20160400),并结合上文文献,经初步分析得出微球制剂的 CQAs,包括鉴别、载药量、含量限度、含量均匀度、粒度分布、残留溶剂、水分、有关物质、释放度、通针性、无菌、热源、可见异物。见表 2[23]。
第三步,进行风险评估以确定出对 CQAs 有影响的 CMAs 和 CPPs,进一步加深对工艺的理解。第四步确定设计空间,合理的设计空间确保了产品的高质量;通过查阅文献,对已掌握的知识和经验进行总结,在理论上首先建立知识空间,在该基础上通过风险评估、试验设计来确定出最终的设计空间。第五步控制工艺流程,即得出一个符合各项质量标准的控制空间。在控制空间内,对产品质量和工艺流程产生影响的一系列因素会得到有效控制,确保其在可控空间范围内。最后便是对该产品的不断改进和改善过程。
3、QbD 在制剂设计中的应用前景
应用 QbD 理念生产制剂的目的就是在制剂过程中对产品的质量进行科学有效的控制[25-30],高质量的药品指的是药品质量稳定,更是适用人群对药品的认可度或好评度,控制和优化药品的制备工艺和配料配比便是优化药品质量的关键一环,QbD 理念就是因此而诞生。
目前,QbD 理念在固体制剂和注射剂中具有着的广泛应用,虽然基于 QbD 理念的制备,会使得在研发生产的前期投入较大量的人力、物力、精力和财力,但是从长远来看,QbD 的实施使药物产品在生产过程中的浪费率和生产消耗都显著降低,同时提高了劳动效率,对控制工艺保证质量起到了决定性的作用[31-32]。
我认为在质量源于设计的核心在于设计空间(DS),设计空间在一个药品的整个研发制备生产过程中起到核心作用,我们可以将其理解为,在传统方法的基础上,找出更宽泛的合适且合格的空间来对药物的物料配比、生产工艺等进行修改优化,在设计空间中,各因素在可接受的范围内变动,均不会影响最终产品的质量稳定,这一点可以通过很普通且实际的例子来反映,实验室小规模制备到实际生产,这一工艺放大的过程,需要保证最终生产的产品质量稳定,这就可以理解为在设计空间内寻找出的可接受范围,在这一范围内,各种因素的变化及波动都不会影响到最终产品的质量,这一优势可以为我们解决研发生产过程中的难题,具有极其重要的应用价值和极其广泛的应用范围。
在监督管理方面,传统的药品制备前、中、后的每个操作单元之间虽有一定的联系,但联系的并不紧密,也没有将各个单元之间结合。而基于 QbD 的理念,则是将研发、审评、生产和监管等多个单元有机地结合起来,从根本上为控制并提高药品的质量奠定了一定的科学基础,为药品的监督管理提供了新的理念和方法,并且由于风险评估和工艺验证的存在,目标产品的制备难度会大大降低而最终产品的质量则会显著提高。
在生产制备方面,传统的药品生产制备中,由于不存在所谓的处方前研究,没有详尽的试验数据,没有确立制备工艺的最优参数,更没有设计空间的建立,所以生产完成的药品不合格率相比于现如今基于 QbD 理念而设计生产出的药物低很多,强制召回不合格药物的事件也时有发生。并且在传统的药品生产制备方法中,由于设备的改变以及磨损、物料的变更、环境的差异以及生产人员的经验不同,很容易造成产品批次间质量的不稳定甚至不合格。
基于以上所述,QbD 理念能显著提高药品的质量稳定性和生产研发效率,并且缩短药物的审批时间,降低产品的制备成本,减少产品不合格、召回的概率,更重要的是降低了药品生产研发过程中物料的浪费和生产消耗。这一先进的理念为人类提供了无法言喻的便捷并带来了极其出色的效果,但其潜在的应用性一定还远不如此,我相信,在不久的将来,QbD 理念将不仅仅应用于固体制剂、注射剂等常用剂型,甚至在纳米级制剂,靶向性制剂中,都会出现基于 QbD 理念而设计出的各种制剂,在不久的未来,QbD 理念的应用只会更加地深入、更加的广泛、更加的灵活,为各种新剂型的成功研发制备提供有力保证。
4、讨论
QbD 理念在制剂设计中的应用已经得到了较为广泛的认可,它是一个将监管体系、风险控制和优化深化集于一体的药品研发方法,最重要的是,它将药品质量的控制迁移至药品的设计阶段,从源头实施质量管理,对药品的高质量生产具有决定性作用。并且,在检验药品是否合格时,可以通过双重判定标准来提高药品的质量,即要求最终药品既要满足药品质量的合格标准,又要使药品的各因素均在设计空间的界定范围内,从而获得最优的产品。
参考文献
[1]ICH.Pharmaceutical Development[EB/OL]. http://www.ich.org/products/guidelines/quality/article/quality -guidelines.html.
[2] U.S. Department of Health and Human Services, Food and Drug Administration, Center for Drug Evaluation and Research (CDER), et al. Guidance for industry: PAT–A framework for innovative pharmaceutical development,manufacturing and quality assurance [EB/OL]. http://www.fda.gov/downloads/Drugs/Guidances/ucm070305.pdf .
[3] HINZ DC. Process analytical technologies in the pharmaceutical industry: the FDA's PA T initiative[J]. Anal Bioanal Chem, 2006,84(5): 1036-1042.
[4] SINGH J. International conference on harmonization of technical requirements for registration of pharmaceuticals for human use[J]. J Pharmacol Pharm, 2015,6(3): 185-187.
[5] 龚行楚, 陈滕, 瞿海斌. 基于质量源于设计理念的中成药二次开发研究进展[J]. 中国中药杂志, 2017,42(6):1031-1036.
[6] MEHTAP S, SEVGI T. Development and in-vitro evaluation of pH-independent release matrix tablet of weakly acidicdrug valsartan using quality by design (QbD) tools[J]. Drug Dev Ind Pharm, 2018,12(44): 1905-1917.
[7] 连传运, 徐冰, 王秋平, 等. 中药质量源于设计应用:工艺控制策略[J]. 世界中医药, 2018,13(3): 561-565.
[8] ICH. Pharmaceutical development Q8(R2)[EB/OL]. Geneva: ICH, (2009-08-01)[2018-08-01]. http:// www. ich. org /fileadmin/Public WebSite/ICH_Products/Guidelines/Quality/Q8_R1/Step4/Q8_R2_Guideline.pdf.
[9] 王晓伟, 王艳伟, 刘亚楠, 等. 基于质量源于设计理念的上市冰硼散质量评价研究[J]. 中南药学, 2019,17(11):1898-1902.
[10] 王永洁, 陈柽, 邓莉莉, 等. 基于质量源于设计理念的红花颗粒制备工艺及物理指纹图谱研究[J]. 中草药,2019,50(17): 132-139.
[11] 韩天燕. 基于质量源于设计理念的仙曲片薄膜包衣工艺研究[J]. 中草药, 2018,49(11): 2564-2570.
[12] 万丹, 张水寒, 肖娟, 等. Box-Behnken 设计-效应面法优选酒黄连炮制工艺[J]. 药物评价研究, 2014,37(4):341-345.
[13] 江敏瑜, 闫丹, 陈娇, 等. 三七跌打软膏的制备及体外透皮特性研究[J]. 中草药, 2017,48(22): 4639-4647.
[14] 黄芸, 谢俊, 杨俊, 等. 基于QbD 理念的盐酸坦索罗辛缓释胶囊的处方工艺研究[J]. 药学与临床研究,2018,26(1): 9-13.
[15] 方亮. 药剂学:第8 版[M]. 北京:人民卫生出版社, 2016.
[16] 姜希伟, 费云扬, 连桂玉, 等. 基于QbD 理念的茶碱凝胶骨架缓释片处方工艺设计与优化[J]. 中国药房,2019,30(18): 2502-2507.
[17] 蒋煜, 杨建红, 王亚敏. “质量源于设计”在仿制注射剂处方工艺研究中的应用[J]. 中国新药杂志, 2014,23(8): 921-924,954.
[18] 阳长明, 王建新. 论中药复方制剂质量源于设计[J]. 中国医药工业杂志, 2016,47(9): 1211-1215.
[19] 郑金凤, 杜佩佩, 闫红波, 等. 丹参多组分渗透泵片的制备及体外释放度的考察[J]. 北京中医药大学学报,2012,35(6): 394-398.
[20] 王逸飞, 朱振宇, 吴志生, 等. QbD 理念的中药缓控释制剂的设计与研发研究[J]. 中国中药杂志, 2019,44(20):4317-4321.
[21] FDA. Approval Date(s) and History, Letters, Labels, Reviews for NDA 019732[EB/OL]. [2020 -04-12] https://www.accessdata. fda.gov/drugsatfda_docs/label/2019/020517s042, 019732s044lbl.pdf.
[22] FDA. Approval Date(s) and History, Letters, Labels, Reviews for NDA 019732[EB/OL]. [2020-04-12] https://www.accessdata.fda.gov/drugsatfda_docs/nda/2005/019732_S029_Lupron%20Depot_APPROVAL%20PACKAGE.pdf .
[23] 安广峰, 吕丕平. QbD 理念在微球制剂开发中的应用[J]. 上海医药, 2021,42(5): 77-81.
[24] ICH. Pharmaceutical Development Q8(R2) [EB/OL]. [2020-04-12]. https: //database.ich.org/sites/default/files/Q8_R2_Guideline.pdf.
[25] 张娟娟, 孙巍, 王萍, 等. 基于分析方法质量源于设计(QbD)的复方丹参滴丸皂苷指纹图谱开发方法初步研究[J]. 中草药, 2017,48(19): 3992-3997.
[26] TECKEO J, MASCARO T,FARRELL T P, et al. Process optimization of a novel immediate release film coating system using QbD principles[J]. AAPS Pharm Sci Tech, 2013,14(2): 531-540.
[27] 张俊鸿, 何雁, 许燕, 等. 基于质量源于设计理念的风咳颗粒喷雾干燥工艺研究[J]. 中草药, 2017,48(10):2061-2066.
[28] 冯怡, 洪燕龙, 杜若飞, 等. QbD 理念的中药新药成型工艺研发模式的探讨[J]. 中国中药杂志, 2014,39(17):3404-3407.
[29] MAZUMDER S, PAVURALA N, MANDA P , et al. Quality by design approach for studying the impact of for mulationand process variables on product quality of oral disintegrating film[J]. Int J Pharm, 2017 ,527: 151-160.
[30] 张小飞, 邢传峰, 果秋婷. 基于质量源于设计(QbD)理念优化穿心莲内酯固体脂质纳米粒[J]. 中草药, 2015,46(2): 194-200.
[31] PATWARDHAN K, ASGARZADEH F, DASSINGER T, et al. A quality by design approach to understand formulationand process variability in pharmaceutical melt extrusion processes[J]. J Pharm Pharmacol, 2015,67(5): 673 -684.
[32] KOVACS S, BERKO E, CSANYI I, et al. Development of nanostructured lipid carriers containing salicyclic acid for dermal use based on the quality by design method[J]. Eur J Pharm Sci, 2017,99: 246-257.