今日头条
上海海和MET抑制剂获批附条件上市。海和药物MET抑制剂谷美替尼片获国家药监局附条件批准,用于治疗MET外显子14跳变的局部晚期或转移性非小细胞肺癌(NSCLC)。在II期临床SCC244-108(GLORY)中,谷美替尼在总体人群、初治患者以及既往经治患者的ORR分别为60.9%、66.7%、51.9%;中位缓解持续时间(DoR)为8.2个月,中位无进展生存时间(mPFS)为7.6个月。在美国,该药已获得FDA授予孤儿药资格。
国内药讯
1.度普利尤单抗新适应症在华报产。赛诺菲IL-4/IL-13抑制剂度普利尤单抗新适应症的上市申请获国家药监局受理,新适应症推测为用于成人结节性痒疹(PN)的治疗。两项III期研究PRIME和PRIME2结果显示,度普利尤单抗治疗组瘙痒较基线显著改善的患者比例分别达到44%和37%,安慰剂组分别为16%和22%。该疗法此前已在中国获批用于中重度特应性皮炎适应症。
2.FIC淀粉蛋白抗体启动国际Ⅲ期临床。阿斯利康及其旗下Alexion公司登记启动一项国际(含中国)Ⅲ期临床,计划在Mayo IIIb期AL型淀粉样变性初治患者中评价其潜在“first-in-class”纤维反应性单抗药物CAEL-101联合浆细胞病治疗对比安慰剂联合浆细胞病治疗的有效性和安全性。该研究中国主要研究者由中国医学科学院北京协和医院医学博士张抒杨担任。
3.华东医药小分子GLP-1R激动剂报IND。华东医药自研1类化药HDM1002片的临床试验申请获CDE受理。HDM1002是第7款申报临床的国产小分子GLP-1R激动剂;国内同类产品锐格医药的RGT-075以及华东医药引进的TTP273均已进入II期临床开发阶段。目前已上市GLP-1R激动剂如司美格鲁肽、利拉鲁肽等,多为多肽类注射药物,尚无小分子GLP-1R激动剂上市。
4.深圳新合mRNA肿瘤疫苗报胃癌IND。深圳新合生物1类生物制品XH101注射液的临床试验申请获CDE受理。XH101是一款全球首创、靶向胃癌公共新抗原的治疗性mRNA肿瘤疫苗,已在临床前研究中显示出能有效激发患者的T细胞免疫应答及肿瘤细胞杀伤效应,具有显著的临床治疗潜力。据IARC统计,2020年全球约有110万胃癌病例,中国患者占据其中的43.9%,约48万例,位居全球第一。
5.上海医药CDK4/6抑制剂开展联合用药研究。上海医药CDK4/6口服小分子抑制剂SPH4336拟联合康方生物PD1/CTLA-4双特异性抗体开坦尼®(卡度尼利单抗注射液)开展联合用药临床研究,评估用于治疗高分化脂肪肉瘤(WDLS)/去分化脂肪肉瘤(DDLS)等适应症的安全性与有效性。SPH4336已在治疗晚期实体瘤的I期临床获得安全性结果,并显示出良好的药效。目前,FDA已批准SPH4336针对局部晚期或转移性脂肪肉瘤开展II期临床试验。
6.中生制药收购F-star获CFIUS批准。美国外国投资委员会(“CFIUS”)批准中国生物制药全资附属公司invoX以现金约1.61亿美元收购F-star公司。通过收购,中国生物制药获得该公司新一代双特异性抗体平台以及3款处于临床阶段的双特异性抗体(FS118、FS222和FS120)。其中,FS118是一种靶向PD-L1及LAG-3的双检查点抑制剂,目前正在Ⅱ期临床中用于治疗头颈部癌症患者;FS222是一款靶向CD137(4-1BB)及PD-L1的双抗药物;FS120是一款靶向OX40及CD137的双重激动剂。
国际药讯
1.Novan公司FIC抗病毒凝胶报NDA。Novan公司潜在“first-in-class”局部抗病毒凝胶SB206(10.3% berdazimer)的新药上市申请(NDA)获FDA受理,用于治疗传染性软疣,PDUFA日期为明年1月5日。在关键Ⅲ期临床B-SIMPLE4中,SB206治疗12周后患者实现病灶完全清除的患者比例更高,具统计学意义的显著改善(p值<0.001),药物耐受性良好,没有报告药物相关严重不良事件,最常见的不良事件多为应用部位的轻度疼痛和轻中度红斑。
2.阿斯利康引进ASO疗法报NDA。Ionis与阿斯利康联合开发的反义寡核苷酸(ASO)疗法eplontersen的新药申请(NDA)获FDA受理,用于治疗遗传性转甲状腺素蛋白(TTR)介导的淀粉样变多发性神经病变(ATTRv-PN),PDUFA日期为今年12月22日。III期NEURO-TTRansform研究中期结果显示,Eplontersen治疗使患者的血清转甲状腺素浓度较基线平均降低81.2%(p<0.0001),患者mNIS+7评分自基线的改变百分比与安慰剂组相比也具有显著性改善。
3.杨森IL-23R拮抗剂银屑病Ⅱb期临床积极。杨森与Protagonist公司联合开发的IL-23R拮抗多肽JNJ-2113治疗中重度斑块状银屑病的Ⅱb期临床(FRONTIER 1)达到主要终点。与安慰剂相比,JNJ-2113治疗的患者达到PASI 75标准的患者比例更高,具统计学显著性;药物的耐受性良好,药物组各组别患者产生不良反应的比率与安慰剂组相当。详细数据将于2023年第2季度的医学会议当中公布。
4.体内CRISPR基因编辑疗法获批临床。FDA批准Intellia公司体内CRISPR基因编辑疗法NTLA-2002的新药研究(IND)申请,拟用于治疗遗传性血管性水肿(HAE)。NTLA-2002通过脂质纳米颗粒(LNP)以mRNA形式递送CRISPR-Cas9基因编辑系统,靶向敲除KLKB1基因,以永久性降低血浆中激肽释放酶活性,从而防止HAE的发作。公布在ACAAI2022年会上的Ⅰ/Ⅱ期临床显示,NTLA-2002(25mg和75mg)治疗使患者的激肽水平降幅分别达到64%与92%。
5.A型血友病基因疗法再遭FDA延迟审查。Biomarin公司A型血友病基因疗法Roctavian的生物制品许可申请(BLA)的PDUFA日期被FDA推迟至2023年6月30日。这是FDA第二次延长Roctavian的BLA审查时间。Roctavian旨在通过一次性治疗使患者获得表达FVIII的基因,解决患者需要长期注射预防性凝血因子的需求。III期GENEr8-1研究3年分析数据显示,患者的平均年出血事件率减少了80%,而凝血因子VIII的使用减少了94%,而且有92%的患者还不需要预防性治疗。
6.神经疾病药物公司Rapport完成A轮融资。神经疾病精准药物公司Rapport宣布完成1亿美元A轮融资。Rapport公司的开发策略利用受体相关蛋白(RAP)来开发针对已经过遗传学和临床验证的靶点,有望为目前没有有效疗法的神经疾病提供精准的小分子治疗药物。目前,该公司主打在研项目正在针对耐药性癫痫发作适应症开展Ⅰ期临床研究,评估药物的安全性与初步疗效。
医药热点
1.江苏首家宫颈癌综合防治一体化门诊成立。3月7日上午,“扬州市宫颈癌综合防治一体化门诊”在扬州市妇幼保健院正式揭牌。这是江苏省首个设区市妇幼保健院开展消除宫颈癌项目的示范点,旨在加快推进“HPV疫苗接种、宫颈癌筛查、诊治和救助相衔接”的宫颈癌三级综合防治模式,积极探索“预防为主、医防融合、规范康复”的扬城模式,为江苏全省消除宫颈癌工作提供更多经验和借鉴。
2.江苏大学扬中临床医学院成立。3月1日,江苏大学扬中临床医学院揭牌仪式在扬中市人民医院隆重举行。江苏大学党委书记袁寿其表示,校院双方将以此次揭牌为契机,大胆探索,努力实践,不断深化校院合作,在拓宽发展新空间、发挥临床医学院职能、促进医教协同三个方面加以推进,努力开创医疗卫生人才培养、科技创新和社会服务事业的崭新局面。
3.全国人大代表庞国明建议建立中医疫病防治体系。全国两会期间,全国人大代表、河南省开封市中医院理事长庞国明建议,建立国家中医疫病防治体系,全面加强中医医疗机构发热门诊感染性疾病科、肺病科等重点科室的建设,将中医药应急队伍纳入卫生应急队伍建设统筹规划,全方位融入国家传染病防治的预防、救治、康复、研究等整体防控救治体系。
4.智利发现首例水獭感染禽流感病例。当地时间7日,智利国家渔业和水产养殖局发布消息称,实验室人员在阿里卡地区发现的一具水獭尸体中检测出禽流感病毒。这是智利发现的首例水獭感染禽流感病例。据悉,这具雄性水獭的尸体在一处海滩附近的湿地被防疫专家发现,一同被发现的还有一些鸟类的尸体。目前在智利12个地区的野生鸟类中,同类病毒均有发现。
评审动态
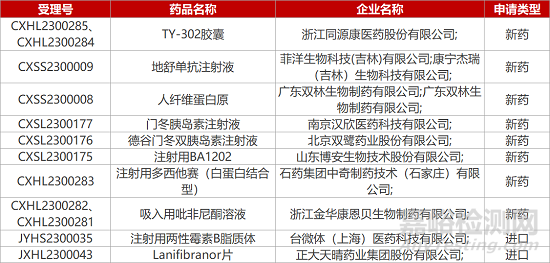
1. CDE新药受理情况(03月08日)
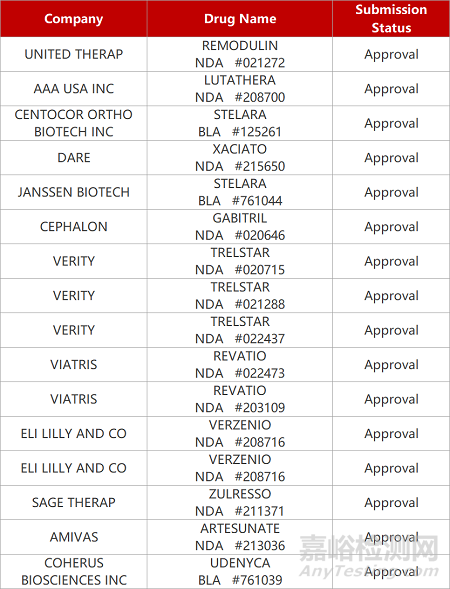
2. FDA新药获批情况(北美03月07日)