您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2024-04-26 08:27
在从大体积材料转向多孔材料时,在可生物降解材料中调和快速降解和过量毒性之间的两难境地具有挑战性。在骨科领域,锌生物可降解材料具有优异的力学性能、成骨和抗菌生物活性,被广泛研究应用于螺钉和钢板系统、髓内针、骨移植、引导骨再生膜等。近日,北京航空航天大学杨宏韬、王晓刚、清华大学温鹏、北京大学郑玉峰通过骨免疫成化实现了显著的骨向内生长到具有 90% 孔隙率的Zn多孔支架中。在微尺度上,采用一种含0.8 wt% Li的合金,形成具有LiZn4和Zn相的共晶状层状结构。这种微结构平衡了高强度和免疫调节效应。在中尺度上,具有纳米级粗糙度的表面模式促进丝状伪足形成和巨噬细胞扩散。在宏观尺度上,各向异性最小表面G单位比各向异性体心立方单位具有适当的均匀性降解率。在体内,G支架在促进巨噬细胞向抗炎表型极化方面表现出更高效率,随后导致成骨标志物显著升高,胶原沉积增加,新骨形成增强。在体外,转录组学分析显示,巨噬细胞中JAK/STAT通路的表达通过上调IL-4、IL-10的表达,从而促进成骨。
相关研究成果以“Multiscale architecture design of 3D printed biodegradable Zn-based porous scaffolds for immunomodulatory osteogenesis”为题于2024年4月11日发表在《Nature Communications》上。
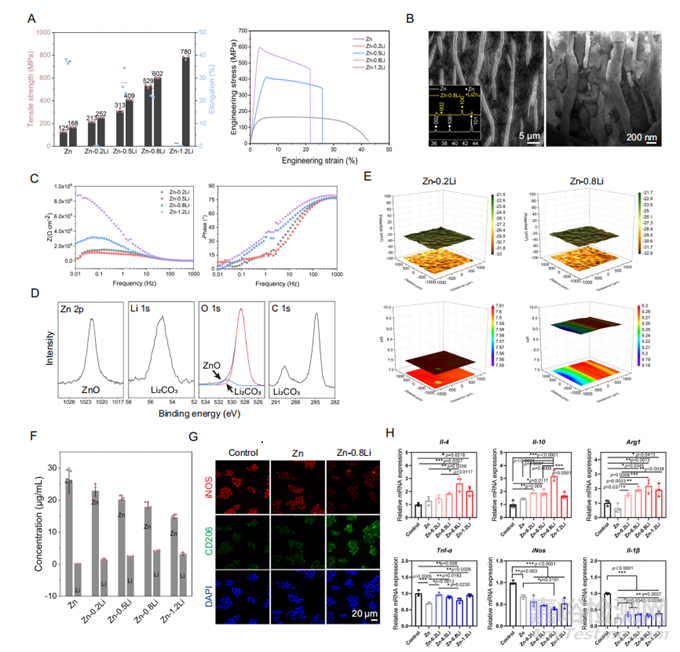
图1 用于生物降解骨支架的Zn合金组合设计
具有骨免疫调节能力的生物可降解锌支架的优越力学性能和适当表面腐蚀及离子释放行为是主要考虑因素。对于Zn-Li合金,强度、塑性和Li元素的加入之间存在权衡(图1a)。由Zn和LiZn4组成的层状微观结构主要出现在Zn-0.8Li合金中,层间距为200–300 nm(图1B)。当材料浸入模拟体液(SBF)中时,材料的表面阻抗随着Li含量的增加而显著增加(图1C)。在SBF中浸泡24小时后,氧化锌(ZnO)和碳酸锂(Li2CO3)是SBF-氧化锂合金中的主要腐蚀产物(图1D)。Zn-0.2Li和Zn- 0.8Li合金的表面电位分布相似,且在SBF中是均匀的(图1E)。在细胞培养基中,Li部分替代锌的释放(图1F),在Zn-0.8Li合金中,Zn:Li比约为4:1。与对照组和纯锌组相比,Zn-Li合金组的CD206表达更多,iNOS表达更少(图1G),特别是在Zn-0.8Li组中。免疫调节细胞因子IL-4、IL-10、Arg1的RNA表达在Zn-0.8Li合金组达到峰值,同时抑制促炎细胞因子TNF-ɑ、iNOS、IL-1β等促炎细胞因子的RNA表达(图1H)。
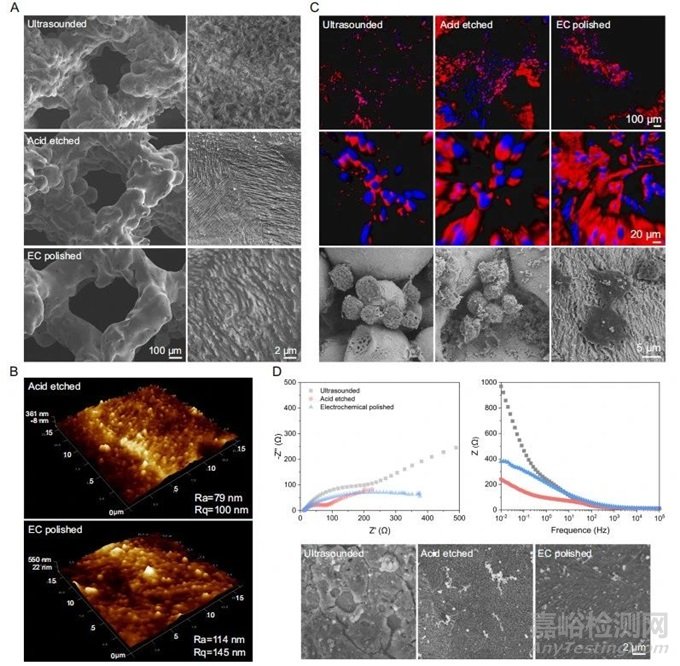
图2 Zn-0.8Li支架的表面形态及性能
超声处理后,支架仍覆盖未熔化的粉末和致密的氧化层(图2A)。AFM图像显示酸蚀刻表面有序的突起,Ra约为79nm(图2B)。将RAW264.7细胞接种在支架上,观察细胞与表面模式之间的相互作用(图2C)。Nyquist和bode图显示,与打印表面相比,酸蚀刻以较小的阻抗激活支架表面,而EC抛光在一定程度上使表面重新钝化(图2D)。
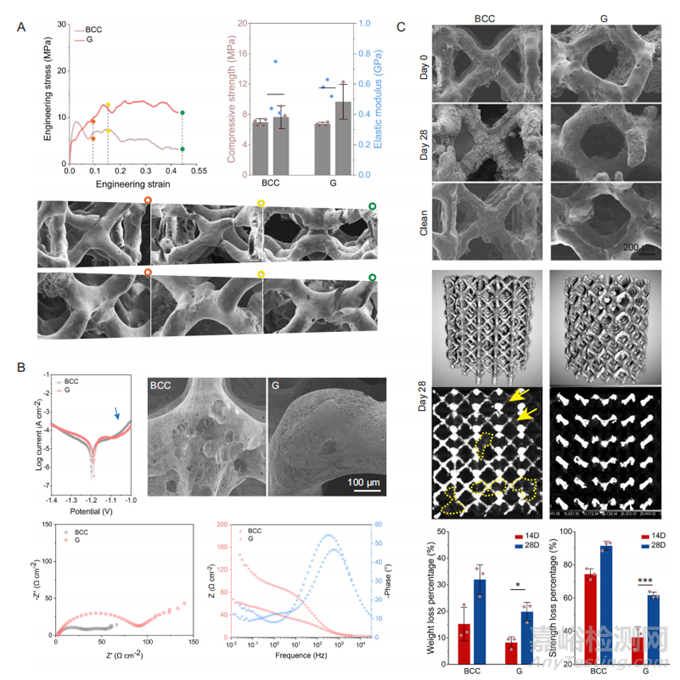
图3 具有体心立方(BCC)和G孔单元的Zn-Li多孔支架的机械性能和腐蚀性能
图3A显示了具有BCC和G孔单元的Zn-Li多孔支架的单轴压缩行为。通过电化学试验了解孔隙单元对Zn-Li支架早期腐蚀行为的影响(图3B)。然后将样品浸入模拟体液动态灌注的专用室中28天,以了解孔隙单元对Zn-Li多孔支架长期腐蚀行为的影响(图3C)。使用G单元的支架中腐蚀产物较少,且大部分金属支柱在28天内保持完整。
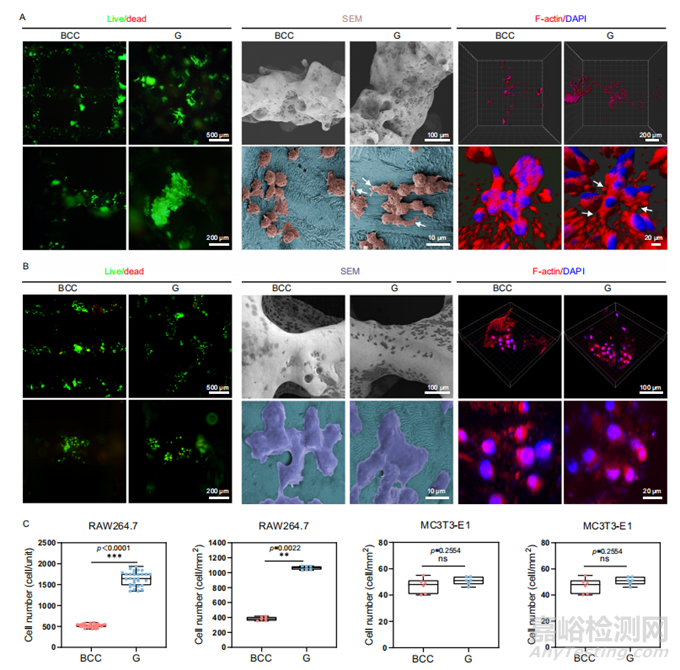
图4 具有BCC和G孔单元的Zn-Li多孔支架的RAW264.7和MC3T3-E1细胞的体外生物相容性评估
RAW264.7和MC3T3-E1是骨缺损修复过程中的两个主要效应细胞。单元几何形状对RAW264.7和MC3T3-E1粘附和增殖的影响如图4所示。活/死染色显示,大部分RAW264.7和MC3T3-E1细胞在两种支架上均存活48 h。G单元上的RAW264.7细胞具有广泛的富含F-肌动蛋白的丝状伪足;MC3T3-E1紧密粘附在多孔支架表面并扩散,细胞伸长并与周围细胞相互作用,呈现出拉伸的细胞骨架。
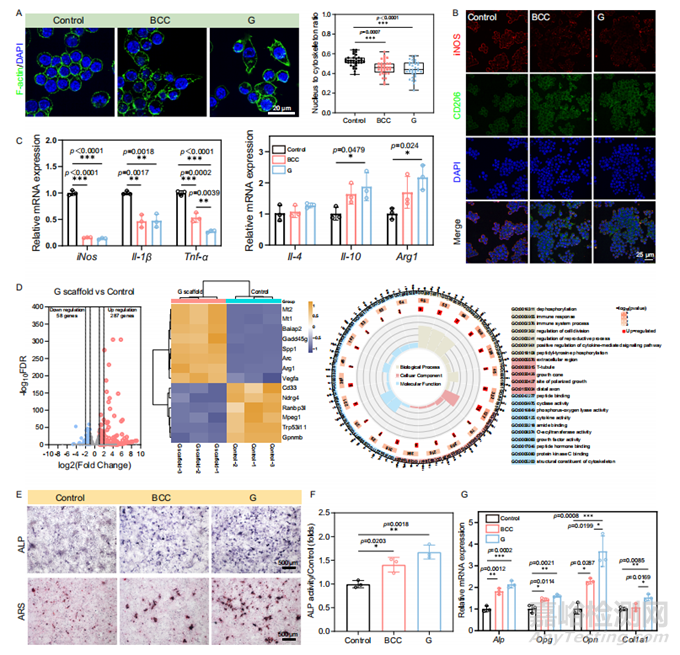
图5 Zn-Li多孔支架调节巨噬细胞极化,诱导体外成骨分化
与用 BCC 支架处理的巨噬细胞相比,G支架处理的巨噬细胞的细胞核与细胞骨架面积比较低(图5A),表明G支架最大限度地拉伸细胞骨架。BCC和G支架组均显著上调 CD206 表达,同时抑制 iNOS 表达(图5B)。与对照组相比,BCC支架组和G支架组中与M1表型相关的基因表达下调,而与M2表型相关的基因表达均上调(图5C)。为了探讨G支架诱导巨噬细胞极化的生物分子机制,采用转录组分析分析Zn组和对照组巨噬细胞的信号通路差异(图5D)。火山图显示有287个上调基因和58个下调基因,表明存在广泛的基因表达差异。为了研究巨噬细胞极化对成骨分化的影响,将MC3T3-E1细胞在含有成骨成分的条件培养基(CM)中培养。第14天对矿化基质中钙结合蛋白的ARS染色显示,G支架组的钙结节的大小和数量都高于BCC组,表明MC3T3-E1细胞的钙沉积效率更高(图5E、F)。采用qRT-PCR方法检测Alp、Opg、Opn和Col1a1的mRNA相对表达水平,与对照组相比,BCC组和G组的成骨相关基因表达均增加(图5G)。
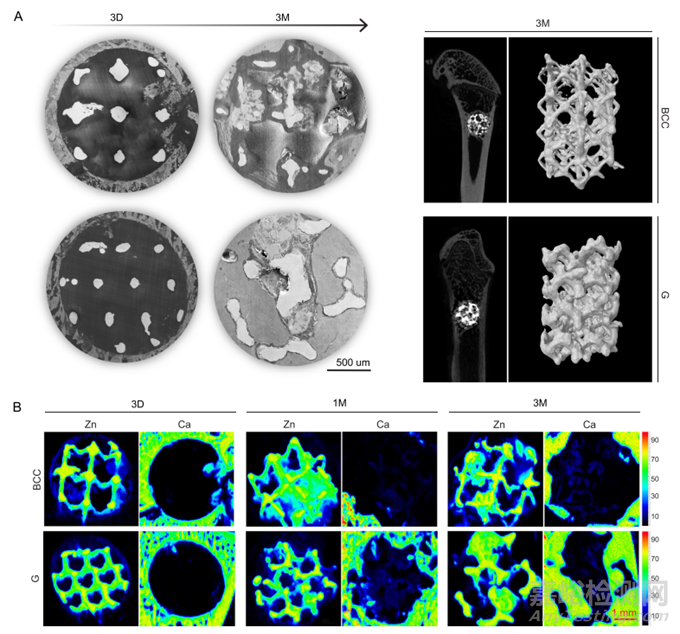
图6 具有BCC和G孔单元的Zn-Li多孔支架在大鼠股骨中的体内降解行为
采用X射线荧光成像光谱仪(XRF)、扫描电子显微镜(SEM)和显微CT等方法,对Zn-Li多孔支架随时间推移的2D和3D生物降解情况进行可视化。第3天,在骨缺损区清晰可见轮廓完整的支架支柱(图6A)。XRF检测到分布在孔隙区域和缺损区域边缘的Zn(蓝色)信号(图6B),表明支架的早期生物降解。在1个月时,BCC支架发生严重降解,部分孔隙完全充满降解产物;相比之下,G支架的降解更加均匀。因此,与BBC相比,具有G的Zn-Li支架在材料的生物降解和骨再生之间具有更好的匹配性。
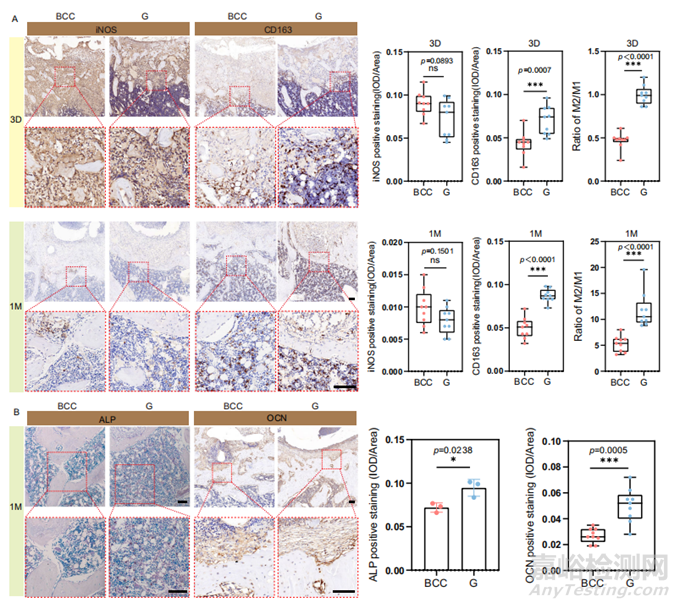
图7 Zn-Li多孔支架在大鼠股骨3天和1个月时的炎症反应和早期成骨

图8 3个月大鼠股骨中具有BCC和G单元的Zn-Li多孔支架的骨再生
损伤后3天,M1型巨噬细胞主要出现在BCC支架中,而G支架的M2/M1比值约为1:1(图7A)。在1个月时,G支架中的M2/M1比值是BBC支架的2倍以上。同时,G支架中早期成骨因子(ALP和OCN)的表达显著升高(图7B)。因此,在3个月时,G支架的骨再生明显优于BBC支架。此外,G支架的弯曲几何形状可以很好地指导Ⅰ型胶原蛋白的分泌。大量的胶原纤维沿着G支架的支柱良好地排列和定向,这在BCC支架中是不可见的(图8)。
小结
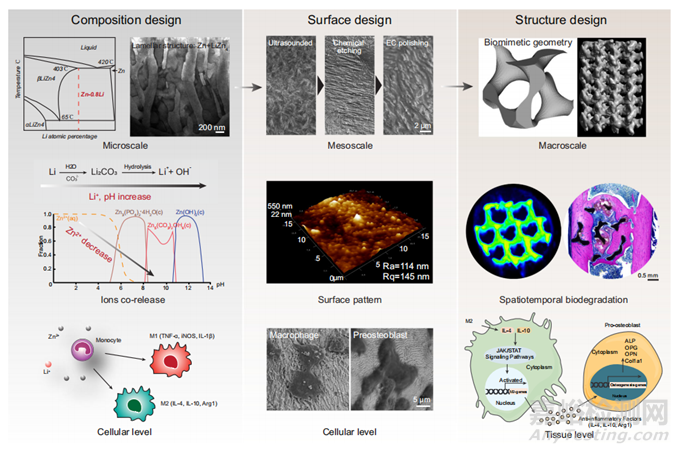
图9 用于免疫调节成骨的3D打印可生物降解Zn多孔支架的多尺度集成设计
总之,本研究通过应用于锌多孔支架的多尺度结构设计,解决了利用骨内膜调节来平衡快速降解和避免过度毒性的难题(图9)。在合金中加入0.8 wt.% Li,为支架打印提供坚实的机械基础。从Zn-0.8Li合金中同时释放Zn和Li离子显著增强巨噬细胞极化,有利于促再生表型。Zn-0.8Li合金交替排列的LiZn4和Zn相,层间间距为200-300nm的独特结构便于通过EC抛光创建纳米级波浪状微图案。这反过来可以在早期附着期间激活巨噬细胞,促进高扩散区域和丝状伪足的形成。G支架以其各向异性特征和最小的表面几何形状而著称,在体内、外都表现出适当的降解速率。因此,G支架在1个月内促进巨噬细胞向抗炎表型极化的效率提高,导致成骨标志物显著升高,胶原沉积增加,并在3个月时增强新骨形成。此外,G支架可能通过上调IL-4和IL-10的表达来激活巨噬细胞中的JAK/STAT通路,进而促进成骨。
文章来源:https://doi.org/10.1038/s41467-024-47189-5

来源:Internet


