当前,单克隆抗体是目前发展最快的新型治疗性生物大分子药物,随着国内生物医药的快速发展,越来越多的新型抗体药物(如双特异性抗体、抗体偶联药物(ADC)等)进入产业化阶段,本文梳理了新型抗体药物-ADC的生产现场检查关注点,新型抗体药物企业在员工培训或内部质量审计等工作中可参考使用。
一 新型抗体药物-ADC的生产工艺
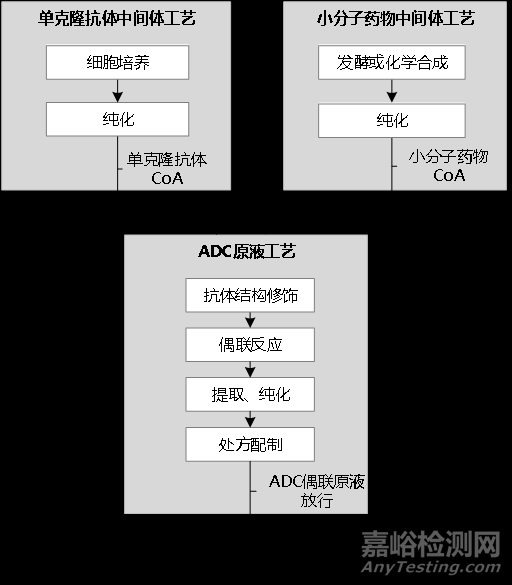
抗体偶联药物(Antibody–Drug Conjugates,简称ADC)是新药研发热点之一,被业界人士称为靶向杀伤肿瘤细胞的“生物导弹”,ADC是指由靶向特异性抗原的抗体药物与有效载荷(如小分子细胞毒药物)通过连接子偶联而成,兼具传统小分子细胞毒药物的强大杀伤效应和抗体药物的肿瘤靶向性,通俗地讲,ADC主要由三部分组成,分别是抗体(制导系统-靶向定位)+连接子(linker)+细胞毒素(也有效载荷(payload)、杀伤性弹药),ADC的优势是在抗体药物高特异性的基础上,增加了对肿瘤具有更强杀伤力的细胞毒性小分子药物,ADC药物生产流程参考示意图如下:
二 新型抗体药物检查策略
新型抗体药物属于生物大分子的特殊属性,在检查中除了应当关注新型抗体药物的工艺特性、过程控制、生产能力和质量属性,还需要重点关注抗体生物活性和原液生产过程中污染控制的工艺控制要求,现在监管机构现场检查一般采用两种策略,分别是基于体系的横向检查策略和基于品种的纵向检查策略。

三 新型抗体药物-ADC检查关注点
ADC药物的生产是一个技术密集型流程,大体可分为小分子药物生产工艺、原液的生产工艺及制剂的生产工艺3个环节,每个环节都拥有其关注点,基于对ADC药物当前的认识,梳理了ADC药物小分子药物生产工艺和制剂生产工艺检查关注的重点,原液生产工艺可参见单抗的通用检查要点,如有遗漏,欢迎大家补充。
1.小分子药物生产
生产工艺主要包括:连接子制备、小分子药物制备、连接子-小分子药物制备。
【检查要点示例】
应当尽可能使用专用设施(如独立的HVAC系统)和设备进行小分子药物分装;如共线生产,需采取特别防护措施并经过风险评估和必要的清洁验证,应充分评估小分子药物在环境及设备表面残留可能造成的风险。
应设立独立的洗衣间,用于小分子药物生产人员穿戴的防护服的清洗,如有必要,应进行预浸泡处理。
小分子药物中间品及产品等进行转运时应采用不易破碎的器具进行二次包装。
小分子药物和连接子-小分子药物生产区域及存储设备设施应受控。
对产品质量有影响的起始物料、试剂应建立质量控制标准,如果手性对ADC药物的活性有影响,对具有手性的起始物料应制定对映异构体或非对映异构体的限度。
当起始物料或中间体的某个杂质与产品的关键质量属性关联时,应验证生产工艺去除该杂质或其衍生物的能力并确定质量标准。
应制定中间体的质量控制标准,如性状、有关物质等;
应对制备过程中影响产品质量的工艺参数(例如:投料量、工艺温度、工艺时间、精制方法、干燥方式、干燥温度等)进行控制。
根据产品质量控制的需要,应检测外观性状、理化常数(如比旋度、溶解度等)、无机杂质、有机残留溶剂(如有必要)、有关物质、含量等(如必要)。
工艺中涉及柱层析和制备纯化等使用填料的步骤时,若填料循环使用,应关注填料寿命及清洁方法,并有相关验证研究。
如涉及中间体或产品混合(包括但不限于将小的批次混合以增加批量、将相同中间体或产品的尾料(例如分离出的相对较少的量)混合成一个批次),每一个将被用于混合的批次均须是按照注册批准的规程生产、检测并符合质量要求;应对混合过程进行监控和记录;混合批号的有效期或复验期应根据混合物中最早的尾料或批次的生产日期决定。
如果涉及物料和溶剂回收,应具备经过批准的溶剂回收规程,且回收的物料和溶剂应有质量标准;若回收溶剂与新溶剂混合使用,应有相关研究证明回收溶剂可适用于其可能被使用的所有生产步骤;对母液、回收溶剂和其他回收物料的使用应有记录。
2.ADC制剂生产
ADC制剂的生产工艺包括:半成品配制、过滤灌装、冻干(如有)、轧盖、灯检、贴签、包装等。
2.1【半成品配制工艺检查要点示例】
关注原液储存容器、原液化冻方式和化冻时间的控制方式(如冻融条件(温度、时长、震摇)、冻融次数等)。
关注原液/成品药液工艺时长、原液稀释时的搅拌温度/时间/速度、缓冲液配制参数(容器开口后吐温多次使用或者长时间存放,需要考虑氧化杂质影响、如产品对金属粒子、氧气和光照敏感,配液罐(金属离子)、罐体顶空氧/稀释剂/溶剂的溶氧、光照等。
关注除菌过滤前的微生物负荷控制水平、除菌过滤工艺的过滤设计,如滤器种类、过滤动力学参数(如最大过滤体积、压力或滤速、时长、温度)等工艺参数;
2.2【过滤灌装工艺检查要点示例】
关注灌装泵种类和速度(剪切力)、灌装温度/时长、喷嘴(直径、位置、数量)、充氮(起泡)、光/氧等工艺参数;
采用蠕动泵进行灌装的,应当重点关注灌装精度要求。
2.3【冻干工艺检查要点示例】
冻干步骤关注冻干曲线的批间一致性,如出现异常,相关的调查、评估对产品质量的影响及风险控制措施。
2.4【加塞/压盖工艺检查要点示例】
ADC制品轧盖结束后应对容器外壁进行清洗,以减少取样、灯检过程中人员操作暴露,清洗时应控制清洗水的温度。清洗后应确保容器在进入后段包装或暂存冷库前,已处于干燥的状态。
加塞/压盖除关注无菌保证相关参数(如轧盖力等)外,还应根据产品自身特性关注胶塞/活塞的硅油、玻璃的金属离子等对产品质量的影响;
生产过程应注意消毒剂残留(如双氧水等)对产品质量的影响(氧化物)。
2.5【轧盖、灯检、贴签、包装等工艺检查要点示例】
由于ADC品种多为低温储存,应当重点关注灯检、包装、贴签等步骤的脱冷链暴露及光照暴露和时间的控制要求。
当抗体偶联的小分子药物具有较强的疏水性时,应关注ADC药物在生产和贮藏期间多聚体的变化情况,检测方法应具有专属性和灵敏度。
如共线生产,经有数据的风险评估和采取有效的措施后方可实施。应充分评估ADC制品在环境及设备表面中残留可能造成的风险,并采取有效的措施进行残留去除,设备的清洁应经过清洁验证,确保制品暴露风险可接受。
采用人工灯检的,人员应经过实操培训且经考核合格后方可上岗,应定期进行再培训;
采用灯检机灯检的,灯检机应当经过验证。验证应包含人机对比且不得低于人工灯检效果。
应当建立不合格品样品库, 以便于后续追溯,并定期进行盘点,当生产过程中出现新种类的不合格品时应进行调查并评估是否更新至不合格品样品库。应定期对不合格品趋势进行分析,并对出现的异常趋势或偏差进行调查。
参考文献
《人用重组单克隆抗体制品生产通用技术要求》、《抗体类药品现场检查指南(征求意见稿)》、《探讨单抗注册生产现场检查中的质量控制要点》等。