今日头条
科越C5/FH1-5双抗上罕见病II期临床。科越医药创新C5/FH1-5双功能抗体融合蛋白KP104用于治疗陈发性睡眠性血红蛋白尿症(PNH)的II期临床首例患者给药。KP104能特异性地同时抑制补体旁路和末端途径,具有潜力可治疗单靶点疗法不足以治疗的补体介导的疾病。该新药目前正在多项Ⅱ期临床中评估用于治疗IgA肾病、C3肾小球病、继发于系统性红斑狼疮的血栓性微血管病和PNH的潜力。
国内药讯
1.三叶草新冠疫苗有效降低家庭传播。三叶草生物三聚体重组蛋白新冠疫苗SCB-2019(CpG 1018/铝佐剂)用于降低新冠病毒在家庭成员中的传播风险的全球II/III期临床最新数据发布在Clinical Infectious Diseases上。相较于未接种疫苗的受感染家庭成员的家庭,接种过SCB-2019受感染的家庭成员,其家庭接触者感染新冠的可能性降低了84%。三叶草计划年底前完成向NMPA、EMA和世卫WHO的注册申请递交。
2.歌礼FASN抑制剂完成痤疮II期临床入组。歌礼制药宣布已完成口服脂肪酸合成酶(FASN)抑制剂ASC40(denifanstat)治疗中重度痤疮的II期临床180例患者入组。该项试验主要研究指标包括治疗第12周总皮损计数相对基线的百分比变化和/或治疗第12周研究者总体静态评分(IGA)相对基线降低≥2分的受试者比例。截至目前,约50%已入组的患者已完成12周治疗,所有已入组患者预计将于2023年2月底完成12周治疗。
3.福贝CSF1R抑制剂获批渐冻人症临床。福贝生物1类新药FB-1071获国家药监局临床试验默示许可,拟开发用于治疗肌萎缩侧索硬化(ALS,俗称“渐冻人症”)。FB-1071是安立玺荣开发的一款新型CSF1R抑制剂,通过特异性地抑制CSF1R,调节中枢小胶质细胞和外周巨噬细胞,抑制神经炎症及其引起的神经损伤。福贝生物拥有FB-1071在中国大陆、香港、澳门地区针对肿瘤以外所有适应症的开发、生产和商业化独家权益。
4.百奥赛图与ADC Therapeutics签署合作协议。百奥赛图与ADC Therapeutics签署合作许可协议,百奥赛图将授予后者针对3个肿瘤靶点开发的单抗或双抗分子,合作开发和商业化ADC产品。根据协议,百奥赛图将获得首付款,并且针对每个许可分子,百奥赛图将获得选择权执行费、开发和商业化里程碑潜在付款,累计可达数千万美元;以及产品的销售分成。百奥赛图将保留这些抗体分子用于除ADC药物以外的所有全球权益。
5.博安生物申请港交所IPO。博安生物在港交所递交IPO申请并获得受理,瑞银、安信融资为其联席保荐人。博安生物成立于2013年,专业从事治疗用抗体开发、生产和商业化,专注于肿瘤、自身免疫、疼痛和内分泌疾病。目前,该公司已构建10多个拥有国际知识产权保护的创新抗体以及7个生物类似药的产品组合,其中生物类似药贝伐珠单抗(博优诺)和地舒单抗(普罗力)已获NMPA批准上市。
国际药讯
1.全球首款粪便微生物组疗法获FDA批准。FDA批准Ferring公司旗下公司Rebiotix开发的粪便来源微生物组疗法Rebyota(RBX2660)上市,用于避免艰难梭菌感染(CDI)患者在接受抗生素治疗后的感染复发。Rebyota通过单剂直肠给药,旨在帮助患者恢复肠道微生物群落,并避免CDI的再次感染。两项试验汇总分析显示,Rebyota预防CDI复发的有效率显著优于安慰剂(70.6%vs57.5%)。Rebyota也是全球首款微生物组疗法。
2.创新CXCR4拮抗剂Ⅲ期临床结果积极。X4 Pharmaceuticals公司CXCR4拮抗剂mavorixafor治疗WHIM综合征的Ⅲ期临床达到主要和关键次要终点。与安慰剂相比,mavorixafor组患者在24小时内维持中性粒细胞数大于500个细胞/微升的时间(TATANC值)显著改善(15.04小时vs2.75小时,P<0.0001);维持绝对淋巴细胞数大于淋巴细胞减少症(lymphopenia)临床阈值的时间(TATALC值)也更长(15.80小时vs4.55小时,P<0.0001)。预计明年上半年在美提交NDA申请。和誉医药拥有mavorixafor的大中华区权益。
3.礼来Aβ单抗III期临床积极。礼来Aβ单抗Donanemab治疗早期阿尔茨海默症(AD)III期研究TRAILblazer-ALZ 4达到所有主要和次要终点。6个月治疗数据显示,Donanemab和Aduhelm组达到淀粉样蛋白斑块完全清除的患者比例分别为37.9%和1.6%;两个治疗组淀粉样蛋白斑块水平分别比基线水平降低65.2%和17%;而且,Donanemab显著降低患者的血浆P-tau217蛋白(苏氨酸217磷酸化的tau蛋白)。药物的安全性与之前研究一致。
4.吉利德TIGIT抗体组合肺癌Ⅱ期临床积极。吉利德与Arcus Biosciences公司开发的TIGIT抗体domvanalimab在治疗非小细胞肺癌的Ⅱ期临床结果积极。与PD-1抗体zimberelimab相比,domvanalimab联合zimberelimab,以及domvanalimab、zimberelimab和腺苷A2a/b受体拮抗剂etrumadenant三联方案,在客观缓解率(ORR)、无进展生存期(PFS)和六个月无进展生存率方面均具统计学显著改善。两个包含domvanalimab的治疗方案总体耐受性良好。
5.再生元ANGPTL3单抗新适应症获优先审评。FDA受理再生元ANGPTI-3靶向疗法Evkeeza(evinacumab)的生物制剂补充许可申请(sBLA),作为其他降脂疗法的辅助药物,用于治疗5-11岁纯合子家族性高胆固醇血症(HoFH)儿童患者。FDA同时授予该sBLA申请优先审查资格。PDUFA日期为2023年3月30日。在Ⅲ期临床中,Evkeeza用于辅助治疗可使患儿的LDL-C平均降低了48%;有79%的患儿LDL-C至少降低一半。Evkeeza是首个ANGPTI-3靶向疗法,已获批用于辅助治疗12岁及以上HoFH患者。
6.Argenx预购一张FDA优先审评劵。Argenx SE宣布以1.02亿美元收购蓝鸟生物(bluebird bio)一张优先审评券(PRV),用于加速其潜在FIC的FcRn阻断剂efgarigimod的上市审批。11月22日,FDA刚受理argenx公司优先审查其皮下制剂efgartigimod 用于治疗全身性重症肌无力 (gMG) 的生物制品许可申请,PDUFA日期为2023年3月20日。在III期ADAPT-SC研究中,efgartigimod组患者第29天的平均总IgG较基线减少66.4%(vs62.2%),疗效与VYVGART相比达到非劣效性。
7.BioNTech与Ryvu公司达成4000万欧元合作。BioNTech与Ryvu公司达成全球合作协议,BioNTech将获得后者STING激动剂全球独家开发与商业化权利。此外,针对BioNTech所选择的靶点,两家公司将联合开发多个小分子候选药物,应用于癌症免疫调节领域;BioNTech将拥有合作候选项目的全球开发与商业化选择权。根据协议,Ryvu将获得2000万欧元的预付款,和2000万欧元的投资款项。
医药热点
1.广州支持有条件的密接者居家隔离。11月30日,广州召开疫情防控新闻发布会。广州市卫健委副主任、新闻发言人张屹表示,为全面、准确、完整贯彻落实国务院联防联控机制《第九版防控方案》和进一步优化疫情防控“二十条”措施要求,各区正在进一步优化5个相关管控措施。其中针对“做好密切接触者的隔离管理”明确,密切接触者原则上落实集中隔离观察,符合居家隔离条件的密切接触者实施居家隔离。
2.第一版药品网络销售禁止清单发布。国家药监局在官网发布《药品网络销售禁止清单(第一版)》,自2022年12月1日起施行。该《清单》包含两大类药品,其一是政策法规明确禁止销售的药品,包括:疫苗、血液制品、麻醉药品、精神药品、医疗用毒性药品、放射性药品、药品类易制毒化学品;医疗机构制剂、中药配方颗粒。其二是其他禁止通过网络零售的药品。此外,9月1日公布的《药品网络销售监督管理办法》也于12月1日起施行。
3.郑川任成都中医药大学副校长。11月28日,四川省人民政府网站公布一批干部任免通知。其中,四川省人民政府决定任命郑川为成都中医药大学副校长(试用期一年)。根据公开信息, 郑川,男,汉族,1981年1月生,四川自贡人,2002年6月加入中国共产党,2003年7月参加工作,四川师范大学化学学院化学专业毕业,理学学士,成都中医药大学基础医学院中西医结合基础专业,研究生学历,医学博士。
评审动态
1. CDE新药受理情况(11月23日)
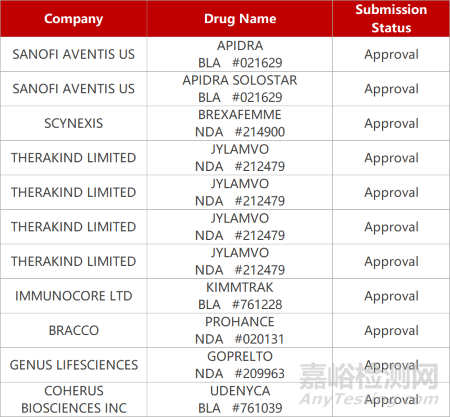
2. FDA新药获批情况(北美11月30日)