您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-07-18 11:48
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
真实生物阿兹夫定治疗新冠报产。真实生物宣布双靶点艾滋病新药阿兹夫定片用于新冠肺炎适应症的注册III期临床达到预期,已正式向国家药监局提交其新增抗新冠病毒的上市申请。阿兹夫定是新型核苷类逆转录酶和辅助蛋白Vif抑制剂,于去年7月获批在国内上市,与核苷逆转录酶抑制剂及非核苷逆转录酶抑制剂联用,治疗高病毒载量的成年HIV-1感染患者,该产品的售价为25.86元/mg(片)。
国内药讯
1.海思科环泊酚获批新适应症。海思科自主研发的静脉麻醉1类创新药环泊酚注射液获NMPA批准第五项适应症,用于重症监护(ICU)期间的镇静。此前该新药已获批用于消化道内镜检查中的镇静;全身麻醉诱导;支气管镜检查中的镇静;以及全身麻醉诱导和维持。据悉,NMPA近期还将“消化道内镜检查中的镇静”和“支气管镜检查中的镇静”适应症进行合并,将说明书适应症扩大修订为“非气管插管手术/操作中的镇静和麻醉”。
2.基石普拉替尼在香港获批上市。基石药业引进的RET抑制剂新药pralsetinib(GAVRETO)在中国香港获批上市,用于一线治疗RET基因融合阳性的转移性非小细胞肺癌(NSCLC)。在一项国际I/II期ARROW临床中,pralsetinib在经治患者中确认的ORR为66.7%, DCR为93.9%;在初治患者中,确认的ORR为80%, DCR为86.7%;而且该新药在中国患者中未发现新的安全信号。普拉替尼已于2021年3月获NMPA批准上市,是中国首个获批的RET抑制剂。
3.BMS口服TYK2抑制剂在华报产。百时美施贵宝(BMS)开发的1类新药氘可来昔替尼片(deucravacitinib)的上市申请获CDE受理,推测适应症为中重度斑块状银屑病。deucravacitinib是BMS自主研发的TYK2变构抑制剂,其用于成人中重度斑块型银屑病的上市申请正在接受FDA的监管审查,PDUFA日期为2022年9月10日。如果获批,氘可来昔替尼将成为首个获批上市的TYK2抑制剂。
4.优卡迪CAR-T获FDA孤儿药资格。上海优卡迪生物自主研发的ssCART-19细胞注射液获FDA授予孤儿药资格,用于治疗急性B淋巴细胞白血病(B-ALL)。这是一款具有沉默白介素6表达功能的靶向CD19基因工程化自体T细胞注射液,通过显著降低回输后外周血IL-6因子的释放水平,进一步降低细胞因子的级联效应,较同靶点药物具有更低的严重细胞因子释放综合征 (CRS) 和严重免疫效应细胞相关神经毒性综合症(ICANS)的发生率。目前,该产品已获CDE临床许可,拟用于治疗中枢神经系统白血病。
5.宜明昂科CD47/HER2双抗获FDA快速通道资格。宜明昂科CD47/HER2双特异性分子IMM2902获FDA授予快速通道资格,针对的适应症为乳腺癌。IMM2902可通过HER2的高亲和活性与肿瘤细胞结合,同时保留了不与人红细胞结合及避免了“Antigenic sink”等特点,加强了双靶点肿瘤特异性协同效应。该产品目前也正在中国晚期HER2阳性及HER2低表达实体瘤(包括乳腺癌、胃癌、非小细胞肺癌及胆管癌)患者中开展Ⅰa/Ⅰb期临床试验。
国际药讯
1.度普利尤单抗儿科Ⅲ期临床积极。再生元与赛诺菲联合开发的IL-4/IL-13抑制剂度普利尤单抗(Dupixent)在用于治疗嗜酸性食管炎(EoE)患儿(1-11岁)的Ⅲ期临床达到主要终点。与安慰剂组相比,Dupixent治疗组患者第16周时达到组织学疾病缓解的患者比例更高(68%和58%,vs3%,p<0.0001)。高剂量Dupixent组患儿的食管上皮细胞间嗜酸细胞数峰值较基线下降86%,安慰剂组这一数值上升了21%(p<0.0001)。
2.基因泰克眼科双抗长期疗效积极。基因泰克VEGF-A/Ang-2双抗Vabysmo(faricimab)公布治疗湿性年龄相关性黄斑变性(AMD)的Ⅲ期临床(TENAYA和LUCERNE)两年治疗数据。在达到与以每2个月接受活性对照治疗患者相似视力改善的前提下,有超过60%的Vabysmo组患者可以每隔4个月的间隔接受治疗,与第一年进行主要分析时相比,有15%的增加。Vabysmo组患者两年内的中位治疗次数为10次(vs15次),显示Vabysmo有潜力降低注射次数。此外,临床中没有新的安全性问题。
3.罗氏帕妥珠单抗乳腺癌长期疗效积极。罗氏HER2单抗帕捷特(帕妥珠单抗,Perjeta)联合赫赛汀(曲妥珠单抗,Herceptin)和化疗组合用于HER2阳性早期乳腺癌术后治疗的Ⅲ期临床APHINITY最新数据积极。中位随访为8.4年时,与赫赛汀联合化疗对照组相比,帕捷特联合赫赛汀和化疗组合可降低患者复发或死亡风险(iDFS,HR=0.77,95% CI:0.66-0.91);两组的死亡率分别为7%和8.4%。在手术前肿瘤已扩散到淋巴结的患者中,帕捷特治疗方案可降低28%的复发或死亡风险(HR=0.72; 95% CI:0.60-0.87)。此外,研究期间没有新的安全性问题。
4.乳腺癌疫苗GLSI-100将重启III期临床。FDA解除Greenwich LifeSciences公司乳腺癌疫苗GLSI-100(GP2+GM-CSF)的III期临床试验暂停。该项试验旨在评估GLSI-100用于既往接受曲妥珠单抗新辅助和术后辅助治疗的HER2/neu和HLA-A*02阳性乳腺癌患者接种的疗效和安全性。一项IIb期临床最新数据显示,在术后接受曲妥珠单抗标准疗程的HER2+患者完成GLSI-100初级免疫(PIS)后,5年随访期间乳腺癌复发率降至0%。
5.创新AD疗法临床前概念验证积极。Hoth Therapeutics公司拟用于治疗阿尔茨海默病(AD)的创新口服疗法HT-ALZ在临床前研究中获积极结果。此前HT-ALZ已在AD小鼠模型中初步显示出可显著降低它们脑间质液中Aβ浓度。此次经认知和行为学评估,长期口服HT-ALZ后AD小鼠的行为和认知功能得到显著改善,该治疗组的认知和行为趋势与野生型小鼠(非AD)相似。这些结果支持HT-ALZ作为AD治疗药物提供认知改善疗效的潜力。
6.Royalty购进COPD/哮喘三联吸入剂。Royalty公司宣布将以13.1亿美元现金首付及最高可达3亿美元的里程金从Theravance Biopharma/Innoviva手中购买三联吸入制剂Trelegy Ellipta(全再乐,氟替美维吸入粉雾剂)的特许权。Trelegy Ellipta由葛兰素史克销售,每日1次,用于慢性阻塞性肺病(COPD)患者的维持治疗和18岁及以上患者的哮喘维持治疗。2021年,Trelegy的销售额为16.8亿美元,较上年增长57%。
医药热点
1.中国拟加快推动药师法立法进程。国家卫健委就十三届全国人大五次会议第7850号《关于加速药师法立法进程的建议》在官网做出回复。早在2013年,国务院已将《药师法》列为立法计划的研究项目之一,已形成三稿《药师法(草案征求意见稿)》;自2020年以来,最大程度上采纳各方反馈意见,达成一致共识,形成《药师法(送审稿)》。国家卫健委表示,将协同有关部门,认真研究听取各方意见,抓紧修改完善法律草案,加快推动药师法立法进程,条件成熟时提请全国人大常委会审议,推动药师法尽快出台。
2.华大智造宣布获Illumina赔偿近22亿元。7月15日,华大智造(MGI)及其关联公司宣布,与Illumina就美国境内的所有未决诉讼达成和解。根据协议,双方将不再对加州北部地区法院和特拉华州地区法院的诉讼判决结果提出异议。基于此,Illumina将向华大智造子公司CG支付3.25亿美元(约合人民币22亿元)的净赔偿费。此外,华大智造将撤销在加州北部地区法院对Illumina的反垄断诉讼。Illumina将获得华大智造及其子公司CG的“双色测序技术”系列专利授权。华大智造将于今年8月开始在美国销售其基于CoolMPS技术的相关测序产品,并于2023年1月开始销售StandardMPS相关测序产品。
3.基石药业或将寻找收购方。据Bloomberg新闻网报道,基石药业正在考虑出售股权或寻求收购等战略选择。据知情人士透露,基石药业正在与高盛集团展开合作,初步考虑出售公司股权或寻找潜在买家进行收购。根据基石年报,2021年总收入达2.437亿人民币,年内亏损19.201亿人民币;2020年总收入10.388亿,年内亏损12.210亿。相较于2020年,2021年总收入下滑了7.95亿,从年报显示,2021年的销售开支和融资成本相较2020年均有所升高。
评审动态
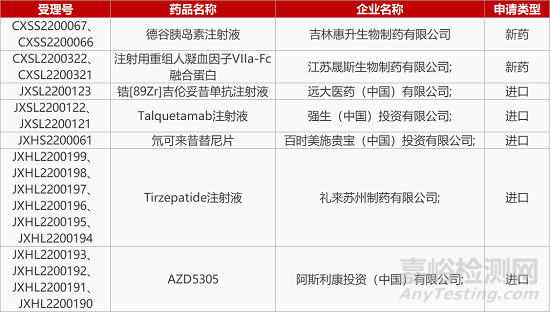
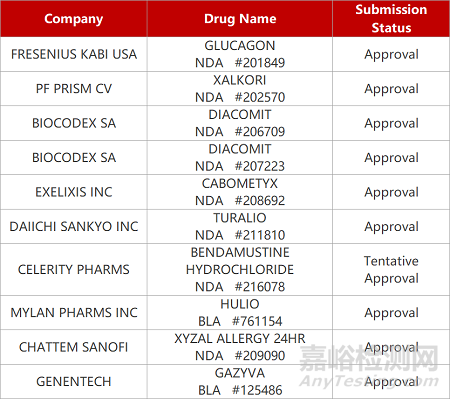

来源:药研发


