您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-05-31 10:58
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
上海应世FAK抑制剂Ib期临床积极。应世生物将在ASCO2022年会上公布FAK抑制剂IN10018联合脂质体多柔比星治疗铂耐药复发卵巢癌的Ib期临床研究数据。在30例可评估患者中,这一组合达到客观缓解率为56.7%(95% CI:37.4%,74.5%);疾病控制率为86.7%(95% CI:69.3%,96.2%)。而且联合治疗安全性和耐受性良好,未观察到毒性的明显叠加。预计该组合将于下半年启动确证性临床试验。
国内药讯
1.GSK双价HPV疫苗获批两剂次接种。NMPA批准葛兰素史克(GSK)HPV疫苗希瑞适(双价人乳头瘤病毒吸附疫苗[HPV16/18型])两剂次接种程序,年龄在9-14岁的女孩可选择在第0、6月分别接种1剂次疫苗完成免疫程序。与15-25岁女性的三剂次接种程序相比,9-14岁女孩接种两剂次所诱导的HPV16和18型抗体水平相似。希瑞适两剂次接种程序获批,简化了原来的接种程序,降低三分之一的接种费用。
2.国药中生四价流感疫苗获批签发。国药集团中国生物上海生物制品研究所生产的首批四价流感病毒裂解疫苗获得NMPA批签发证明并获批签上市。这款四价流感病毒裂解疫苗采用世界卫生组织推荐的2022-2023年流感流行季的流感毒株研制,包含2株甲型病毒及2株乙型病毒。该品种的上市,将为我国流感的预防和控制发挥积极作用。
3.复必泰中国人群Ⅱ期临床见刊柳叶刀。复星医药引进的mRNA新冠疫苗复必泰(BNT162b2)在中国境内的Ⅱ期临床研究成果刊发在《柳叶刀》预印本平台。在健康或患有稳定的基础疾病的中国成年人中,间隔21天接种2剂复必泰可诱导强烈的免疫应答,并且安全性良好。BNT162b2由德国BioNTech研发,复星医药拥有在中国大陆及港澳台地区独家开发及商业化授权。2021年财报显示,复星复必泰在港澳台的销售量达到2206万剂,实现销售规模超10亿元。
4.沃森/蓝鹊新冠mRNA疫苗将启动临床。沃森生物在Clinicaltrials.gov网站上登记启动新冠mRNA嵌合疫苗RQ3013的Ⅰ期临床。该项临床计划入组120例健康志愿者,预计8月完成。RQ3013是蓝鹊生物研发的一款基于阿尔法/贝塔突变株S蛋白嵌合体设计的双价mRNA疫苗,该疫苗在动物试验中对多种变异株均能产生高效价中和抗体,是一种广谱的新冠变异株mRNA疫苗。
5.药捷安康AXL/FLT3抑制剂国内报IND。药捷安康1类化药TT-00973-MS片的临床试验申请获CDE受理。TT-00973是一款新型AXL/FLT3双重抑制剂,可通过抑制AXL信号通路,来治疗复发及难治性血液系统恶性肿瘤;以及抑制FLT3突变,有望克服既往第一、第二代FLT3-ITD抑制剂治疗的急性髓系白血病(AML)患者的获得性耐药性。今年3月,FDA已批准该新药在美国开展针对AML和骨髓增生异常综合征的Ⅰ期临床。
6.睿跃中美双报PROTAC新药报IND。睿跃生物1类新药CG001419片的临床试验申请获CDE受理。CG001419是一款TRK蛋白降解剂(神经营养因子受体酪氨酸激酶),拟用于治疗癌症和其他疾病。去年2月,该公司宣布完成5000万美元B轮融资,用于推动多个肿瘤靶向蛋白质降解剂和新型E3配体管线的开发,并计划在中美同步提交CG001419的临床试验申请(IND)。国内药企康朴生物和珃诺生物的同类药物进展最快,已处于Ⅰ/Ⅱ期临床阶段。
国际药讯
1.诺华CD19-CAR-T获批第三项适应症。诺华靶向CD19的CAR-T疗法Kymriah获FDA加速批准扩展适应症,用于治疗接受过两种以上全身性治疗的复发/难治性滤泡性淋巴瘤患者。在一项Ⅱ期临床ELARA中,中位随访约为17个月时,86%的患者获得缓解,68%的患者获得完全缓解。Kymriah(tisagenlecleucel)是首款获得FDA批准的CAR-T,已获批用于治疗复发/难治性急性淋巴细胞白血病和弥漫性大B细胞淋巴瘤。
2.罗氏CD20/CD3双抗最新临床数据积极。罗氏将在ASCO2022年会上公布其CD20/CD3双抗glofitamab治疗侵袭性淋巴瘤的关键II期NP30179扩展研究数据。中位随访12.6个月后,glofitamab的完全缓解(CR)率达到39.4%(n=61/155),总体缓解率为51.6%(n=80/155);而且CR患者中有77.6%患者维持缓解超过12个月。细胞因子释放综合征发生率为63.0%。详细数据已提交给欧洲药品管理局审批,并计划在今年提交给FDA等药监部门。
3.HER2双抗早期临床数据积极。Zymeworks公司HER2靶向双抗zanidatamab在ASCO2022年会上公布与多西他赛联用一线治疗晚期HER2阳性乳腺癌的Ⅰ/Ⅱ期临床积极结果。该研究达到90.5%的确认客观缓解率(cORR)。在中位随访为7.0个月时,6个月无进展生存率为95.2%。在联合PD-1抗体tislelizumab和化疗治疗HER2阳性胃癌/胃食道结合部腺癌的临床试验中,组合疗法达到75.8%的cORR。疾病控制率为100%。百济神州拥有zanidatamab在亚洲(日本除外)、澳大利亚和新西兰的独家授权。
4.即用型CAR γδ-T细胞疗法早期临床积极。Adicet Bio公司即用型CD20靶向CAR γδ-T细胞疗法ADI-001在ASCO2022年会上公布用于治疗复发/难治性B细胞非霍奇金淋巴瘤的Ⅰ期临床积极数据。在接受治疗28天时,ADI-001在既往治疗中位数为5线的患者中达到67%的完全缓解率(4/6)。其中2例患者完全缓解维持时间超过3个月,包括1例接受过CD19靶向自体CAR-T疗法治疗的患者。
5.Terremoto公司融资开发突破性共价药物。Terremoto公司完成7500万美元的A轮融资,以推进其靶向赖氨酸(Lys)的共价平台,开发潜在“best-in-class”小分子药物,以及针对此前不可成药靶点的潜在“first-in-class”药物。Terremoto技术平台旨在扩展共价药物可以结合的氨基酸种类,开发靶向结合赖氨酸的共价药物。该公司利用的技术包括基于结构的药物设计、亲电弹头文库开发、计算机发现引擎、冷冻电镜和X光晶体学等等。
医药热点
1.WHO将猴痘的全球公卫风险评估为中等。世卫组织29日宣布,5月13日至26日期间,已有23个非猴痘流行国家和地区上报了257例猴痘确诊病例,和约120例疑似病例。世卫组织预计,随着监测范围的扩大,还将发现更多猴痘病例。病毒可能已传播数周或更长时间而未被发现,且存在广泛的人际传播。世卫组织将猴痘的全球公共卫生风险评估为中等。
2.上海进入公共场所和搭乘公交须72小时核酸阴性证明。在5月29日召开的上海市新冠肺炎疫情防控新闻发布会上,上海市政府新闻发言人尹欣通报上海市新冠疫情防控工作领导小组办公室发布的《关于调整和优化核酸检测时间要求的通知》。自6月1日零时起,进入有明确防疫要求的公共场所和搭乘公共交通工具的人员,须持72小时内核酸检测阴性证明。
3.我国将逐步解决HPV疫苗供应不足等问题。近日,国家卫健委召开新闻发布会介绍我国HPV疫苗接种情况。HPV疫苗接种数量从2018年的341.7万剂次上升至2020年的1227.9万剂次;但总体HPV疫苗处于供不应求状态,我国适龄女性HPV疫苗接种率处于较低水平。下一步,国家将促进免费HPV疫苗接种政策覆盖更多人群,并加大多部门协作力度,逐步解决HPV疫苗供应不足等问题。
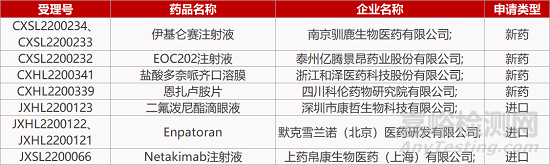
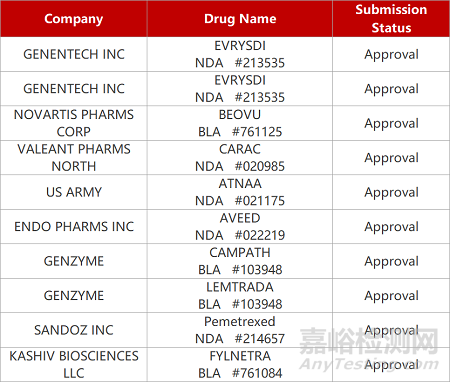
评审动态

来源:药研发


