您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-05-17 05:55
一、概述
药包材即直接与药品接触的包装材料和容器,系指药品生产企业生产的药品和医疗机构配制的制剂所使用的直接与药品接触的包装材料和容器。药包材按材质可分为塑料类(如药用低密度聚乙烯滴眼剂瓶、口服固体药用高密度聚乙烯瓶)、金属类(如药用铝箔、铁制的清凉油盒)、玻璃类(如低硼硅玻璃安瓶、中硼硅管制注射剂瓶)、陶瓷类、橡胶类(如注射液用氯化丁基橡胶塞、口服液体药用硅橡胶垫片)和其他类(如纸、干燥剂)等,也可以由两种或两种以上的材料复合或组合而成(如复合膜、铝塑组合盖等)。药包材应具有良好的安全性、适应性、稳定性、功能性、保护性和便利性,在药品的包装、贮藏、运输和使用过程中起到保护药品质量、安全、有效、实现给药目的作用。
二、注册管理法律法规
国家药品监督管理部门对药包材的管理已历时二十年,按发布时间汇总的相关法律法规见下表。
|
发布时间 |
名称 |
|
2000.04.29 |
药品包装用材料、容器管理办法(暂行)(局令第21号) |
|
2001.02.28 |
《中华人民共和国药品管理法》(主席令第45号)第六章药品包装的管理 |
|
2002.08.15 |
《中华人民共和国药品管理法实施条例》(国务院令第360号)第六章药品包装的管理 |
|
2004.07.20 |
《直接接触药品的包装材料和容器管理办法》(局令第13号) |
|
2015.04.24 |
《中华人民共和国药品管理法》第六章药品包装的管理 |
|
2016.05.12 |
总局办公厅公开征求关于药包材药用辅料与药品关联审评审批有关事项的公告(征求意见稿)意见 |
|
2016.06.01 |
《中华人民共和国药品管理法实施条例》第六章药品包装的管理 |
|
2016.08.09 |
关于药包材药用辅料与药品关联审评审批有关事项的公告(2016年第134号) |
|
2016.11.23 |
总局关于发布药包材药用辅料申报资料要求(试行)的通告(2016年第155号) |
|
2017.11.23 |
关于调整原料药、药用辅料和药包材审评审批事项的公告(2017年146号) |
|
2018.06.05 |
关于公开征求《药用辅料登记资料要求(征求意见稿)》和《药包材登记资料要求(征求意见稿)》意见的通知 |
|
2019.07.15 |
国家药监局关于进一步完善药品关联审评审批和监管工作有关事宜的公告(2019年第56号) |
|
2020.03.30 |
《药品注册管理办法》第三节关联审评审批 |
|
2020.04.30 |
关于公开征求《化学原料药、药用辅料及药包材与药品制剂关联审评审批管理规定(征求意见稿)》意见的通知 |
三、新旧管理办法中药包材产品分类对比
|
|
|
|
药品包装用材料、容器管理办法 (暂行)(局令第21号) |
《直接接触药品的包装材料和容器管理办法》(局令第13号) |
|
药包材产品分为Ⅰ、Ⅱ、Ⅲ三类。 Ⅰ类药包材指直接接触药品且直接使用的药品包装用材料、容器。 Ⅱ类药包材指直接接触药品,但便于清洗,在实际使用过程中,经清洗后需要并可以消毒灭菌的药品包装用材料、容器。 Ⅲ类药包材指Ⅰ、Ⅱ类以外其它可能直接影响药品质量的药品包装用材料、容器。 |
实施注册管理的药包材产品目录 |
|
1、实施Ⅰ类管理的药包材产品: (1)药用丁基橡胶瓶塞; (2)药品包装用PTP铝箔; (3)药用PVC硬片; (4)药用塑料复合硬片、复合膜(袋); (5)塑料输液瓶(袋); (6)固体、液体药用塑料瓶; (7)塑料滴眼剂瓶; (8)软膏管; (9)气雾剂喷雾阀门; (10)抗生素瓶铝塑组合盖; (11)其它接触药品直接使用药包材产品。 |
一、输液瓶(袋、膜及配件); 二、安瓿; 三、药用(注射剂、口服或者外用剂型)瓶(管、盖); 四、药用胶塞; 五、药用预灌封注射器; 六、药用滴眼(鼻、耳)剂瓶(管); 七、药用硬片(膜); 八、药用铝箔; 九、药用软膏管(盒); 十、药用喷(气)雾剂泵(阀门、罐、筒); 十一、药用干燥剂。 |
|
2、实施Ⅱ类管理的药包材产品: (1)药用玻璃管; (2)玻璃输液瓶; (3)玻璃模制抗生素瓶; (4)玻璃管制抗生素瓶; (5)玻璃模制口服液瓶; (6)玻璃管制口服液瓶; (7)玻璃(黄料、白料)药瓶; (8)安瓿; (9)玻璃滴眼剂瓶; (10)输液瓶天然胶塞; (11)抗生素瓶天然胶塞; (12)气雾剂罐; (13)瓶盖橡胶垫片(垫圈); (14)输液瓶涤纶膜; (15)陶瓷药瓶; (16)中药丸塑料球壳; (17)其它接触药品便于清洗、消毒灭菌的药包材产品。 |
|
|
3、实施Ⅲ类管理的药包材产品: (1)抗生素瓶铝(合金铝)盖; (2)输液瓶铝(合金铝)、铝塑组合盖; (3)口服液瓶铝(合金铝)、铝塑组合盖; (4)除实施Ⅱ、Ⅲ类管理以外其它可能直接影响药品质量的药包材产品。 |
|
四、药包材注册审评审批流程
药包材注册申请包括生产申请、进口申请和补充申请。生产申请,是指在中国境内生产药包材的注册申请。进口申请,是指在境外生产的药包材在中国境内上市销售的注册申请。补充申请,是指生产申请和进口申请经批准后,改变、增加或者取消原批准事项或者内容的注册申请。
1、生产申请与注册流程
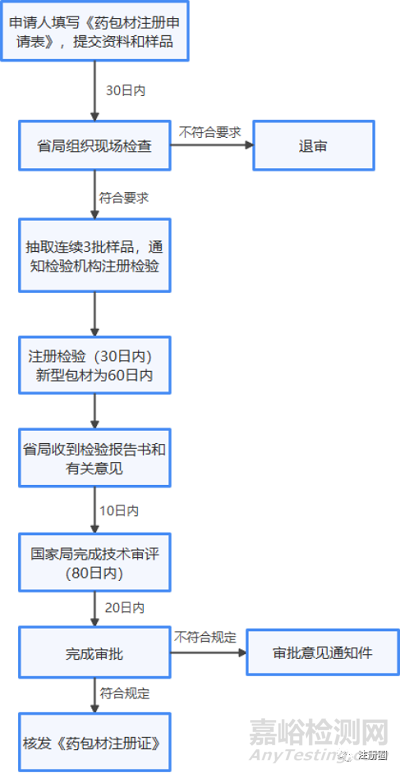
2、进口申请与注册流程
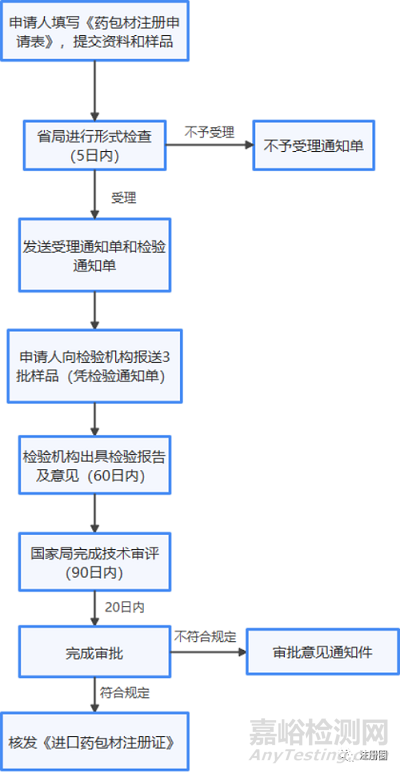
3、再注册
国家食品药品监督管理局核发的《药包材注册证》或者《进口药包材注册证》的有效期为5年。有效期届满需要继续生产或者进口的,申请人应当在有效期届满前6个月申请再注册。
注册流程与原申报程序一致。
五、关联审评
1、实行关联审评审批的药包材
2016年8月10日总局关于药包材药用辅料与药品关联审评审批有关事项的公告(2016年第134号)附件1中明确了实行关联审评审批药包材的范围。
|
风险等级 |
制剂类别 |
剂型 |
包装系统 |
包装组件 |
|
高 |
经口鼻吸入制剂 |
气雾剂、喷雾剂、粉雾剂 |
吸入制剂密闭系统 |
罐(筒)、阀门 |
|
较高 |
注射制剂 |
小容量注射剂 |
预灌封注射剂密闭系统 |
针筒(塑料、玻璃)、注射钢针(或者鲁尔锥头)、活塞 |
|
笔式注射器密闭系统 |
卡式玻璃瓶+玻璃珠、活塞、垫片+铝盖 |
|||
|
抗生素玻璃瓶密闭系统 |
玻璃瓶、胶塞、铝盖(或者铝塑组合盖) |
|||
|
玻璃安瓿、塑料安瓿 |
|
|||
|
大容量注射剂 |
玻璃瓶密闭系统 |
玻璃瓶、胶塞、铝盖(铝塑组合盖) |
||
|
软袋密闭系统 |
多层共挤输液袋、塑料组合盖 |
|||
|
塑料瓶密闭系统 |
塑料瓶、塑料组合盖 |
|||
|
冲洗液、腹膜透析液、肠内营养液等 |
软袋密闭系统 |
输液袋、塑料组合盖或者其他输注配件 |
||
|
较高 |
眼用制剂 |
眼用液体制剂 |
塑料瓶密闭系统 |
|
|
其他眼用制剂,如眼膏剂等 |
眼膏剂管系统 |
软膏管、盖、垫片 |
||
|
中 |
透皮制剂 |
贴剂 |
透皮制剂包装系统 |
基材、格拉辛纸+复合膜袋 |
|
中 |
口服制剂 |
口服液体制剂 |
塑料瓶系统、 玻璃瓶系统 |
瓶身、瓶盖、垫片 |
|
中 |
外用制剂 |
气雾剂、喷雾剂、粉雾剂 |
外用制剂密闭系统 |
罐(筒)、阀门 |
|
软膏剂、糊剂、乳膏剂、凝胶剂、洗剂、乳剂、溶液剂、搽剂、涂剂、涂膜剂、酊剂 |
外用制剂包装系统 |
|
||
|
低 |
口服制剂 |
口服固体制剂 |
塑料瓶系统、玻璃瓶系统 |
|
|
泡罩包装系统 |
泡罩材料、易穿刺膜 |
|||
|
低 |
药用干燥剂 |
|
||
|
-- |
其他 |
|
||
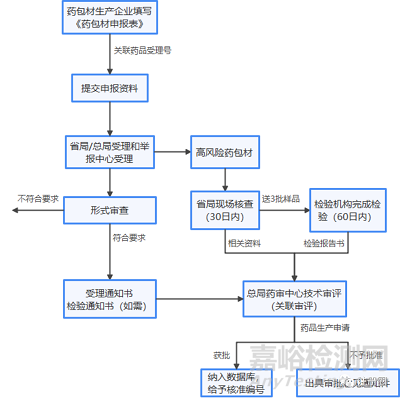
2、审批流程
在新的政策要求下,药品注册申请人在提交药品注册申请时须一并提交药包材研究资料,并在申报阶段关联受理编号,相关部门在进行技术评审时将药品与药包材进行“关联”。

来源:注册圈


