您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-02-18 11:03
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
中国抗体制药FIC单抗报IND。中国抗体制药有限公司自主研发的潜在“first-in-class”注射用人源化抗IL-17RB单克隆抗体(SM17)的临床试验申请已获FDA受理,拟用于治疗哮喘患者。SM17可抑制由一类被称为“警戒素”的细胞因子导致的Th2细胞相关免疫反应,进而治疗过敏性疾病以及气道细胞的病毒感染反应,有望成为治疗哮喘的新疗法。
国内药讯
1.东阳光「利托那韦片」报产。广东东阳光药业利托那韦片日前已通过BE试验,并向国家药监局提交了注册申请。低剂量利托那韦口服片剂(100 mg)是多种抗病毒蛋白酶抑制剂的药代动力学增强剂,是口服抗新冠药Paxlovid(Nirmatrelvir+利托那韦)的组成之一。目前,该公司旗下乳源东阳光药业的利托那韦原料药也已在国内获批。据悉,全球口服新冠药物市场规模为数十亿至上百亿美元。
2.嘉和「英夫利西单抗」即将获批。玉溪嘉和生物开发的英夫利西单抗生物类似药的上市申请审评状态变更为“在审批”,预计即将获批上市,有望成为国产第3款英夫利西单抗生物类似药。英夫利西单抗是强生/默沙东研发的一款特异性阻断肿瘤坏死因子(TNF-α)的人鼠嵌合型单抗,主要适用于类风湿性关节炎等自身免疫性疾病。原研产品已于2006年在国内获批上市,商品名为类克®。
3.丽珠新冠疫苗III期临床积极。丽珠医药重组新冠融合蛋白疫苗(V-01)在巴基斯坦和马来西亚开展序贯加强的III期临床中期结果积极。与两针灭活疫苗对比,V-01序贯加强后绝对保护力达到61.35%,符合WHO标准;两组COVID-19发病率分别为6.73%和12.80%(P=0.0012)。此外,有效送检标本中60个的病毒基因分型一代测序均为Omicron(其余仍在进行二代测序),显示V-01序贯加强对于Omicron毒株可产生良好的保护力。临床中,未发现有值得关注的安全性问题。
4.信达PCSK-9单抗两项III期临床成功。信达生物PCSK-9单抗IBI306的两项中国关键III期临床(CREDIT-1和CREDIT-4)均达到主要终点。在非家族性高胆固醇血症(non-FH)合并高危/极高危心血管风险患者中,与安慰剂相比,IBI306治疗组48周后患者LDL-C较基线下降具统计学显著改善。在non-FH和杂合子型家族性高胆固醇血症[HeFH]患者中,IBI306治疗12周后LDL-C较基线下降也具统计学意义。IBI306总体安全性良好。信达计划启动IBI306的上市申报工作,并在学术会议上公布两项临床成果。
5.泽璟KRAS G12C抑制剂国内启动临床。泽璟生物KRAS G12C选择性共价抑制剂ZG1901登记启动一项Ⅰ/Ⅱ期临床,评估治疗至少经一线标准治疗失败的携带KRAS G12C突变或无标准治疗的晚期实体瘤患者的安全性和耐受性。该试验计划在中国境内招募110例患者。临床前研究显示,ZG19018具有显著的抑制KRAS G12C突变肿瘤生长和细胞增殖的药效作用;且在肿瘤和脑组织中具有高药物浓度。ZG19018在美国也获得临床许可。
6.传奇生物CD4 CAR-T临床暂停。传奇生物宣布,因患者外周血中CD4+T细胞计数较低,FDA暂时停止LB1901的I期临床试验。LB1901是传奇生物开发的一款靶向CD4的自体嵌合抗原受体T细胞(CAR-T)疗法,拟用于治疗成人复发性和难治性外周T细胞淋巴瘤或皮肤T细胞淋巴瘤。该项临床由德克萨斯大学MD安德森癌症中心癌症医学部教授SwaminathanP.Iyer博士领导实施。截至目前,已有1例患者接受LB1901给药治疗。
国际药讯
1.FIC镰状细胞贫血新药获欧盟批准上市。欧盟委员会(EC)批准Global Blood Therapeutics(GBT)公司“first-in-class”口服疗法Oxbryta(voxelotor)上市,单药或与羟基脲联用,治疗12岁及以上镰状细胞病(SCD)患者的溶血性贫血。Oxbryta是首个被批准直接抑制镰状血红蛋白聚合的治疗药物,已于2019年11月获FDA加速批准上市。在美国,FDA还批准了Oxbryta片剂用于治疗4岁12岁的SCD儿童患者;批准Oxbryta口服混悬片剂用于4岁-12岁的儿科SCD患者。
2.辉瑞20价肺炎球菌疫苗获欧盟批准。欧洲药品管理局(EMA)批准辉瑞20价肺炎球菌结合疫苗(PCV20)上市,用于18岁及以上成人主动免疫接种,预防由疫苗中20种肺炎链球菌血清型引起的侵袭性疾病和肺炎。在美国,该疫苗已于去年6月获得批准,是首款获批可预防20种血清型引起的大多数侵袭性肺炎球菌病和肺炎的结合疫苗。PCV20在欧盟和美国分别以品牌名Apexxnar和Prevnar 20上市销售。
3.血清素反向激动剂在美重报sNDA。Acadia公司重新向FDA提交Nuplazid(pimavanserin)的补充新药申请(sNDA),拟用于治疗与阿尔茨海默精神病(ADP)相关的幻觉和妄想。Nuplazid是一款选择性血清素反向激动剂,是首个获批用于与帕金森病相关的幻觉和妄想的治疗药物。此前提交的sNDA中,Nuplazid拟用于治疗痴呆相关精神病。在重新提交的sNDA中,拟定的适应症从痴呆相关精神病缩小到了阿尔茨海默精神病(ADP)。
4.BMS心肌病疗法Ⅲ期临床积极。百时美施贵宝开发的FIC心肌肌球蛋白别构抑制剂mavacamten,在用于符合室间隔缩小治疗条件的症状性梗阻性肥厚型心肌病(oHCM)患者的Ⅲ期临床达到主要终点。与安慰剂相比,mavacamten治疗组第16周时仍然达到符合接受室间隔缩小治疗标准的患者比例显著更高。此前,FDA已授予mavacamten突破性疗法认定,并已受理其新药上市申请,PDUFA日期为今年4月28日。
5.AMN基因疗法获FDA快速通道资格。FDA授予SwanBio公司基于AAV的基因疗法SBT101快速通道资格,用于治疗肾上腺脊髓神经病(AMN)患者。AMN是一种成人期发病型进行性退行性脊髓疾病,由ABCD1基因突变引起。SBT101旨在补偿导致疾病的ABCD1突变,增加ABCD1表达,并降低AMN患者体内超长链脂肪酸(VLCFA)水平。在临床前研究中,SBT101在小鼠模型中显示AMN疾病标记物呈剂量依赖性改善;而且耐受性良好。
6.新型多黏菌素类抗生素早期临床积极。Spero公司新型多黏菌素类抗生素SPR206用于支气管肺泡灌洗(BAL)的Ⅰ期临床结果积极。SPR206总体耐受性良好,没有证据表明在预期的治疗剂量下存在肾毒性。SPR206平均肺泡上皮衬液 (ELF) 与血浆浓度之比为0.264;在给药期间,肺泡ELF中SPR206的平均浓度超过了针对革兰氏阴性病原体的SPR206 MIC(最小抑制浓度)。研究结果支持SPR206在医院获得性肺炎和呼吸机相关肺炎中的进一步开发。
7.Equillium公司收购Bioniz公司。Equillium公司宣布收购Bioniz Therapeutics。Bioniz公司专注于开发用于严重免疫炎症性疾病的创新疗法。通过收购,Equillium将获得后者两款潜在“first-in-class”候选药物BNZ-1、BNZ-2和临床前候选药物BNZ-3。BNZ-1是一款处于Ⅰ/Ⅱ期临床的IL-2/IL-9/IL-15三特异性抑制剂;BNZ-2是一款IL-15/IL-21选择性抑制剂;BNZ-3是一种拟用于胃肠道炎症的口服多肽疗法。
医药热点
1.中国首部抗肿瘤药物循证用药指南发布。北京大学第三医院药剂科赵荣生教授牵头主持制定的中国首部抗肿瘤药物(大剂量甲氨蝶呤)循证用药指南在英国British Journal of Clinical Pharmacology杂志正式发表。该指南提供涵盖大剂量甲氨蝶呤(HDMTX)临床用药全流程的28条推荐意见,涉及给药前评估、预处理与常规给药方案、治疗药物监测、亚叶酸钙解救以及不良反应管理与血液净化治疗,其中12条为强推荐。该指南为HDMTX全程个体化给药提供了全面的技术支撑和使用建议。
2.张旭院士工作站将落户南大一附院。南昌大学第一附属医院党委书记谭友文日前透露,中国科学院院士、中国人民解放军总医院泌尿外科医学部主任张旭教授已与南大一附院达成共识,计划将其国内唯一的院士工作站落户至南大一附院。张旭院士是全球著名的泌尿外科领域专家,长期致力于泌尿外科,尤其是微创腹腔镜技术和机器人手术在泌尿外科的应用研究及推广。院士工作站的落户将全面提升南大一附院在泌尿外科领域的综合实力和影响力。
评审动态
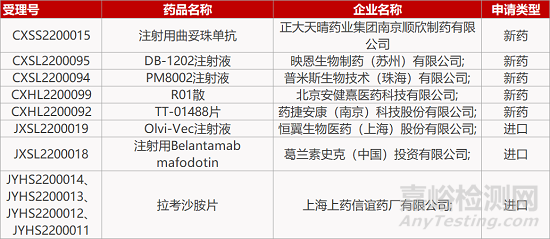
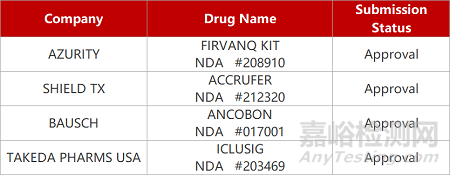

来源:药研发


