您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-02-15 10:37
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
1.歌礼利托那韦在欧洲多国报产。歌礼制药利托那韦(100毫克薄膜衣片)已向德国、法国、爱尔兰和英国药监部门递交了上市许可申请。其他包括在欧洲国家、北美国家和亚太国家的利托那韦的上市许可申请也预计将在近期递交。口服利托那韦片是针对病毒蛋白酶的多种口服抗病毒药物的药代动力学增强剂及口服抗病毒药物Paxlovid(奈玛特韦片+利托那韦片组合包装)的组成之一。
2.信达/驯鹿BCMA CAR-T获孤儿药资格。信达生物与驯鹿医疗联合开发的全人源BCMA CAR-T(IB1326,CT103A)获FDA授予孤儿药资格,用于治疗复发/难治性多发性骨髓瘤(R/R MM)。在ASH2021年会上公布的最新Ⅰ/Ⅱ期注册性临床数据显示,该疗法在79例R/R MM患者中的ORR达到94.9%,CR/sCR为58.2%;回输后6个月、9个月和12个月的PFS分别为78.0%、76.0%和71.0%。去年2月,CDE已将其纳入“突破性治疗药物”品种。
3.CLDN18.2靶向抗体在华获批新临床。安斯泰来Claudin 18.2(CLDN18.2)靶向抗体注射用zolbetuximab获国家药监局临床试验默示许可,拟联合白蛋白紫杉醇和吉西他滨,临床用于一线治疗Claudin18.2阳性转移性胰腺癌患者。全球范围内,zolbetuximab处于Ⅲ期临床开发阶段,正在一项全球多中心(含中国)Ⅲ期临床中评估用于治疗局部晚期不可切除或转移性、Claudin18.2阳性和HER2阴性的成人胃和胃食管交界(GEJ)腺癌的潜力。
4.圣和TIGIT/PD-L1双抗获批临床。圣和药业自主研发的治疗用生物制品1类新药SH006注射液获国家药监局临床许可,拟用于治疗晚期实体瘤。SH006是一款TIGIT/PD-L1双特异性抗体。临床前研究结果表明,SH006能够特异性阻断TIGIT-PVR及PD1-PDL1信号通路,通过双重作用机制解除肿瘤免疫抑制,在非小细胞肺癌、结直肠癌、淋巴瘤中具有显著的抗肿瘤活性。据悉,SH006是国内第二款申报临床的PD-L1/TIGIT双抗。
5.武汉朗来CFB抑制剂报IND。武汉朗来子公司上海美悦1类新药MY008211A片的临床试验申请获CDE受理。MY008211A是一款补体B因子(CFB)抑制剂,拟开发用于治疗阵发性睡眠性血红蛋白尿(PNH)、免疫球蛋白A肾病(IgA肾病)。在中国,PNH已被收录于2018年制定的《第一批罕见病目录》。目前全球共有三款CFB抑制剂处于临床阶段;国内尚无同类药物申请临床。
6.博腾与辉瑞签署43亿元大单。博腾股份于2月11日发布公司公告,宣布收到辉瑞的新一批《采购订单》,将为辉瑞提供合同定制研发生产(CDMO)服务。新获得订单金额合计6.81亿美元(约合43亿元人民币),超过博腾公司最近一个会计年度经审计营业收入的50%。目前该订单已生效,交付日期是2022年。2021年末,凯莱英先后宣布与辉瑞签署约30亿元、27亿元人民币的订单。这3个大单应都是新冠口服药Paxlovid。
国际药讯
1.礼来第三款新冠抗体获FDA紧急使用授权。礼来与Abcellera公司联合开发的广谱中和抗体bebtelovimab获FDA授予紧急使用授权(EUA),用于治疗轻中度新冠患者。这是礼来获得EUA的第三款中和抗体,维持了针对目前已知和报道的所有变异株的结合和中和活性,包括Omicron和BA.2。此次获批是基于一项Ⅱ期试验,评估bebtelovimab单药和bebtelovimab联合其他单抗治疗轻中度COVID-19的疗效。此前,礼来已与美国政府签订了60万剂bebtelovimab的订单,总金额高达7.2亿美元。
2.肺癌药物poziotinib在美报NDA。FDA受理Spectrum公司酪氨酸激酶抑制剂(TKI)poziotinib的新药申请,用于治疗携带HER2外显子20插入突变的经治非小细胞肺癌患者。在一项Ⅱ期临床中,poziotinib达到27.8%的确认ORR(95% CI,18.9%-38.2%),置信区间下限为18.9%,超过了预先规定的17%。中位缓解持续时间为5.1个月,中位PFS为5.5个月。安全性上,87%的患者发生治疗中断,11例因不良事件永久停药,13例发生治疗相关严重不良事件。poziotinib此前已获得治疗这类患者的快速通道资格。
3.礼来GIP/GLP-1激动剂Ⅲ期成果见刊JAMA。礼来新型每周一次的GIP/GLP-1激动剂tirzepatide(LY3298176),在用于治疗接受滴定甘精胰岛素治疗但血糖控制不足的2型糖尿病患者的Ⅲ期临床(SURPASS-5)中达到主要终点和关键次要终点。全部3种剂量tirzepatide均比安慰剂具有更好的降低血糖(A1C)和降低体重的效果。tirzepatide(5mg、10mg和15mg)治疗组达到A1C<7%的患者比例为85-90%(vs34%),A1C较基线分别降低了-2.11%、-2.40%和-2.34%(vs-1.47%),体重减轻-5.4千克、-7.5千克和-8.8千克(vs+1.6千克)。详细结果发表在《美国医学会杂志》上。目前,tirzepatide正在接受FDA和EMA的监管审查。
4.脑渗透酶替代疗法长期疗效积极。Denali公司酶替代疗法DNL310治疗II型黏多糖贮积症(MPS II,又名亨特综合征)的Ⅰ/Ⅱ期临床新数据积极。在给药长达一年时,脑脊液(CSF)溶酶体脂质生物标志物进一步降低,与溶酶体功能改善一致;大多数患者的总体MPS II症状、认知能力和行为较基线均出现临床改善;该药总体耐受良好,安全性特征与标准治疗保持一致。Denali计划今年上半年启动关键性Ⅱ/Ⅲ期临床试验。
5.Ventus公司完成新一轮融资。Ventus公司宣布完成1.4亿美元的C轮融资,以用于支持加速其结构免疫学ReSOLVE平台的发展,针对“不可成药”的蛋白靶点开发创新药物。Ventus的科学创始人之一是结构免疫学的专家,哈佛医学院生物化学与分子药理学系吴皓教授。Ventus计划在2023年为三个主要项目提交IND申请。其先导项目VENT-01是一款靶向NLRP3的外周限制性小分子抑制剂。
6.创新带状疱疹疫苗获6000万美元融资。疫苗开发公司Curevo Vaccine宣布完成6000万美元的A轮融资。该公司先导项目CRV-101是一款拟用于预防老年人带状疱疹的佐剂亚基疫苗。与使用灭活或减毒病毒的传统方法相比,佐剂亚基疫苗注射后不会引起感染。在Ⅰ期临床中,CRV-101显示出非常稳健的免疫原性,没有观察到3级的注射部位副作用。本轮融资主要用于推进这一疫苗的Ⅱb期临床试验。
医药热点
1.村医中执业医师占比新要求。近日,国务院印发的《“十四五”推进农业农村现代化规划的通知》中要求,在“基本医疗有保障”方面,巩固健康扶贫、医保扶贫成果,有效防范因病返贫致贫风险;稳步扩大乡村医疗卫生服务覆盖范围;到2025年,乡村医生中执业(助理)医师比例由2020年的38.5%增长到45%。
2.北京出台首个专门针对药监能力建设文件。北京市市场监督管理局日前正式印发《北京市全面加强药品监管能力建设的若干措施》。该《措施》包括健全协同高效的组织运行体系;健全完善地方法规标准体系;健全具有首都特色的审评检测体系;健全市区协同的检查执法体系;健全严谨高效的风险防控体系;健全科学有效的应急管理体系;健全创新便捷的智慧监管体系;提升服务发展能力;提升落实保障能力等9个部分共24项具体措施。《若干措施》是北京市出台的首个专门针对药品监管能力建设的政策文件。
3.欧洲药管局调查新冠疫苗接种后月经紊乱。欧洲药品管理局安全委员会近日宣布,正在审查两款mRNA新冠疫苗接种后,妇女出现大量月经出血和暂时停经的报告。该机构称,目前还不确定接种疫苗和月经紊乱是否存在因果关系。《太阳报》去年9月也曾报道,英国有近3万名女性在接种新冠疫苗后出现月经紊乱的现象,不过英国药品和医疗产品监管署(MHRA)并不认为相关症状属于疫苗不良反应。
评审动态
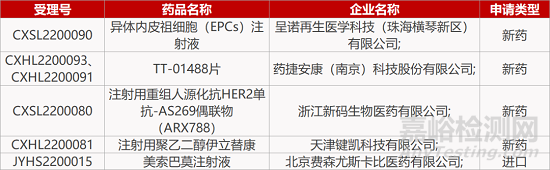
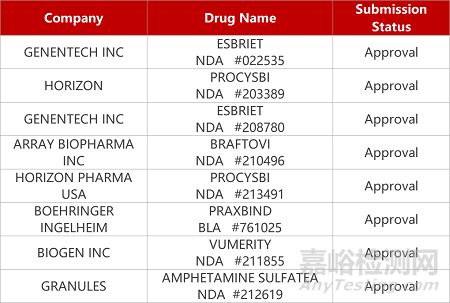
1. CDE新药受理情况(02月

来源:药研发


